近5年植物茎叶抗癌成分的研究概况
卫 强,阚聪慧
安徽新华学院药学院,合肥 230088
叶和茎是植物的重要器官。随着天然药物的研究和开发,活性成分的寻找已从植物根部转向茎叶部位,茎叶在某些功能表现上,可作为根的替代品,且具有可再生特点,有利于环境保护。当前,天然药物茎叶药品的开发方兴未艾,如山楂叶中总黄酮制成益心酮片,银杏叶提取物制成银杏叶片[1],汉桃叶提取物制成汉桃叶片,灯台叶制成灯台叶颗粒,枇杷叶制成枇杷叶膏,荷叶制成荷叶丸,以上六种药物均被收入2015年版《中国药典》。
中国男性和女性的癌症发病每年的总增长率分别为0.96%和0.84%,2011~2015年间的主要癌症类型有肺癌、结直肠癌、乳腺癌、肝癌、胃癌、宫颈癌、鼻咽癌、白血病和淋巴瘤,癌症防治已成为我国重要公共卫生问题[2]。寻找新的抗癌活性成分治疗癌症和提升癌症患者“五年存活率”是医学研究的难题。本研究按照苯丙素类、黄酮类、皂苷、萜类、其他成分进行分类,总结近5年植物茎叶中抗癌成分的研究概况,以期为该资源的开发与应用提供参考。
1 植物茎叶抗癌成分
1.1 苯丙素类抗癌成分
苯丙素类成分指苯环与三个直链碳相连构成的化合物,包括苯丙素、香豆素和木脂素,其中木脂素结构较为复杂。研究发现,五味子茎藤中五味子丙素、五味子乙素及五味子醇乙均具有抗肝癌作用[3]。荔枝叶分离的成分Sesquipinsapol B 和Sesquimarocanol B对鼻咽癌细胞显示细胞毒性,其中Sesquipinsapol B可抗肝癌和子宫颈癌,Sesquimarocanol B和Ehletianol C抗子宫颈癌[4]。傣药香面叶茎皮中香面叶木脂素A具有抗急性早幼粒细胞白血病和神经母细胞瘤作用[5]。枸杞茎中4-O-methylgrossamide和4-hydroxylgrossamide均可抗脑胶质母细胞瘤[6]。具体参数如表1所示。经结构分析,苯丙素类抗癌成分以木脂素为主,主要类型有联苯环辛烯型木脂素、木脂素、新木脂素。
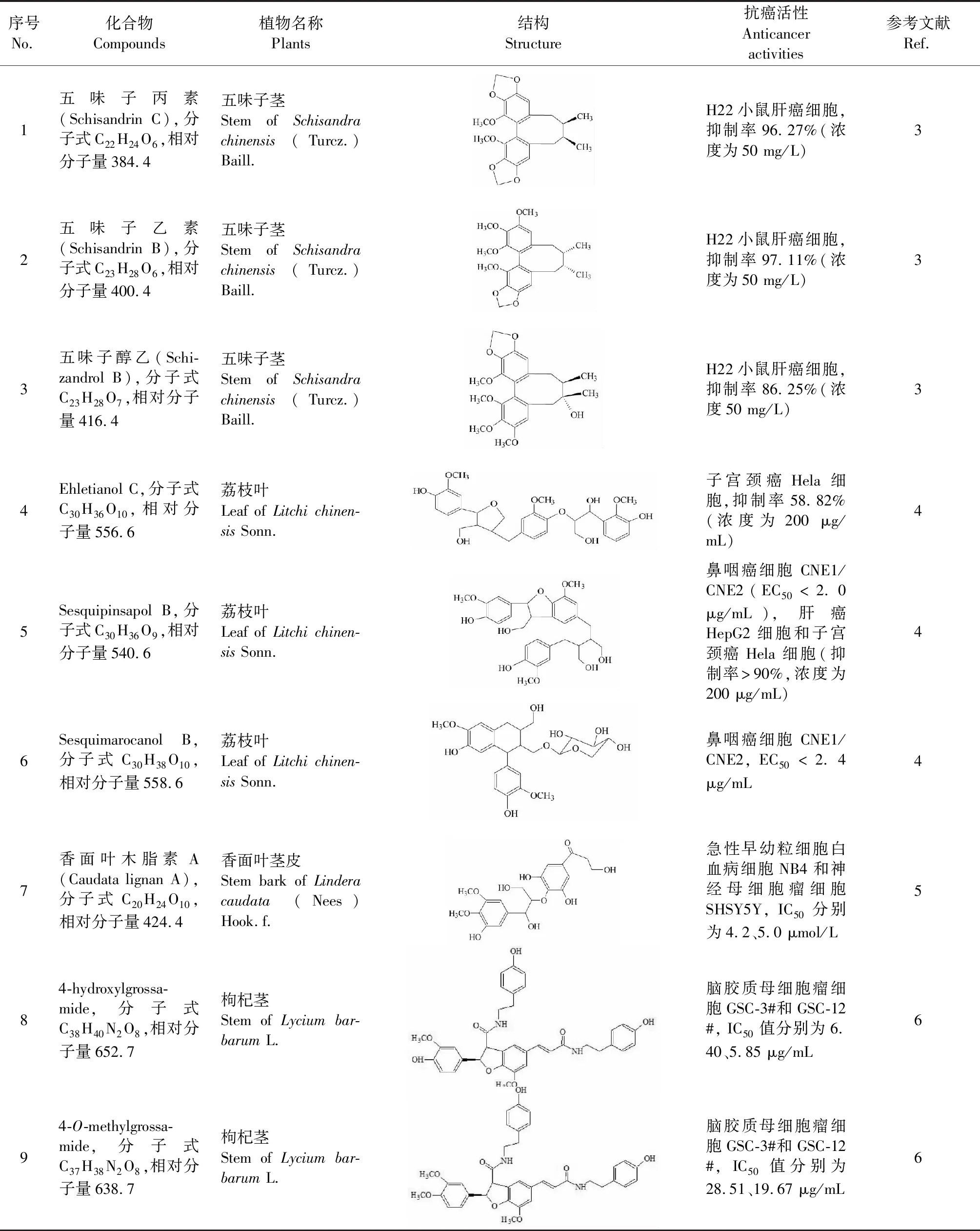
表1 苯丙素类抗癌成分
1.2 黄酮类抗癌成分
黄酮泛指两个具有酚羟基的苯环通过中央三碳原子相互连接而成的一类化合物。研究发现,莲梗(叶柄)中木犀草素-3′,4′-二甲基-7-O-β-D-葡萄糖苷、山柰酚-3-O-β-D-吡喃木糖(1→2)-β-D-葡萄糖苷、槲皮素-3,3′-O-二葡萄糖、异鼠李素-3-O-β-D-葡萄糖苷可抗肝癌[7]。从万寿菊叶中分离的4′-甲氧基-泽兰素-3-O-β-D-葡萄糖苷和山柰酚-3,7-O-α-L-双鼠李糖苷可抗胃癌和肝癌,使癌细胞形态发生改变,部分细胞发生凋亡[8]。薜荔茎中芹菜素和Alpinum isoflavone可抗乳腺癌[9]。醉鱼草中槲皮素可抗宫颈癌[10]。明日叶中查尔酮成分可抑制小鼠肝癌组织新血管生成,高剂量组与对照组(腹腔注射4 mg/kg恩度)的肝癌组织MVD计数分别为(4.5±1.286)与(9.9±1.175)[11]。具体参数如表2所示。经结构分析,黄酮类抗癌成分主要类型有黄酮、黄酮醇或黄酮苷、异黄酮、查耳酮。

表2 黄酮类抗癌成分
续表2(Continued Tab.2)
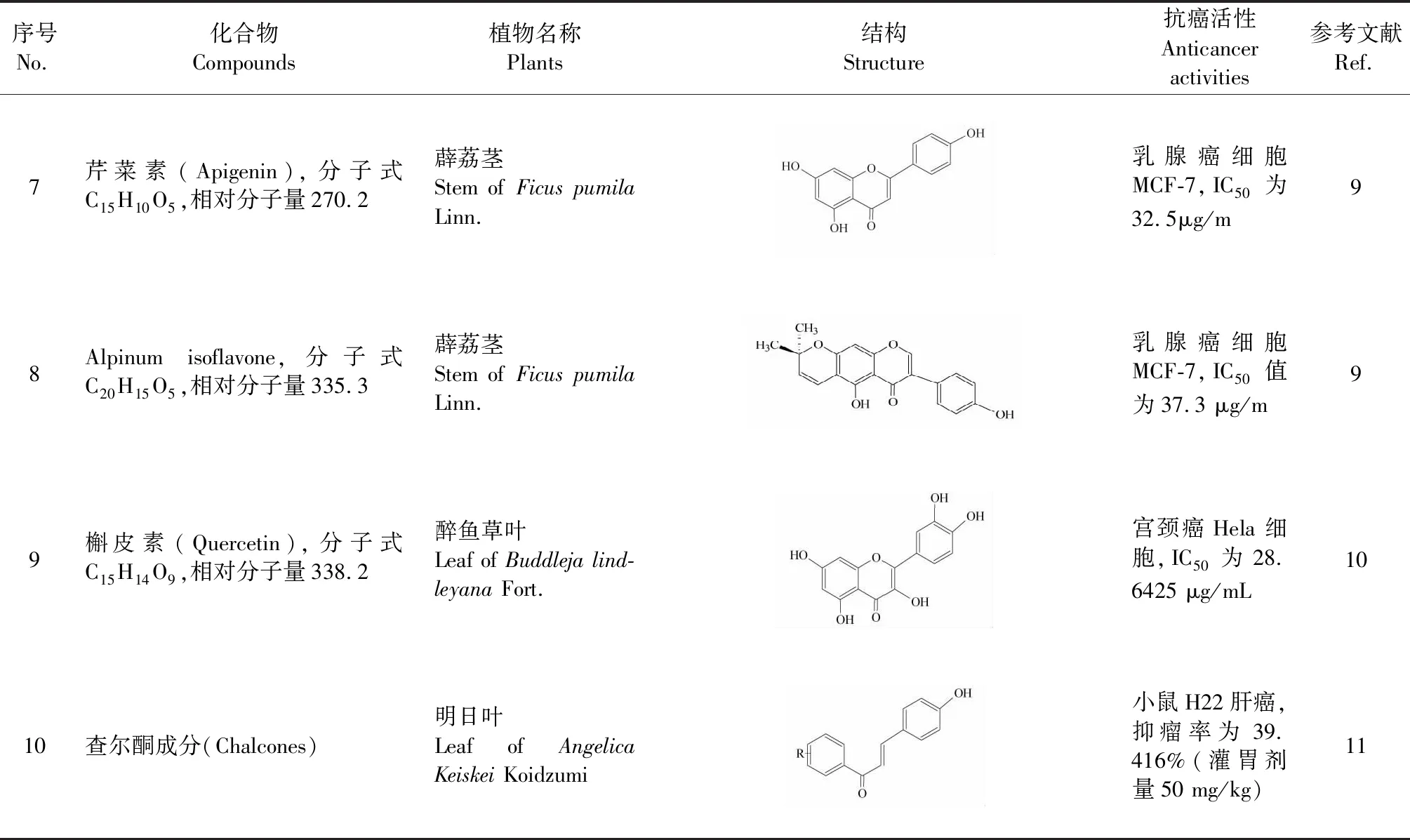
序号No.化合物Compounds植物名称Plants结构Structure抗癌活性Anticancer activities参考文献Ref.7芹菜素(Apigenin),分子式C15H10O5,相对分子量270.2薜荔茎Stem of Ficus pumila Linn.乳腺癌细胞MCF-7,IC50为32.5μg/m98Alpinum isoflavone,分子式C20H15O5,相对分子量335.3薜荔茎Stem of Ficus pumila Linn.乳腺癌细胞MCF-7,IC50值为37.3 μg/m99槲皮素(Quercetin),分子式C15H14O9,相对分子量338.2醉鱼草叶Leaf of Buddleja lind-leyana Fort.宫颈癌Hela细胞,IC50为28.6425 μg/mL1010查尔酮成分(Chalcones)明日叶Leaf of Angelica Keiskei Koidzumi小鼠H22肝癌,抑瘤率为39.416%(灌胃剂量50 mg/kg)11
1.3 皂苷、萜类抗癌成分
1.3.1 皂苷
皂苷包括三萜皂苷和甾体皂苷,前者主要以五环或四环为特征,后者以螺甾烷为特征。研究发现,辽东楤木叶中皂苷成分体外抗血癌细胞HL60、肺腺癌细胞A549 和前列腺癌细胞DU145的实验研究,证明各种皂苷显示出一定的毒活性。其中3-O-β-D-吡喃葡萄糖基(1→4)-β-D-吡喃葡萄糖基齐墩果酸抗急性早幼粒白血病、 肺癌和前列腺癌作用较强[12]。毛果南烛叶中3β-O-α-L-阿拉伯吡喃糖氧基-齐墩果-12-烯-1β,23-二醇成分可抑制早幼粒白血病、乳腺癌、肝癌、肺癌和结肠癌细胞的增殖,其中抑制乳腺癌细胞MCF-7、肺癌细胞A-549 和结肠癌细胞SW480的活性均强于顺铂[13]。匙羹藤茎中Gymsylvestroside A、Gymsylvestroside B、Gymsylvestroside C、Gymsylvestroside D成分可抗慢性髓系白血病[14]。云南鼠尾草中马斯里酸(又名山楂酸)、熊果酸可抑制鸡胚绒毛尿囊膜新生血管,构效关系研究发现C-28的羧基和C-3位的羟基是齐敦果烷型或乌苏烷型三萜类化合物具有抗血管生成活性的必需基团[15]。忧遁草新鲜枝叶中羽扇豆醇可抗肝癌[16]。琼岛染木树茎中3-乙酰基齐墩果醛可抗小鼠黑色素瘤,21-H-Hop-22(29)-ene-3,30-diol可抗乳腺癌。另分离的成分3α,6α,30-trihydroxy-ursan-28-oic acid、3α,30-dihydroxy-6-one-ursan-28-oic acid、3α,6α,7α,30-trihydroxy-ursan-28-oic acid可抗肺癌和小鼠黑色素瘤,其中3α,30-dihydroxy-6-one-ursan-28-oic acid可抗乳腺癌和肝癌[17]。马甲子叶中马甲子素A(2α-O-顺式对羟基肉桂酰基-3α-羟基-27-O-反式对羟基肉桂酰基白桦脂酸)、Messagenic acid A、马甲子素B(2α-O-反式对羟基肉桂酰基-3α-羟基-27-O-顺式对羟基肉桂酰基白桦脂酸)可抗肝癌[18]。具体参数如表3所示。经结构分析,皂苷类抗癌成分以三萜皂苷为主,其结构类型有齐墩果酸、乌苏酸、羽扇豆醇。甾体皂苷较少,以C21甾醇为主。
1.3.2 萜类
萜类由甲戊二羟酸衍生,以异戊二烯为结构单元。研究发现,雷公藤叶中二萜成分Tripterlide F、异雷公藤内酯醇、雷公藤内酯醇、雷醇内酯、雷公藤乙素可抑制缺氧诱导因子-1(HIF-1)而抗神经胶质瘤。另分离的Triptersinine N和Triptersinine O成分均可抑制结肠癌细胞。Tripterlide F、雷公藤内酯醇、雷醇内酯成分均可抗5种癌症(结肠癌、肝癌、胃癌、肺癌和卵巢癌)[19]。具体参数如表3所示。经结构分析,萜类抗癌成分结构类型有三环二萜、双环倍半萜。

表3 皂苷、萜类类抗癌成分
续表3(Continued Tab.3)

序号No.化合物Compounds植物名称Plants结构Structure抗癌活性Anticancer activities参考文献Ref.7山楂酸(2α,3β-di-hydroxyursa-12-en-28-oic acid),分子式C30H48O4,相对分子量472.7 云南鼠尾草地上部分Leaf of Salvia yunnanensis C.H.Wright鸡胚绒毛尿囊膜血管新生(浓度0.8 nmol/egg)158熊果酸(Ursolic acid),分子式C30H48O3,相对分子量456.7云南鼠尾草地上部分Leaf of Salvia yunnanensis C.H.Wright鸡胚绒毛尿囊膜血管新生(浓度0.8 nmol/egg)159羽扇豆醇(Lupeol),分子式C30H50O5,相对分子量490.7忧遁草叶Leaf of Clina-canthus nutans(Burm.f.)Lin-dau肝癌细胞BEL-7402,IC50为42.5 μmol/L16103-乙酰基齐墩果醛(3-O-acetyl oleanolic aldehyde),分子式C32H49O3,相对分子量481.7琼岛染木树茎Stem of Sapros mamerrillii Lo.黑色素瘤HEPG2,IC50值为41.78 μg/mL17113α,6α,30-trihydroxy-ursan-28-oic acid,分子式C30H48O5,相对分子量488.7琼岛染木树茎Stem of Sapros mamerrillii Lo.肺癌细胞A549、黑色素瘤B16F10,IC50分别为280.56、37.33 μg/mL17123α,30-dihydroxy-6-one-ursan-28-oic acid,分子式C30H46O5,相对分子量486.6琼岛染木树茎Stem of Sapros mamerrillii Lo.肺癌细胞A549、黑色素瘤B16F10,IC50分别为312.61、211.07 μg/mL;乳腺癌细胞MDA-MB-231和肝癌细胞HEPG2,IC50分别为170.58、65.35 μg/mL17 133α,6α,7α,30-trihy-droxy-ursan-28-oicac-id,分子式C30H48O6,相对分子量504.7琼岛染木树茎Stem of Sapros mamerrillii Lo.肺癌细胞A549、黑色素瘤B16F10,68.40,IC50分别为129.47 μg/mL171421-H-Hop-22(29)-ene-3,30-diol,分子式C30H50O2,相对分子量442.7琼岛染木树茎Stem of Sapros mamerrillii Lo.乳腺癌细胞MDA-MB-231,IC50值为91.35 μg/mL1715马甲子素A(Pali-urusene A),分子式C48H60O9,相对分子量780.9马甲子叶Leaf of Paliurus ramosissimus (Lour.) Poir.肝癌细胞BEL7404、肝癌细胞 QGY7703,IC50值分别为3.87、5.44 μmol/L18
续表3(Continued Tab.3)

序号No.化合物Compounds植物名称Plants结构Structure抗癌活性Anticancer activities参考文献Ref.16Messagenic acid A,分子式C39H54O6,相对分子量618.8马甲子叶Leaf of Paliurus ramosissimus (Lour.) Poir.肝癌细胞BEL7404、肝癌细胞 QGY7703,IC50分别为5.49、13.88 μmol/L1817马甲子素B(Pali-urusene B),分子式C48H60O9,相对分子量780.9马甲子叶Leaf of Paliurus ramosissimus (Lour.) Poir.肝癌细胞BEL7404、肝癌细胞 QGY7703,IC50分别为2.50、4.23 μmol/L1818Tripterlide F,分子式C19H18O6,相对分子量342.3雷公藤叶Leaf of Triptery-gium wilfordii HOOK.F.HIF-1、结肠癌细胞HCT-116、肝癌细胞HepG2、胃癌细胞BGC-823、肺癌细胞H460、卵巢癌细胞A2780,IC50分别为9.82、0.90、0.63、0.85、0.17、2.30 μmol/L1919异雷公藤内酯醇(Isotriptolide),分子式C20H21O6,相对分子量357.3 雷公藤叶Leaf of Triptery-gium wilfordii HOOK.F.HIF-1、胃癌细胞BGC-823,IC50分别为5.87、0.34 μmol/L1920雷公藤内酯醇(Trip-tolide),分子式C20H22O6,相对分子量358.3雷公藤叶Leaf of Triptery-gium wilfordii HOOK.F.HIF-1、结肠癌细胞HCT-116、肝癌细胞HepG2、胃癌细胞BGC-823、肺癌细胞H460、卵巢癌细胞A2780,IC50均小于0.1 μmol/L1921雷醇内酯(Wilfor-lide),分子式C20H22O7,相对分子量374.3 雷公藤叶Leaf of Triptery-gium wilfordii HOOK.F.HIF-1、结肠癌细胞HCT-116、肝癌细胞HepG2、胃癌细胞BGC-823、肺癌细胞H460、卵巢癌细胞A2780,IC50分别为0.06、0.39、0.77、0.20、2.16、0.41 μmol/L1922雷公藤乙素(Tripdi-olide),分子式C20H22O6,相对分子量358.3雷公藤叶Leaf of Triptery-gium wilfordii HOOK.F.HIF-1,IC50为0.17 μmol/L1923Triptersinine N,分子式C35H37NO14,相对分子量695.6雷公藤叶Leaf of Triptery-gium wilfordii HOOK.F.结肠癌细胞HCT-116,IC50为7.56 μmol/L1924Triptersinine O,分子式C35H37NO14,相对分子量695.6雷公藤叶Leaf of Triptery-gium wilfordii HOOK.F.结肠癌细胞HCT-116,IC50为5.73 μmol/L19
1.4 其他抗癌成分
研究发现,滇重楼叶总皂苷提取物可抗肝癌,呈现时间、剂量依赖效应,能阻滞细胞周期于S期,诱导细胞凋亡。但其诱导凋亡作用仅高剂量组(≥80 μg/mL)效果显著,处理组多数细胞核褶皱,常染色质固缩浓染,或呈边集化、新月状[20]。人参叶总皂苷以灵芝斜面菌发酵可使人参皂苷Rh1、Rd、Rg3和CK水平呈总体上升趋势,其中人参皂苷Rh1水平增幅最大,增加408.88%。人参茎叶发酵后提取物可抗肝癌[21]。6月和7月胡桃揪叶的杜尔贝科改良伊格尔培养基(Dulbecco,s modified eagle medium,DMEM)提取物可抗乳腺癌,药物浓度增大可使癌细胞碎裂,胞质变得粗糙,细胞与细胞之间的粘附性降低,细胞死亡数明显増多[22]。紫薇叶氯仿部位可抑制肝癌细胞,乙酸乙酯部位可抗肝癌和卵巢癌[23]。毛果鱼藤茎氯仿部位可抗宫颈癌[24]。亮叶杨桐叶和杨桐叶80%丙酮提取物均可抗肝癌和乳腺癌[25]。文冠果叶70%乙醇提取物抗肝癌活性较强[26]。香茶菜属植物PlectranthusstocksiiHook.f.叶和茎乙酸乙酯提取物可抗乳腺癌和克隆结肠癌,当浓度高于30 μg/mL时,抑制率达到90%[27]。单面针茎氯仿、正丁醇和乙酸乙酯浸膏均可抑制乳腺癌细胞[28]。玉米叶甲醇/氯仿提取物可促进喉癌细胞的调亡[29]。番木瓜叶经人工唾液、人工胃液和人工肠液消化,所得提取物可抗前列腺癌。其提取物中等极性部分(0.003~0.03 mg/mL)作用72 h,可抑制前列腺细胞,有利于治疗前列腺疾病(包括前列腺癌)。流式细胞仪分析显示,液汁阻滞于癌细胞S期周期可能是其作用机制[30]。
细胞凋亡的发生是一个极其复杂的、多基因参与调控的过程。在细胞发生凋亡早期,线粒体膜通透性增加,引起外膜的破裂,导致线粒体不可逆的损伤,释放细胞色素C等,激活caspase级联反应引发细胞凋亡。鱼腥草地下茎95%乙醇提取物可抗胃癌,其机制可能是提高p53的表达,促进凋亡因子Bax、Bid、Bak表达上调,抑制凋亡因子Bcl-2 表达下调,调节线粒体膜电位的变化,进而诱导细胞凋亡。提取物也可使胃癌细胞SGC-7901中caspase-3和caspase-9的活性增加,可能通过影响线粒体的功能,激活线粒体凋亡途径诱导 SGC-7901 细胞凋亡[31]。
肿瘤的生长需要新生血管形成以获取血供。研究发现,NO通过促进肿瘤血管形成、内皮细胞黏附和增加血管通透性而加速肿瘤的生长和转移[32]。一氧化氮合酶(NOS)氧化L-精氨酸产生NO,NO与鸟苷酸环化酶(c GMPase)结合,催化产生环磷酸鸟苷(c GMP),使胞内c GMP浓度升高,激活蛋白激酶G(PKG),介导细胞内c GMP的信号转导[33],如松弛血管平滑肌,降低血管张力,增加微循环通透性,改变基质成分,迁移内皮细胞,促使肿瘤血管生成[34]。因此,NO、NOS 和cGMP在肿瘤新生血管形成中发挥重要调节作用[35]。榄绿粗叶木茎甲醇提取物可抗食管癌,浓度增加可使食管癌细胞EC-9706的NO活性及NOS、c GMP含量下降[36]。
肿瘤干细胞高表达中NF-E2相关因子2(Nrf2)介导抗氧化酶,从而保留相对低水平的活性氧(ROS),抗肿瘤药物可利用ROS如一个兵工厂一样杀死癌细胞。日本栗叶甲醇提取物可抗乳腺癌,通过抑制Nrf2信号通路提高乳腺癌干细胞对紫杉醇的敏感性[37]。
抗癌其他成分具体参数如表4所示。

表4 其他抗癌成分
续表4(Continued Tab.4)

序号No.其他成分及植物Other components and plants抗癌活性Anticancer activities参考文献Ref.5乙酸乙酯提取物(紫薇叶)Ethyl acetate extract (Leaf of Lagerstroemia indica L.)肝癌细胞HepG2和卵巢癌细胞A2780,IC50分别为43.261、46.673 μg/mL236氯仿提取物(毛果鱼藤茎)Chloroform extract (Stem of Derris eriocarpa How)宫颈癌Hela细胞,IC50值为0.09 mg/mL24780%丙酮提取物(杨桐叶、亮叶杨桐叶)80% acetone ex-tract[Leaf of Adinandra nitida Merr.ex H.L.Li and A.Mil-lettii (Hook.&Arn.) (Benth.& Hook.f.ex Hance)]肝癌HepG2细胞,IC50分别为1.05、1.49 mg/mL;乳腺癌细胞MCF-7,IC50分别为2.26、2.43 mg/mL25870%乙醇提取物(文冠果叶)70% ethanol extract (Leaf of Xanthoceras sorbifolia Bunge)肝癌细胞HepG2,抑制率为74.27%(浓度为2.5 mg/L)269乙酸乙酯提取物Ethyl acetate extract(Plectranthus stocksii Hook.f.叶和茎) (Leaf and stem of Plectranthus stocksii Hook.f.)克隆结肠癌Caco-2细胞,叶和茎乙酸乙酯提取物IC50分别为36.08、38.14 μg/mL;乳腺癌细胞MCF-7,叶乙酸乙酯提取物IC50为48.87 μg/mL2710氯仿、正丁醇、乙酸乙酯萃取物(单面针茎)Chloroform,n-butanol and ethyl acetate extract (Stem of Zanthoxylum dissitum Hemsl )乳腺癌细胞MCF-7,氯仿浸膏、正丁醇浸膏、乙酸乙酯浸膏IC50分别为0.235、0.319、0.647 mg/mL2811甲醇提取物(玉米叶)Methanol extract(Zea mays L.)喉癌Hep2细胞,吉姆萨染色、碘化丙啶染色、氨乙苯啡啶染色显示分别使H2O2处理后的喉癌Hep2细胞凋亡率增加94%、160%、153%(浓度为20 mg/mL)2912经人工唾液、人工胃液、人工肠液消化提取物(番木瓜叶)Extract digested by artificial human saliva,gastric phase of digestion and intestinal juice (Leaf of Carica papaya L.)前列腺细胞,IC50值为0.02~0.07 mg/mL)301395%乙醇提取物(鱼腥草地下茎)95% ethanol extract(Subterraneous stem of Houttuynia cordata Thunb.)胃癌细胞SGC-7901,抑制率达80%(浓度为800 mg/L)3114甲醇提取物(榄绿粗叶木茎)Methanol extract [Leaf of Lasianthus japonicus Miq.var.lancilimbus (Merr.) L.]食管癌EC-9706细胞,72 h抑制率分别为64.76%、82.92%(浓度分别为0.2、0.4 mg/L)3615二甲基亚砜提取物(日本栗叶)DMSO extract(Leaf of Castanea crenata )乳腺癌细胞MCF-7,降低乳腺癌Nrf2的核迁移,抑制抗氧化酶蛋白的表达(浓度为50 μg/mL时)37
2 结论
植物茎叶抗癌成分的分类和总结表明,其主要特点有:一方面植物茎叶成分抗癌的活性较强。如荔枝叶中Sesquipinsapol B 和Sesquimarocanol B,香面叶茎皮中香面叶木脂素A成分等。另一方面植物茎叶抗癌成分的结构规律性较强,可作为先导化合物。本研究中发现联苯环辛烯、木脂素、新木脂素、黄酮、黄酮醇或黄酮苷、异黄酮、查耳酮、齐墩果酸、乌苏酸、羽扇豆醇、三环二萜、双环倍半萜等多种结构。如Sesquimarocanol B属木脂素结构,与鬼臼毒素糖苷化衍生物α-pelatatin-β-D-glucoside结构类似,后者抑制人口腔表皮样癌细胞KB的EC50值为1.1 μg/mL[38]。另据报道,对全球抗癌领域的专利进行分析,采用二维象限法共识别抗癌重点子领域分别是天然抗癌药、微生物抗癌药、肿瘤电子医疗器械以及癌症诊断与手术技术[39],天然抗癌药领域的重点技术有抗癌药活性、酶或微生物的检测及制备方法、天然来源药物的制剂技术、细胞及组织培养技术、药物载体技术[40],反映天然抗癌药物研究与开发仍然处于相对活跃期,但越来越依赖相关技术的支撑。因此,目前植物茎叶中抗癌活性成分的筛选多停留在药理活性验证阶段,需要以现有活性成分为先导,依托关键技术进行广泛验证和多重筛选,结合临床验证和科学统计,才能实现其临床应用价值。

