烟管头草粗提物体外抗前列腺增生活性及机制研究
王 坤,吴 琼,耿 瑞,王梦玲,马佑芬,骆 衡,*,晏 晨
1贵州省中国科学院天然产物化学重点实验室,贵阳 550002;2毕节医学高等专科学校,毕节 551700; 3遵义医学院,遵义 563006;4德江县民族中医院,德江 565200;5安顺市人民医院,安顺 561000
烟管头草为菊科(Asteraceae)天名精属一或两年生草本,高40~90 cm。茎直立,多分枝,全株密被白毛,单叶互生,全缘或波状齿,根粗叶大而狭长,柄短,下部叶长椭圆形,上部较小,广被针形。头状花序单生在小枝顶端,初直立,开花时多下垂;总苞片淡绿色,外层总苞片叶状,内层干膜质 ;花黄色片,全为管状花。瘦果线形有条纹[1]。烟管头草具有清热解毒、消肿止痛的功效,主治感冒发热、高热惊风、咽喉肿痛、痄腮、牙痛、尿路感染、淋巴结核、疮疡疖肿、乳腺炎等,贵州苗族地区将其作为民族药野烟叶使用[2]。烟管头草的化学成分主要有倍半萜、黄酮、苯酚、甾体、木脂素、三萜、香豆素等[3]。研究表明导致前列腺增生主要因素有生长因子通路与激素变化,治疗前列腺增生目前有药物治疗与手术治疗,并且近年来,药物治疗成为学者治疗前列腺增生研究热点,但烟管头草治疗前列腺增生的研究及活性成分鲜有报道,并且本研究预实验表明,烟管头草粗提物对前列腺增生细胞(BPH1)增殖有抑制作用,有凋亡现象。因此,本研究就烟管头草粗提物对前列腺增生细胞的增殖、侵袭、凋亡进行初步探究,确定其是否可诱导前列腺增生细胞(BPH1)凋亡,并从调控前列腺增生细胞凋亡Wnt信号通路中关键基因的表达的角度探讨其可能的抗前列腺增殖分子机制[4],以期望为进一步研究烟管头草的抗前列腺增殖活性成分及其机制奠定基础。
1 实验材料
1.1 实验试剂
DEME高糖培养基(HyClone,美国,AC10254368);0.25% Trypsin胰酶(HyClone,美国,T1320);胎牛血清(杭州四季青公司,中国,20171221);四甲基偶氮唑蓝(3-(4,5-Dimethyl-thiazol-2-yl-tetrazolium bromide;MTT) (Sigma 公司,美国,G1724034);二甲基亚砜(北京索莱宝科技有限公司产品,中国,D8370);青链霉素混合液(北京索莱宝科技有限公司产品,中国,20171222);Gold view I型核酸染料(北京索莱宝科技有限公司产品,中国,G8140);Wnt通路基因(β-catenin、C-myc、SFRPS2、CyclinD1、ddk1、fzd2 、GAPDH)引物(上海生工科技有限公司,中国);琼脂糖(BIOWEST公司,中国,111860);DNA Ladder抽提试剂盒(碧云天生物技术公司,中国,C0007);Hoechest染色试剂盒(碧云天生物技术公司,中国,C0003);Matrigel® Matrix(Corning公司,美国,356234);50×TAE(康为世纪生物科技有限公司,中国,CW06635);Super DNA Marker(康为世纪生物科技有限公司,中国,CW25835)。其它相关试剂为分析纯级别的国产试剂。
1.2 实验仪器
荧光倒置显微镜(卡尔·蔡司股份公司,德国);倒置显微镜(ECLIPSE TS100-F)(日本尼康有限公司产品,日本,ECLIPSE TS100-F);NANODROP 2000(赛默飞世尔科技公司,中国);超净台(赛默飞世尔科技公司,中国,1384);培养箱(赛默飞世尔科技公司,中国3111);高速离心机(BECKMAN COULTER公司,美国);凝胶成像仪(Gene Company Limited,中国香港);电泳仪(北京君意东方电泳设备有限公司,JY300HE);PCR仪(Applied Biosystems(ABI),美国,9902)。
1.3 烟管头草粗提物的制备
样品采自贵州省安顺市镇宁县,经贵阳中医学院孙庆文教授鉴定为菊科(Asteraceae)天名精属(CarpesiumL.)植物烟管头草(Carpesiumcernuum)。黔产药用烟管头草的提取:黔产药用烟管头草(Carpesiumcernuum)的全草干重20.0 kg,用95% 的工业乙醇将粉碎后的药材加热回流提取,每次3 h,共提取3次,将提取液合并,回收CH3CH2OH。然后加水使浓缩液呈悬浮状态,用乙酸乙酯萃取,得乙酸乙酯萃取液与水层,乙酸乙酯萃取物616 g,-4 ℃保存备用。
2 实验方法
2.1 细胞培养
所用的细胞株由贵州省中国科学院天然产物重点实验室肿瘤药理课题组保存。将保存的人前列腺增生BPH1细胞于37 ℃ 水浴中迅速解冻,离心收集细胞后,用含10% 胎牛血清及1% 青霉素、1% 链霉素的DMEM高糖培养基,于37 ℃、5% CO2恒温饱和湿度培养箱中培养。当细胞80% 汇合时进行传代及保种,选取对数生长期细胞进行实验。
2.2 MTT检测
取对数生长期细胞,离心收集细胞,加入新的培养液调整细胞浓度至1×104个/mL,接种于96孔培养板中,每孔加入190 μL细胞液,分别设置3个复孔,设置空白组与对照组,于37 ℃、5% CO2恒温饱和湿度下培养至细胞贴壁,吸干培养液,加入用新鲜培养液配好的各浓度的提取物,对照组为同比例稀释的DMSO,空白组加入同体积培养液,分别继续培养24、48、72 h后,3 200 rpm离心15 min,加入20 μL MTT,继续培养4 h后,1 500 rpm离心8 min,吸出培养液,每孔加150 μL DMSO溶解结晶物,摇床低速震荡10 min,采用多功能酶标仪于490 nm处检测其OD值,并计算其细胞增殖抑制率[5,6]。
2.3 Tanswell检测
4 ℃解冻Matrigel胶,使其成为液体;用无血清的DMEM培养基将Matrigel胶按照7∶1比例稀释;每孔加入50 μL稀释的Matrigel于Tanswell小室滤膜上层。37 ℃、5% CO2孵育30 min。将对数期的细胞离心收集,用培养基将收集的细胞稀释成1×104个/mL,将细胞与不同浓度提取物混匀接种于上层无血清的培养液中,下层为含血清的培养液。培养24 h;取出小室,用生理盐水冲洗3次,用棉签小心擦去小室Matrigel胶,加入无水甲醇浸泡10min;室温静置15 min,每孔加入300 μL 0.1%的结晶紫染色30 min,生理盐水冲洗3次,晾干,取染色的小室显微观察拍照,分别取上下左右及中间五个视野计数,多次重复求平均值,并作统计学分析[7]。
2.4 HE染色
取洁净的盖玻片在75% 乙醇中浸泡5 min,无菌超净台内用0.9%生理盐水冲洗三次,再用培养液冲洗一次,将洗净灭菌的盖玻片平置于六孔板内。将对数期收集并稀释为1×104个/mL的细胞悬液2 mL接种于上述的六孔板中,37 ℃、5% CO2培养待其贴壁后,加入不同浓度的提取物继续培养24 h后,离心后吸去大部分液体保留50 μL液体,再缓缓悬起细胞,滴加至载玻片上尽量使细胞分布均匀;加入0.5 mL固定液,固定10 min;去固定液,用0.9% 生理盐水冲洗两次,每次3 min;加入0.5 mL Hoechst 33258染色液振动染色5 min;去染色液,用0.9% 生理盐水洗两次,每次3 min,吸尽液体,加入一滴抗荧光淬火封片液于载玻片上,盖上贴有细胞的盖玻片,荧光显微镜检测其细胞核的变化[8]。
2.5 DNA Ladder检测
取对数期生长的细胞,制成细胞悬液,调整细胞浓度为1×105个/mL;将细胞接种于培养瓶中,继续培养,待细胞生长贴壁后,加入不同浓度的提取物,DMSO处理为空白对照,培养48 h后用胰酶消化,用生理盐水冲洗1次,1 500 g离心2 min,弃上清,收集细胞;用DNA Ladder抽提试剂盒抽提DNA,1%琼脂糖凝胶电泳检测其DNA损伤程度[9]。
2.6 RT-PCR检测细胞基因表达
收集不同浓度提取物处理48 h的细胞,按照文献[10]报道方法去取总RNA,1% 的琼脂糖电泳液检测RNA的完整性。利用逆转录试剂盒将其逆转录成cDNA。以GAPDH为内参,按照文献[10],利用1% 的琼脂糖电泳液检测不同基因(引物序列见表1)的PCR产物,凝胶成像分析差异表达结果[11]。
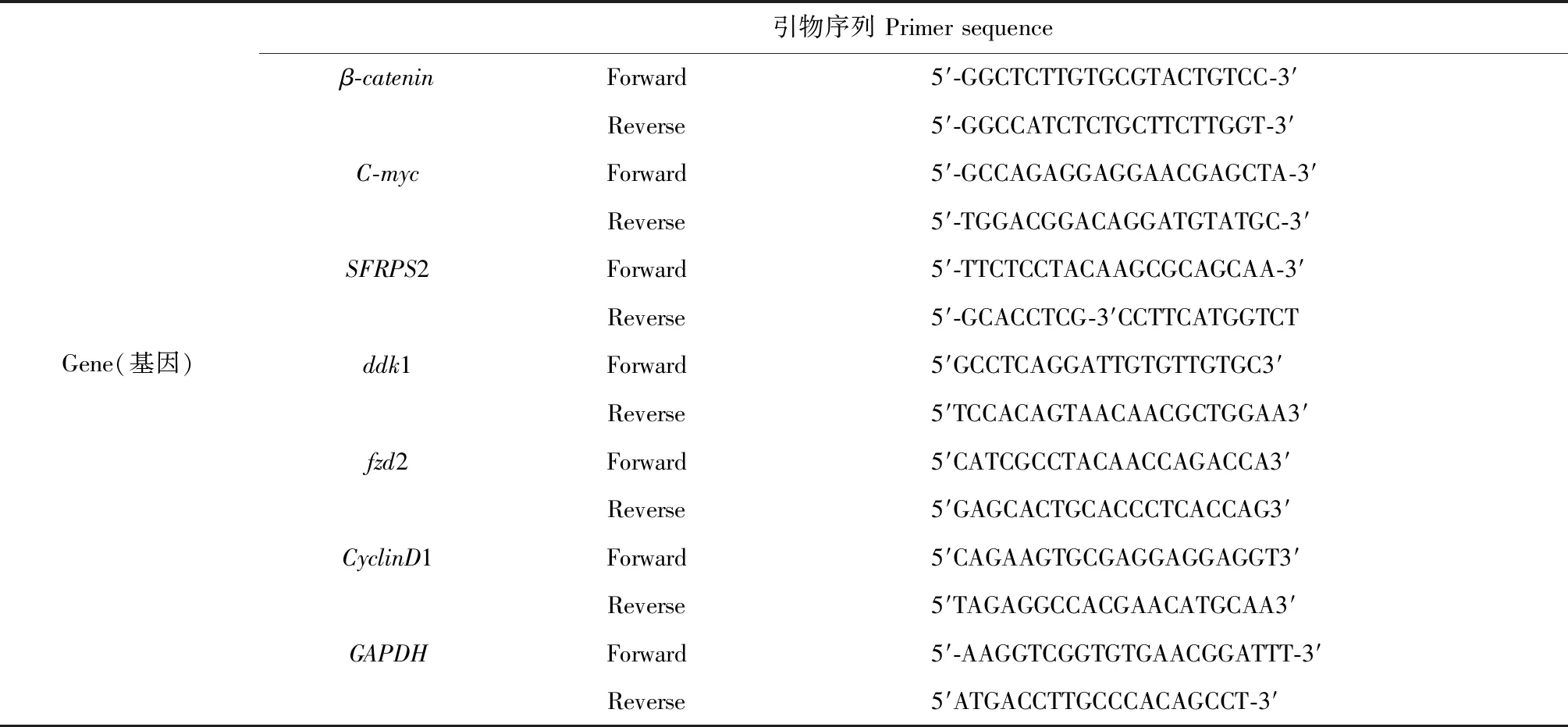
表1 本研究中检测的相关基因的引物序列
2.7 统计学分析
所有的数据处理采用SPSS 22.0 软件(IBM SPSS Statistics 22.0,USA)做统计学分析,所有结果以均值表示。采用F-检验进行差异性分析,显著差异表示为(*P< 0.05;**P< 0.01)。
3 结果
3.1 烟管头草粗提物对前列腺增生(BPH1)细胞增殖活性的影响
倒置显微(×100)观察不同浓度处理对BPH1细胞生长及形态的影响(图1 A),正常(Control)细组胞贴壁生长,呈带状或条状,胞质饱满,细胞融合成群落;而实验组细胞数量减少,间隙增大,体积减小,染色质凝聚、有凋亡小体出现等特点,并且作用效果成浓度依赖性,即浓度越大,药物度对BPH1细胞作用越明显。MTT检测烟管头草粗提物对BPH1细胞增殖的影响(图1 B)实验表明,粗提物对细胞作用呈现浓度和时间依赖性,也即作用效果与浓度和时间成正相关。经IBM SPSS Statistics 22.0软件分析,作出IC50值图(图1 C),实验组24 h、48 h、72 h的IC50值分别为72.76 μg/L、30.42 μg/L、25.69 μg/L,表明实验组IC50值与时间成负相关,即时间越长,浓度越小,并且与24 h组比较,48 h与72 h差异性显著(*P< 0.05)。因此,烟管头草粗提物对前列腺增生细胞增殖活性有显著影响。
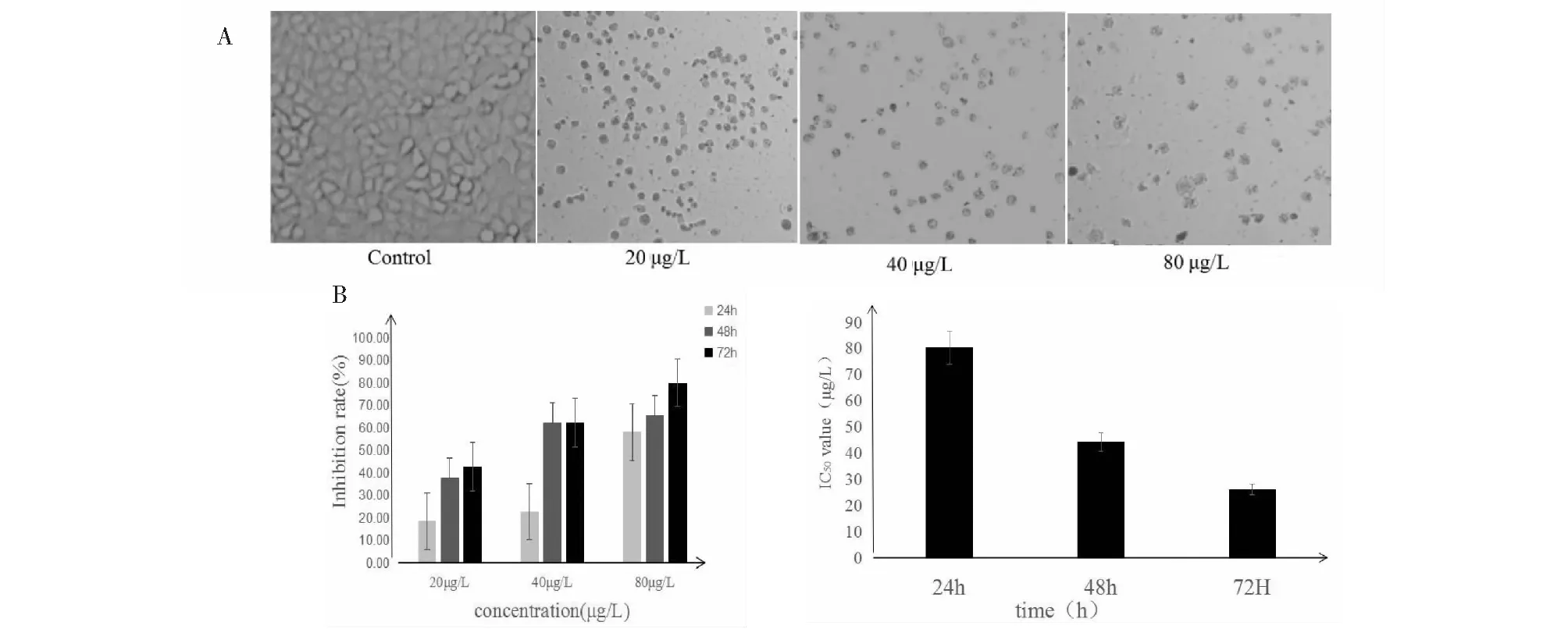
图1 烟管头草粗提物对前列腺增生细胞增殖活性的影响Fig.1 Effect of Carpesium cernuum crude extract on proliferative activity of benign prostatic hyperplasia注:与空白对照组比较,* P < 0.05,** P < 0.01。A.倒置显微镜观察提取物对BPH1细胞形态变化的影响;B.烟管头草粗提物对前列腺增生细胞生长的影响;C.粗提物对BPH1细胞作用的IC50值* P<0.05,** P<0.01。Note:Compared with control group,* P<0.05,**P<0.01.A.Inverted microscope to observe the effect of >extracts on the morphological changes of BPH1 cells;B.Effect of Carpesium cernuum crude extract on the growth of benign prostatic hyperplasia cells;C.IC50 value of crude extracts on BPH1 cells.
3.2 Transwell实验
体外侵袭能力检测实验:倒置显微镜(×100)观察(图2A)表明随着药物浓度的增大,视野数目逐渐减少,呈现浓度依赖性。统计学处理(图2B)表明,对照组(0 μg/L),实验组(20、40、80 μg/L)其透过滤膜平均数分别为123、34、18、10个,与对照组(0 μg/L)比较,实验组20、40、80 μg/L差异性显著(P<0.01),进一步验证了药物对细胞侵袭力的影响呈现浓度依赖性。因此,侵袭实验表明:药物能显著降低细胞的侵袭潜能。
3.3 粗提物诱导细胞凋亡研究
细胞凋亡染色实验(图3)表明正常细胞(Control)呈现淡蓝色,偶尔有带苍白色;而加入药物后的细胞大多呈现苍白色,并且浓缩成圆形。染色质断裂是细胞凋亡时主要的生化特征,在凝胶电泳上表现为梯形电泳图(图4)谱(DNA ladder),本研究用两种浓度处理 BPH1细胞后发现,与对照组 DNA ladder 有明显不同,药物处理后细胞出现典型的 DNA ladder,说明细胞已经凋亡。因此,凋亡染色试验和DNA ladder实验表明:药物能够诱导 BPH1细胞凋亡。
3.4 RT-PCR检测
RT-PCR实验(图5)结果表明:GAPDH基因在BPH1正常表达,实验组与GAPDH相比,实验组SFRPS2 、C-myc、β-catenin基因组表达均高于内参组,ddk1、fzd2、cyclinD1表达均低于内参组。与control组相比,SFRPS2 、C-myc、β-catenin是随着浓度的增大而增加;ddk1、fzd2表达是随浓度的增大,表达能力增强,但显著低于内参组,cyclinD1组表达能力是随着浓度的增大而降低。因此,粗提物诱导BPH1细胞凋亡是与Wnt信号通路关键基因的表达有关。

图2 烟管头草粗提物对前列腺增生细胞体外侵袭能力的影响Fig.2 Effect of crude extract of Carpesium cernuumon in vitro invasive ability of benign prostatic hyperplasia cells注:与空白对照组比较,** P < 0.01。A.显微(×100)观察图;B.透过滤膜平均值。Note:Compare with control,** P < 0.01.A.microscopic (x100) observations;B.Average of filtration membranes.

图3 HE染色检测烟管头草粗提物诱导前列腺增生细胞凋亡Fig.3 HE staining was used to detect the apoptosis of prostate hyperplasia cells induced by crude extractof Carpesium cernuumon 注:A.Control组;B.图为20 μg/L粗提物处理。Note:A.Control group;B.20 μg/L crude extract treatment.
4 结论
前列腺增生症即良性前列腺增生(Benign prostatic hyper-plasia,BPH) ,是中老年男性常见疾病。随着老龄化人口日益增加,BPH 的发病率逐年上升,50 岁以上男性,约 90% 有不同程度的前列腺增生,已严重威胁中老年男性的健康。国际良性前列腺增生咨询委员会定义 BPH 为存在良性前列腺长大,或前列腺移行区长大的客观证据,有下尿路症状(LUTS) ,或下尿路症状加重及上尿路受损,存在膀胱出口梗阻[12]。主要临床表现:进行性尿频、尿线变细、排尿费力、尿潴留等,重症患者可导致肾积水、肾功能衰竭等病症[12]。有研究表明,生长因子通路是调控前列腺增生直接主要因素;雌雄激素紊乱,是前列腺增生源头;凋亡紊乱,由生长因子及激素变化诱导,也是前列腺增生的病理表现,而在前列腺增生发生发展中,激素内分泌学说和生长因子学说也具重要地位和作用[12]。有研究中药及其活性成分可从多方面、多靶点治疗 BPH,现有研究多为调节雌激素、雄激素,改善微循环 及增强免疫,并且也有研究证实、牵牛子、川芎、当归、白芥子、王不留行、水蔓青等可通过改善 BPH动物模型的各种指标[12]。近年来,国内对 BPH1研究取得较大进展,现已证实药物干预防治前列腺增生症与多种因素密切相关。有学者拟通过虚拟筛选、分子水平筛选、细胞水平筛选和整体动物筛选,进行药物的筛选[13]研究。烟管头草常以全草入药,其化学成分和药理作用报道较多,含有倍半萜、黄酮、醇、酯、苯酚、甾体、木脂素、三萜、香豆素等,如天名精内酯酮(Carab-rone),天名精内酯醇(Carabrol)与特勒内酯(Telekin)[14],鹤大叶土木香内酯(Granilin),11(13)-去氢腋生依瓦菊素[11(13)-dehydroivaxillin][15]等,药理活性报道有清热泻火、凉血解毒、抗病毒抗菌杀虫[16-19]作用,但是在利用烟管头草粗提物诱导细胞凋亡发挥抗前列腺细胞作用方面的研究较少涉及。因此,本研究就其抗前列腺细胞增殖活性及其机制进行初步探究。实验表明:烟管头草粗提物对前列腺增生细胞(BPH1)的增殖抑制作用具有选择性,可显著抑制前列腺增生细胞(BPH1)的增殖,并且呈现显著的时间和浓度依赖性;荧光倒置显微镜观察发现细胞数量与状态显著改变,且有凋亡小体出现;Transwell实验表明烟管头草粗提物可降低BPH1细胞侵袭潜能;Heston染色实验及DNA ladder表明提取物可显著诱导细胞凋亡;分子生物学实验结果表明粗提物可在转录水平显著调控Wnt信号通路中β-catenin、SFRPS2、cyclinD1、ddk1、fzd2、C-myc基因表达。烟管头草作为民族药,资源丰富,医用前景大,而本研究为分离烟管头草的抑制人前列腺增生(BPH1)活性成分及综合利用提供了实验依据。
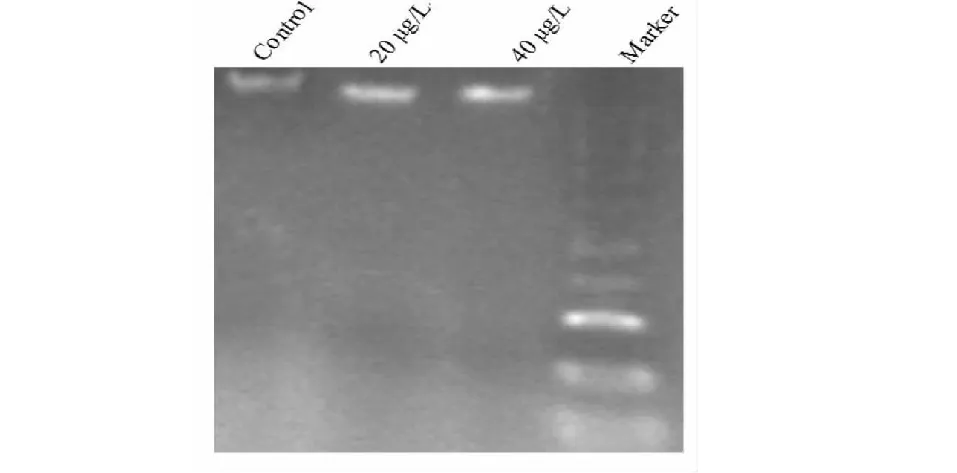
图4 DNA Ladder检测烟管头草粗提物诱导前列腺增生细胞凋亡Fig.4 DNA Ladder detection of Carpesium cernuumon crude extract induces apoptosis of benign prostatic hyperplasia
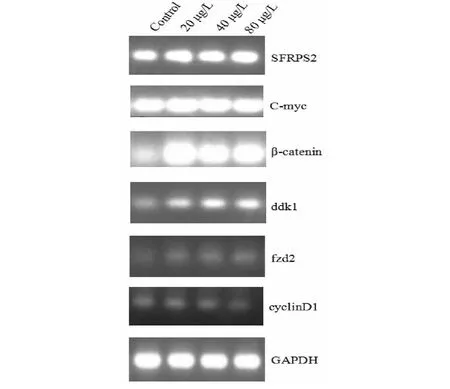
图5 转录水平检测烟管头草粗提物对前列腺增生细胞中Wnt信号通路的关键基因表达的影响Fig.5 The effect of expression of key gene transcription level detection of Carpesium cernuumon extract on Wnt signaling pathway in the cells of the prostate hyperplasia

