滇结香花改善糖尿病胰岛损伤及机制研究
王亚欣,张志文,任怡琳,刘 敏,史劲松,许正宏,许泓瑜*
1江南大学药学院;2江南大学生物工程学院 工业生物技术教育部重点实验室;3江南大学 粮食发酵工艺与技术国家工程实验室,无锡 214122;4青藏高原微生物国家地方联合工程研究中心,拉萨 850000
2型糖尿病(T2DM)的发病率日渐增加,胰岛β细胞功能受损和胰岛素抵抗是其两大发病机制[1]。过去认为胰岛素抵抗在T2DM病理生理机制中占主要位置,现在越来越多地认识到胰岛β细胞功能障在T2DM发生发展中起重要作用。胰岛β细胞功能障碍是T2DM发生的必要条件,胰岛β细胞凋亡是造成胰岛素分泌能力绝对下降的重要因素[2]。
滇结香Edgeworthiagardneri(Wall.)Meissn,E.gardneri属于瑞香科、结香属植物,主要分布在我国西藏及云南地区。滇结香是我国特有的珍贵药材,据《藏医养身图说》书中记载,滇结香花具有清肝明目等作用,民间泡水饮用对糖尿病、高血压、高血脂等慢性疾病均具有预防和治疗效果[3],其主要成分包括双香豆素类、黄酮类、多酚类等[4]。随着人们对滇结香研究的不断深入,发现其具有抗菌[5]、抗氧化[6]、降血糖[7]、降血脂[8]等多种作用。
本实验室前期在2型糖尿病动物模型上评价滇结香提取物,发现滇结香花水提取物具有良好的降糖活性,能增加胰岛素分泌量,并对损伤胰岛组织有一定的修复作用[9]。因此利用胰岛损伤模型对滇结香花提取物中保护胰岛的物质进行筛选并探究其降糖作用机制是非常必要的。本实验从滇结香花中提取分离制备组分,通过胰岛细胞损伤模型及化学诱导型T2DM小鼠模型对其体外、体内降糖活性和作用机制进行研究,为滇结香花保护胰岛细胞治疗T2DM提供依据。
1 材料与仪器
1.1 实验动物
5周龄SPF级雄性C57BL/6J小鼠,体重16~20 g,30只。购于上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2012-0002。
1.2 细胞株
大鼠胰岛β细胞RIN-m5F,购自国家实验细胞资源共享服务平台。
1.3 药物与试剂
滇结香花由西藏月王公司提供,与保藏在中国科学院昆明植物研究所的滇结香标本一致,并经分子鉴定确认;RPMI-1640 培养基和无糖RPMI-1640 培养基胎牛血清(GIBCO公司,美国);噻唑蓝(MTT)、胰酶(碧云天公司);AKT、FOXO1、JNK抗体(CST公司,美国);棕榈酸(PA)、葡萄糖、DCFH-DA(Sigma公司,美国);链脲佐菌素(STZ)(麦克林公司);艾塞那肽注射液(Baxter Pharmaceutical Solutions LLC公司,美国);其他试剂,均为国产分析纯试剂。
1.4 主要仪器
Multiskan MK3型酶标仪(Thermo-Labsysytems公司,美国);CO2培养箱(Thermo Forma公司,美国);倒置显微镜(Nikon公司,日本);蛋白电泳仪、电转仪(Bio-Rad公司美国);冷冻离心机(Eppendorf公司,德国);PCR扩增仪、荧光定量PCR仪(Bio-Rad公司,美国)。
2 方法
2.1 滇结香花提取物的制备
取干燥滇结香花(500 g)粉碎后,按质量体积比1∶10正己烷提取,于60 ℃浸提6 h,过程中不断搅拌。过滤得澄清滤液,滤渣再重复浸提两次,合并滤液,旋转蒸发去除正己烷后得到滇结香花正己烷提取物(EGH)。
2.2 剂量与分组
将3周龄SPF级雄性C57BL/6J小鼠分为空白对照组(NC)与造模组,NC组喂养普通饲料,造模组喂养60%高脂饲料4周后,连续腹腔注射链脲佐菌素(STZ)(50 mg/kg/day)5天,注射结束后监测FBG 2周,待血糖稳定升高且FBG ≥ 11.1 mmol/L时造模成功,然后随机分成模型组、阳性对照组以及低中高EGH干预组。空白对照组(NC):灌胃0.5%羧甲基纤维素钠溶液;模型组(DM):灌胃0.5%羧甲基纤维素钠溶液;阳性对照组(EX):腹腔注射艾塞那肽4μg/kg/day;EGH低剂量组(L-40 mg/kg/day);EGH中剂量组(M-80 mg/kg/day);EGH高剂量组(H-160 mg/kg/day)。
2.3 空腹血糖(FBG)
每周定时检测小鼠FBG。小鼠测量FBG前一晚8点开始禁食12 h,自由饮水,第二天早8点剪尾采血测量FBG。
2.4 全血中糖化血红蛋白(HbAlc)的检测
采用南京建成全血中糖化血红蛋白测定试剂盒检测HbAlc,遵照试剂盒说明书方法测定。
2.5 空腹血清胰岛素
采用赛默飞小鼠胰岛素酶联免疫(ELISA)检测试剂盒检测胰岛素水平。遵照试剂盒说明书方法进行实验,并用酶标仪测量结果,计算胰岛素浓度。
2.6 细胞培养及胰岛损伤细胞模型建立
在37 ℃,5%CO2的饱和湿度培养箱中,采用含有10%胎牛血清和1%青霉素/链霉素的1640培养基(含有10 mmol/L萄糖,不含胰岛素)培养RIN-m5F细胞,待细胞汇合度达到70%~80%时采用胰酶消化,按1∶3比例传代,每2~3天传代一次。
取对数生长期的RIN-m5F细胞,以2×104个细胞/孔的密度接种在96孔板中。根据安丽萍等[10]和蔺忆[11]等方法加以改良,采用0.25 mmol/L棕榈酸联合30 mmol/L葡萄糖培养基刺激RIN-m5F细胞6 h作为诱导胰岛β细胞损伤的条件。
2.7 MTT法测定细胞存活率
将RIN-m5F细胞以2×104个细胞/孔的密度接种在96孔板中,加入刺激药物孵育,一定时间后进行MTT测定。孵育结束后,弃去培养基,PBS清洗细胞后,将细胞与MTT(0.5 mg/mL)一起孵育4 h,弃去培养基并加入DMSO(150 μL),避光震荡10 min,于570 nm波长处测定吸光度(OD,重复3次)。
2.8 DCFH-DA荧光探针法检测细胞内活性氧(ROS)水平
将RIN-m5F细胞以2×104个细胞/孔的密度接种在96孔黑色荧光板中,实验分为6 组:正常组(CTL):含1640完全培养基;模型组(DM):0.25 mmol/L棕榈酸联合30 mmol/L葡萄糖培养基;阳性对照组(EX):0.25 mmol/L棕榈酸联合30 mmol/L葡萄糖培养基加入10 nM艾塞那肽;实验组:0.25 mmol/L棕榈酸联合30 mmol/L葡萄糖培养基加入50 μg/mL(L)、100 μg/mL(M)、200 μg/mL(H)滇结香花正己烷提取物。作用细胞时间为6 h。孵育结束后,弃去培养基,用10μM DCFH-DA探针于37 ℃孵育细胞30 min。使用激发/发射波长为488/525 nm的酶标仪分析其荧光强度。以空白组的荧光强度(0 mmol/L棕榈酸联合10 mmol/L葡萄糖)为100%,对实验组进行相对定量。
2.9 荧光定量PCR法检测细胞凋亡基因的表达
采用苯酚抽提法提取细胞总RNA,按照条件(25 ℃,10 min;48 ℃,40 min;95 ℃,5 min;4 ℃保存)反转录为cDNA.然后按照条件(50 ℃,2 min;95 ℃,10 min,一个循环;95 ℃,15 s;60 ℃,1 min,40个循环扩增)进行qRT-PCR.以GAPDH为内参,采用2-△△Ct法对caspase-3基因的表达进行相对定量,计算其表达倍数,所需引物序列如下:
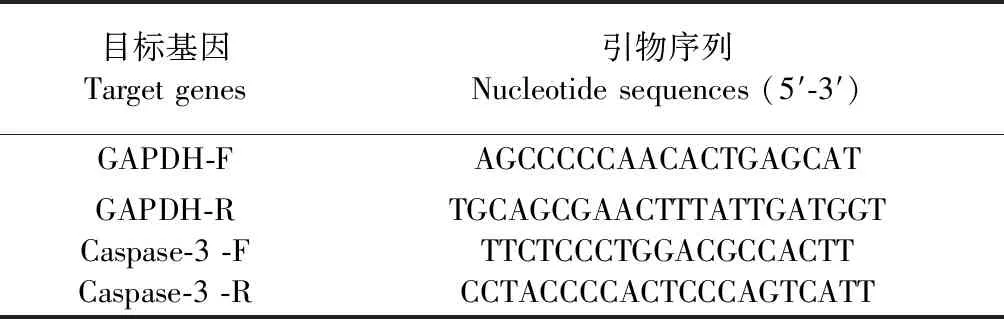
表1 qRT-PCR引物序列
2.10 蛋白免疫印迹
将RIN-m5F细胞接种到6孔板(1.5×106个细胞/孔)上。处理后,用冰的裂解缓冲液裂解RIN-m5F细胞。根据蛋白质含量试剂盒说明测量蛋白质浓度。在10%聚丙烯酰胺凝胶上分离等量蛋白质的样品,然后转移到聚偏二氟乙烯膜上,分别用针对AKT,FOXO1,JNK的选择性抗磷酸化或非磷酸化抗体进行检测。
2.11 统计学分析
实验结果通过One-Way ANOVA进行统计学分析,数据结果用于平均值±标准差表示。显著性差异表示为:与对照组相比,*P<0.05,**P<0.01,***P<0.001;与模型组相比,#P<0.05,##P<0.01,###P<0.001。实验中所有数据均在GraphPad Prism 5中进行数据分析。
3 结果
3.1 EGH对胰岛损伤模型小鼠空腹血糖(FBG)的影响
空腹血糖作为糖尿病的常用检测指标,其变化可初步反映药物的降糖活性。如表1,STZ诱导C57BL/6J糖尿病模型小鼠的FBG与正常组相比,具有显著性升高的差异,且四周后并无恢复;阳性药物EX和EGH低、中、高三个剂量治疗一周后FBG开始降低,持续治疗四周后,EX降低FBG 57.02%,低、中、高三个剂量分别降低FBG 22.91%、32.18 %、40.04%,结果显示EGH可有效降低胰岛损伤糖尿病模型小鼠的FBG。
3.2 EGH对胰岛损伤模型小鼠糖化血红蛋白(HbAlc)的影响
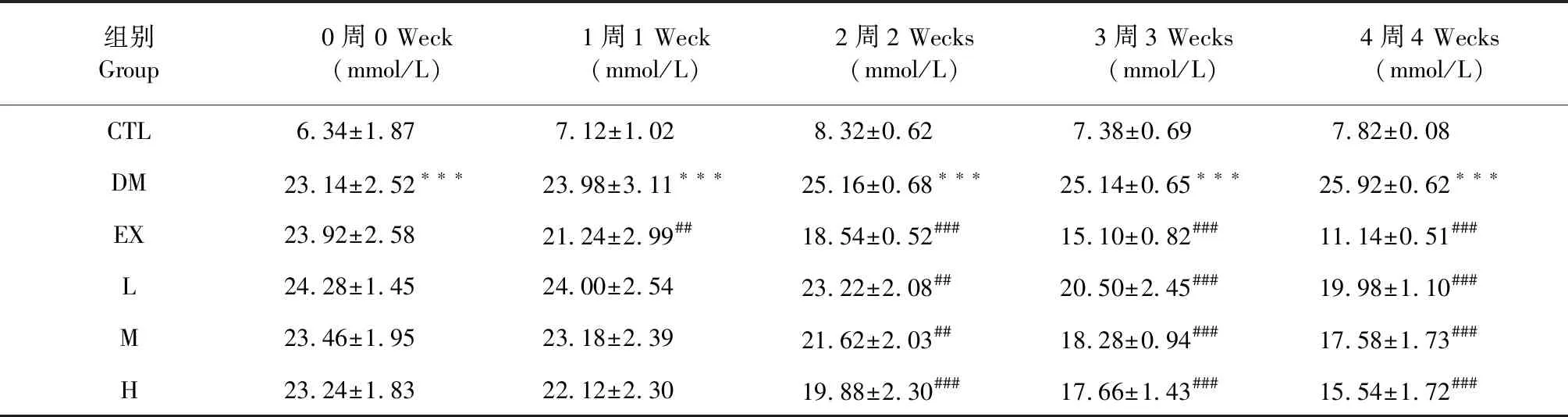
表2 EGH对C57BL/6J T2DM小鼠模型FBG的影响(n=5)
注:与正常组相比,***P< 0.001;与模型组相比,##P<0.01,###P< 0.001。
Note:Compared with control group,***P<0.001;compared with model group,##P<0.01,###P<0.001.
HbAlc主要表示过去4~8周内平均血糖控制水平,如图1所示,C57小鼠HbA1c含量DM组显著高于NC组(**P<0.01);治疗4周后EX组HbA1c含量显著降低(##P< 0.01),且接近于NC组;EGH治疗可明显减少C57BL/T2DM模型小鼠HbA1c含量,并呈剂量依赖性,其中高剂量组效果与阳性药物艾塞那肽相近。
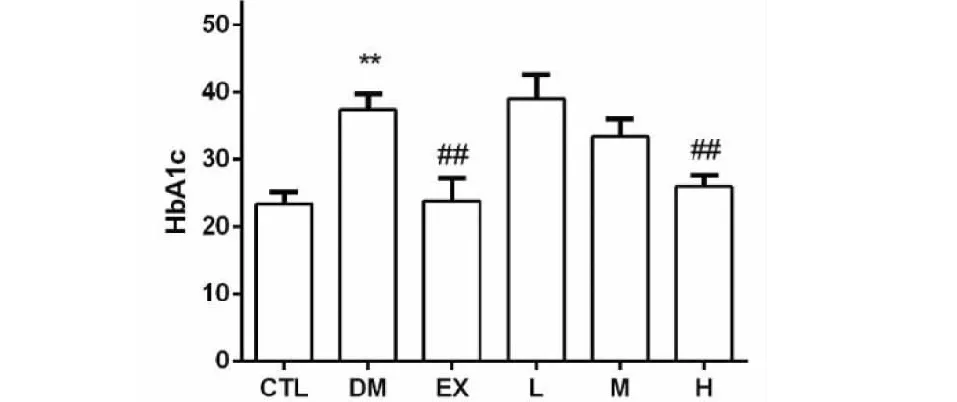
图1 EGH对C57BL/6J小鼠HbAlc的影响Fig.1 Effect of EGH on HbA1c of T2DM model C57BL/6J mice注:与对照组相比,**P<0.01;与模型组相比,##P<0.01。Note:Compared with control group,**P<0.01;compared with model group, ##P<0.01.
3.3 EGH对胰岛损伤模型小鼠胰岛素分泌的影响
胰岛素是机体内唯一的降血糖激素,也是唯一能同时促进糖原、脂肪、蛋白质合成的激素,血清胰岛素的测定是糖尿病诊断的必要参考指标[12]。结束治疗后,收集小鼠空腹时的血清,采用ELISA检测小鼠的血清胰岛素水平,如图2,糖尿病模型小鼠的血清胰岛素水平明显低于正常小鼠(***P<0.001);治疗四周后,治疗组较模型组小鼠的血清胰岛素水平显著上升(#P<0.05,##P<0.01,);中、高剂量的EGH可明显提高糖尿病小鼠的血清胰岛素水平。

图2 EGH对T2DM模型小鼠胰岛素分泌的影响Fig.2 Effect of EGH on insulin secretion of T2DM model mice注:与空白对照组相比,***P<0.001;与模型组相比, #P<0.05,##P<0.01,###P<0.001。Note:Compared with control group,***P<0.001;compared with model group,#P<0.05,##P<0.01,###P<0.001.
3.4 MTT法检测滇结香花提取物对RIN-m5F损伤细胞存活率的影响
如图3结果显示,采用0.25 mmol/L棕榈酸联合30 mmol/L葡萄糖的模型组显著降低细胞存活率(**P<0.01)。经过.100~200 μg/mL EGH处理后,与模型组相比细胞存活率明显上升(#P<0.05)。

图3 EGH对Rin-m5F损伤细胞存活率的影响Fig.3 Effect of EGH on cell viability in RIN-m5F cells注:与空白对照组相比,**P<0.01;与模型组相比,#P<0.05。Note:Compared with control group,**P<0.01;compared with model group,#P<0.05.
3.5 DCFH-DA荧光探针法检测滇结香花提取物对RIN-m5F细胞内ROS水平的影响
采用本实验室建立的胰岛损伤细胞模型以活性氧生成量为检测指标评价不同浓度滇结香花正己烷提取物对胰岛细胞的保护作用。如图4,与空白对照组相比,模型组ROS生成量显著增加(***P< 0.001);与模型组相比,EGH作用RIN-m5F细胞后ROS生成量显著降低且呈剂量依赖性。
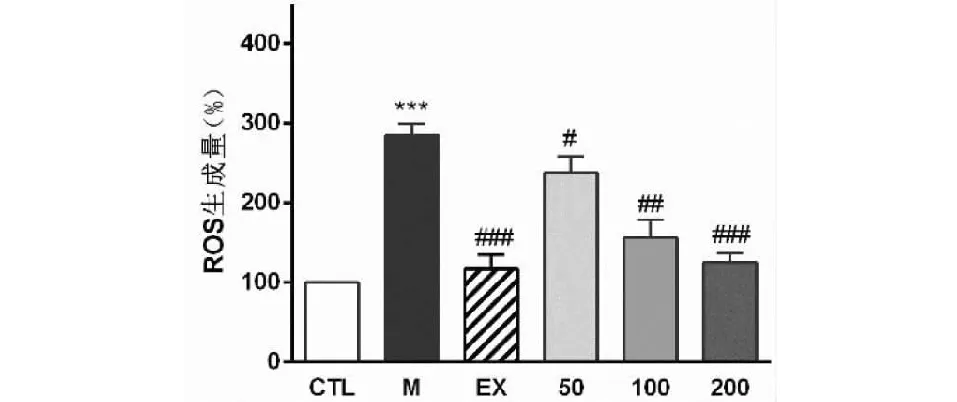
图4 滇结香花提取物对RIN-m5F损伤细胞ROS的影响Fig.4 Effect of extrations of E.gardneri. on ROS in RIN-m5F injury cells注:与空白对照组相比,***P<0.001;与模型组相比,#P<0.05,##P<0.01,###P<0.001。Note:Compared with control group,***P<0.001;compared with model group,#P<0.05,##P<0.01,###P<0.001.
3.6 qRT-PCR法检测caspase-3基因的转录
β细胞损伤时,可能触发了凋亡途径导致细胞存活率降低。如图5所示,当0.25 mmol/L棕榈酸联合30mmol/L葡萄糖作用后,与空白对照组相比,模型组caspase-3基因表达水平增加;与模型组相比,100 μg/mL EGH能明显降低caspase-3基因表达水平(##P<0.01)。
3.7 Western blot法检测胰岛损伤和凋亡信号通路蛋白的表达
PI3K/AKT信号通路是与胰岛素信号相关的一条信号通路,它参与细胞增殖、分化、凋亡等多种活动[13]。如图6所示,与空白对照组相比,模型组p-AKT、p-FOXO1蛋白水平明显下调,p-JNK蛋白水平明显上调(***P< 0.001)。在浓度为100 μg/mL的EGH作用RIN-m5F细胞后,AKT、FOXO1蛋白磷酸化水平升高,JNK蛋白磷酸化水平降低(##P<0.01),证明EGH可以激活AKT抑制FOXO1,导致FOXO1从细胞核移位到细胞质,从而使FOXO1失活[14]。同时抑制JNK的激活,保护β细胞免受氧化应激影响。

图5 EGH对RIN-m5F细胞caspase-3基因转录的影响Fig.5 Effect ofEGH on transcription level of caspase-3 gene in RIN-m5F cells注:与空白对照组相比,**P<0.01;与模型组相比, ##P<0.01。Note:Compared with control group,***P<0.001;compared with model group,##P<0.01.

图6 滇结香花提取物对RIN-m5F损伤细胞相关蛋白的影响。(a)AKT;(b)FOXO1;(c)JNKFig.6 Effect of extrations of E.gardneri. on revelant protein in RIN-m5F injury cells.(a) AKT;(b) FOXO1;(c) JNK注:与空白对照组相比,***P<0.001;与模型组相比, ##P<0.01。Note:Compared with control group,***P<0.001;Compared with model group,##P<0.01.
4 讨论
糖尿病胰岛β细胞的功能障碍及数量减少是2型糖尿病(T2DM)的主要发病原因。伴随着营养过剩以及肥胖的发生,人体血浆中葡萄糖和游离脂肪酸的水平明显増加。糖毒性和脂毒性是导致胰岛β细胞衰竭的重要病理因素,但其损伤机制至今尚未完全阐明。本实验室前期研究报道滇结香花提取物通过抑制α-葡萄糖苷酶活性等方面治疗T2DM[7]。滇结香花水提取物展现出良好的降糖活性。实验同时还发现对损伤胰岛组织也有一定的修复作用,提示利用胰岛损伤的体内和体外模型对滇结香花中保护胰岛的物质进行筛选并探究其机制是非常必要的。本实验通过检测空腹血糖、糖化血红蛋白和胰岛素分泌等指标证实滇结香花正己烷提取物能明显降低糖尿病小鼠的空腹血糖、糖化血红蛋白和口服糖耐量,并提高胰岛素水平。
本试验结果提示滇结香花正己烷提取物可以改善损伤的RIN-m5F细胞存活率,降低活性氧(ROS)生成量。而氧化应激被认为是糖尿病发生和发展过程中的重要风险因素。长期高血糖和高游离脂肪酸引起氧化应激和的ROS加速产生,导致胰岛细胞损伤和凋亡,降低胰岛素基因的表达,减少胰岛素分泌[15]。
Caspase-3是细胞凋亡途径中caspase依赖性途径中的关键效应分子,其活化和含量的提高意味着凋亡的加强。实验中我们证实了EGH与模型组相比能够减少caspase-3基因的转录水平,提示EGH对损伤的RIN-m5F细胞具有抗凋亡的作用。
氧化应激的发生通常包含了多条信号通路,如PI3K/AKT途径。PI3K/AKT通过下游多种途径对靶蛋白进行磷酸化而发挥抗凋亡作用,例如胰岛β细胞中特异性过表达AKT可导致β细胞数目和大小的显着增加[16]。 AKT还是参与内质网线粒体连接水平调节的关键激酶,通过调控IP3R1磷酸化水平,进而影响内质网内钙离子的释放。而钙离子在葡萄糖促进胰岛素释放中起着关键的调节作用[17]。FOXO1转录因子是控制细胞周期的重要分子,其核内定位导致细胞凋亡[18]。这些均证明AKT/FOXO1信号通路在PA诱导的细胞凋亡起着重要的调节作用。C-Jun N-末端激酶(JNK)在各种细胞类型(包括胰腺β细胞)中被氧化应激激活。现有证据表明内质网应激与氧化应激通过激活JNK,从而抑制胰岛素生物合成和干扰胰岛素作用通路[19]。因此JNK在胰岛β细胞功能障碍和凋亡以及胰岛素抵抗中起着关键作用。实验中我们发现浓度为100 μg/mL的EGH处理后,细胞内AKT、FOXO1蛋白磷酸化水平升高,JNK蛋白磷酸化水平降低,证明EGH可以激活AKT抑制FOXO1,导致FOXO1从细胞核移位到细胞质,从而使FOXO1失活。同时抑制JNK的激活,减少氧化应激对β细胞的影响,抑制凋亡。

