一株秋茄内生真菌Colletotrichum sp. SCSIO KcB3-2的次级代谢产物研究
戴 昱,林秀萍,庞小艳,罗小卫, Limbadri Salendra,杨 斌,王俊锋,周雪峰,刘永宏,3*
1中国科学院南海海洋研究所广东省海洋药物重点实验室,广州 510301;2中国科学院大学,北京 100049; 3南海生物资源开发与利用协同创新中心,广州 510275
红树林生态系统是一个广泛分布于热带和亚热带的,由陆地到海洋过渡的特殊的潮间带生态系统,是四大海洋高生产力生态系统之一,全世界将近60%~70%的热带和亚热带海岸线都被红树林所覆盖[1,2]。红树林作为一种特殊的植物群落,其独特的环境孕育了丰富的微生物资源,而无论是种类还是分布范围,在大西洋西岸,中国的红树林都具有代表性[3]。自从Cribb等[1]首次从红树根部分离到真菌后,对于红树林真菌的研究逐渐成为研究的热点。目前已分离鉴定的红树林真菌超过200种,是海洋真菌的第二大生态群落[2,4]。
中山大学林永成课题组从不同红树植物秋茄内生真菌中分离到了一系列新颖结构:内酯类,环肽类,呋喃香豆素类,异色酮类,氧杂蒽醌类,萜类,异黄酮类等化合物[5]。本课题组于2016年从一株秋茄内生真菌葡萄座腔菌属分离得到2个新的苯类衍生物[6];2017年从一株秋茄内生真菌拟盘多毛孢属分离得到10个新的水杨酸衍生物[7]。为了从海洋微生物资源中寻找新颖的活性化合物,本课题组对采自深圳大亚湾红树植物秋茄中分离得到的一株内生真菌次级代谢产物进行了研究,分离得到14个化合物 (图1),分别为:对羟基苯甲醛 (1),2-(4-羟苯基)乙醇 (2),2-(4-羟苯基)乙酸乙酯 (3),2-羟基-2-(4′-羟基苯基)乙醇 (4),2-甲氧基-2-(4′-羟基苯基)乙醇 (5),苯乙二醇 (6),2-氨基-3-苯基-1-丙醇 (7),对羟基苯乙酸甲酯 (8),2-(2-羟基乙基)苯酚 (9),3-chlorogentisyl alcohol (10),4-hydroxymellein (11),diaporthin (12),环(L-苯丙-L-亮)二肽 (13),环(D-苯丙-L-异亮)二肽 (14)。
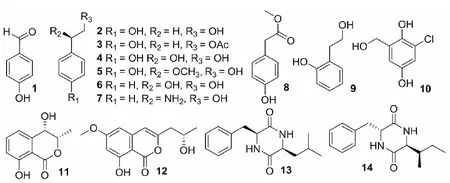
图1 化合物1~14的结构Fig.1 Structures of compounds 1-14
1 材料与方法
1.1 实验样品
供试菌株是从一株分离于深圳大亚湾红树植物秋茄树枝的内生真菌菌株。将保藏于4 ℃的菌株接种到MB琼脂固体平面培养基上,置于28 ℃ 培养箱中活化7天。然后接种到MB 种子培养液(麦芽提取物 15 g,海盐 2.5 g,水 1 L,pH 7.4~7.8) 中,于28 ℃、178 rpm 条件下摇床活化3天,最后接种至大米培养基(大米200 g,海盐3 g,水200 mL)中,室温下静置发酵30天,共发酵 9.6 kg。
1.2 菌株鉴定
首先按照文献[8]提取真菌菌体总DNA,并分别用引物ITS1 (5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)对总DNA中的ITS序列进行PCR扩增并测序。其中,该菌株(accession number KcB3-2)与Colletotrichumgloeosporioidesisolate OMC3(NCBI GenBank accession number JF710554),Colletotrichumkahawaeisolate LS8(NCBI GenBank accession number KM520031)以及ColletotrichumignotumCol1(NCBI GenBank accession number JX515292)的相似度为99%,故鉴定为Colletotrichumsp.SCSIO KcB3-2,菌种保存于中国科学院南海海洋研究所热带海洋生物资源与生态重点实验室。其ITS序列如下:
CTCTACACCCTTTGTGACATACCTATAACTGTT
GCTTCGGCGGGTAGGGTCTCCGTGACCCTCCCGGC
CTCCCGCCCCCGGGCGGGTCGGCGCCCGCCGGAG
GATAACCAAACTCTGATTTAACGACGTTTCTTCTGA
GTGGTACAAGCAAATAATCAAAACTTTTAACAACG
GATCTCTTGGTTCTGGCATCGATGAAGAACGCA
GCGAAATGCGATAAGTAATGTGAATTGCAGAA
TTCAGTGAATCATCGAATCTTTGAACGCACATTGCGCCCGCCAGCATTCTGGCGGGCATGCCTGTTCGAGCGTCATTTCAACCCTCAAGCTCTGCTTGGTGTTGGGGCCCTACAGCTGATGTAGGCCCTCAAAGGTAGTGGCGGACCCTCCCGGAGCCTCCTTTGCGTAGTAACTTTACGTCTCGCACTGGGATCCGGAGGGACTCTTGCCGTAAAACCCCCCAATTTTCCAAAGGTTGACCTCGGATCAGGTAGGAATACCCGCTGAACTTAAGCATATCAATAAGTCGGAGGAA
1.3 主要仪器与试剂
主要仪器有:AV-500 和AV-700 超导核磁共振仪(德国Bruker 公司)、中压制备色谱仪(Buchi 公司)、Hitachi Primade 高效液相色谱仪(日本日立公司)、ZYJ-S 型超净工作台(苏州净化设备公司)、旋转蒸发仪(日本东京理化株式会社,EYELAN-1100V-W 型)等;主要试剂有薄层色谱及柱色谱用硅胶(青岛海洋化工厂)、分析纯化学试剂(广州化学试剂厂和天津富宇精细化工有限公司)等。
1.4 提取与分离
将固体发酵培养物切成小块,加入等体积丙酮,充分搅拌,超声提取15 min,再浸泡过夜。经减压过滤后,滤液减压蒸馏至无有机溶剂,水相溶液用乙酸乙酯萃取3遍,蒸干乙酸乙酯相得浸膏;滤渣用乙酸乙酯提取5遍,乙酸乙酯溶液再经减压浓缩得浸膏,合并两者得粗浸膏;将其分散到甲醇中,然后用石油醚萃取3次,去除石油醚相得到甲醇相,减压蒸馏最终得总浸膏73.4 g。浸膏用100~200目硅胶拌样,经中压柱色谱(200~300目硅胶)分离 (二氯甲烷/甲醇100∶0~0∶100)梯度洗脱后经TLC分析合并得14个流份。Fr.5经ODS中压反相柱色谱(甲醇/水 10%∶90%~100%∶0)分离得10个子流份,其中Fr.5-5使用半制备HPLC(甲醇/水 30%∶70%,流速 2.5 mL/min)分离得到化合物1(1.9 mg);Fr.5-7经半制备HPLC(甲醇/水 33%∶67%,流速 2.5 mL/min)分离得到化合物8(4.7 mg),11(11.0 mg);Fr.5-8经半制备HPLC(甲醇/水 38%∶62%)分离得到化合物3(21.9 mg)。Fr.7经ODS中压反相柱色谱 (甲醇/水 10%∶90%~100%∶0)分离得12个子流份,其中Fr.7-3使用半制备HPLC(甲醇/水 17%∶83%,流速 3.0 mL/min)分离得到化合物2(56.8 mg)、5(13.8 mg)、6(33.2 mg);Fr.7-4使用半制备HPLC(甲醇/水 24%∶76%,流速 2.5 mL/min)分离得到化合物7(11.8 mg);Fr.7-4使用半制备HPLC(乙腈/水 25%∶75%,流速 3.0 mL/min)分离得到化合物13(3.5 mg),14(2.5 mg)。Fr.10经ODS中压反相柱色谱 (甲醇/水 10%∶90%~100%∶0,流速 2.5 mL/min) 分离得8个子流份,其中Fr.10-3使用半制备HPLC(甲醇/水 33%∶67%,流速 2.5 mL/min)分离得到化合物12(7.6 mg)。Fr.11经ODS中压反相柱色谱 (甲醇/水 10%∶90%~100%∶0) 分离得14个子流份,其中Fr.11-10使用半制备HPLC(乙腈/水 30%∶70%,流速 2.5 mL/min)分离得到化合物4(3.1 mg)。
2 结构鉴定
化合物1无色油状物;1H NMR (700 MHz,CD3OD)δ:9.71 (1H,s,H-1),7.76 (2H,d,J=9.1 Hz,H-2′,6′),6.87 (2H,d,J=8.4 Hz,H-3′,5′);13C NMR (175 MHz,CD3OD)δ:192.6 (s,C-1),168.1 (s,C-4′),133.6 (d,C-2′,6′),128.9 (s,C-1′),117.6 (d,C-3′,5′)。以上数据与文献[9]报道基本一致,故鉴定该化合物为对羟基苯甲醛。
化合物2红棕色针状晶体(甲醇);1H NMR (700 MHz,CD3OD)δ:7.05 (2H,d,J=8.4 Hz,H-2′,6′),6.75(2H,d,J=9.1 Hz,H-3′,5′),3.72 (2H,t,J=7.0 Hz,H-1),2.75 (2H,t,J=7.0 Hz,H-2);13C NMR (175 MHz,CD3OD)δ:156.6 (s,C-4′),131.0 (d,C-2′,6′),130.8 (d,C-3′,5′),116.1 (s,C-1′),64.5 (t,C-2),19.2 (t,C-1)。以上数据与文献[10]报道基本一致,故鉴定该化合物为2-(4-羟苯基)乙醇。
化合物3无色油状物;1H NMR (500 MHz,CD3OD)δ:7.06 (2H,d,J=8.5 Hz,H-4,8),6.74 (2H,d,J=8.5 Hz,H-5,7),4.22 (2H,t,J=7.0 Hz,H-1),2.84 (2H,t,J=7.0 Hz,H-2),2.01 (3H,s,H-10);13C NMR (125 MHz,CD3OD)δ:173.0 (s,C-9),157.1 (s,C-6),130.9 (d,C-4,8),129.9 (s,C-3),116.2 (d,C-5,7),66.6 (t,C-1),35.2 (t,C-2),20.8 (q,C-10)。以上数据与文献[11]报道基本一致,故鉴定该化合物为2-(4-羟苯基)乙酸乙酯。
化合物4无色无定型粉末;1H NMR (700 MHz,CD3OD)δ:7.26 (2H,d,J=8.4 Hz,H-2′,6′),6.81 (2H,d,J=9.1 Hz,H-3′,5′),4.61 (1H,m,H-2),3.96 (1H,m,H-1b),3.69 (1H,m,H-1a);13C NMR (175 MHz,CD3OD)δ:158.5 (s,C-4′),130.3 (d,C-2′,6′),128.5 (d,C-3′,5′) ,116.2 (s,C-1′),78.6 (d,C-2),73.7 (t,C-1)。以上数据与文献[12]报道基本一致,故鉴定该化合物为2-羟基-2-(4′-羟基苯基)乙醇。
化合物5无色无定型粉末;1H NMR (500 MHz,CD3OD)δ:7.13 (2H,d,J=8.5 Hz,H-2′,6′),6.78 (2H,d,J=8.5 Hz,H-3′,5′),4.17 (1H,m,H-2),3.63 (1H,m,H-1b),3.51 (1H,m,H-1a),3.22 (3H,s,2-OCH3);13C NMR (125 MHz,CD3OD)δ:158.4 (s,C-4′),130.8 (s,C-1′),129.3 (d,C-2′,6′),116.2 (d,C-3′,5′),85.9 (d,C-2),67.7 (t,C-1),56.8 (q,2-OCH3)。以上数据与文献[12,13]报道基本一致,故鉴定该化合物为2-甲氧基-2-(4′-羟基苯基)乙醇。
化合物6无色针状晶体(甲醇);1H NMR (500 MHz,CD3OD)δ:7.40 (2H,d,J=7.0 Hz,H-2,6),7.36 (2H,m,H-3,5),7.29 (1H,m,H-4),4.72 (1H,dd,J=5.0,7.5 Hz,H-7),3.64 (2H,m,H-8);13C NMR (125 MHz,CD3OD)δ:143.2 (s,C-1),129.2 (d,C-3,5),128.5 (s,C-4),127.4 (d,C-2,6),75.9 (d,C-7),68.7 (t,C-8)。以上数据与文献[14]报道基本一致,故鉴定该化合物为苯乙二醇。
化合物7棕色油状物;1H NMR (500 MHz,CD3OD)δ:7.40 (2H,m,H-6,8),7.36 (2H,m,H-5,9),7.21 (1H,t,J=7.0 Hz,H-7),3.86 (1H,quint,J=6.0 Hz,H-2),3.54 (2H,m,H-1),2.87 (2H,m,H-3);13C NMR (125 MHz,CD3OD)δ:140.1 (s,C-4),130.4 (d,C-6,8),129.3 (d,C-5,9),127.1 (s,C-7),74.5 (d,C-2),66.6 (t,C-1),41.0 (t,C-3)。以上数据与文献[15]报道基本一致,故鉴定该化合物为2-氨基-3-苯基-1-丙醇。
化合物8黄色油状物;1H NMR (700 MHz,CD3OD)δ:7.10 (2H,d,J=8.4 Hz,H-2,6),6.75 (2H,d,J=8.4 Hz,H-3,5),3.68 (3H,s,H-9),3.54 (2H,s,H-7 );13C NMR (175 MHz,CD3OD)δ:174.6 (s,C-8),157.6 (s,C-4),131.3 (d,C-2,6),126.3 (s,C-1),116.3 (d,C-3,5),52.4 (q,C-9),40.9 (t,C-7)。以上数据与文献[16]报道基本一致,故鉴定该化合物为对羟基苯乙酸甲酯。
化合物9黄色油状物;1H NMR (700 MHz,CD3OD)δ:7.07 (1H,dd,J=1.4,7.7 Hz,H-5),7.03 (1H,td,J=1.4,7.7 Hz,H-3),6.75 (1H,m,H-6),6.74 (1H,m,H-4),3.75 (2H,t,J=7.0 Hz,H-8),2.84 (2H,t,J=7.0 Hz,H-7);13C NMR (175 MHz,CD3OD)δ:156.7 (s,C-1),131.9 (d,C-3),128.5 (d,C-5),126.6 (s,C-2),120.5 (d,C-4),116.1 (C-6),63.2 (t,C-8),35.1 (t,C-7)。以上数据与文献[17]报道基本一致,故鉴定该化合物为2-(2-羟基乙基)苯酚。
化合物10红色无定型粉末;1H NMR (500 MHz,CD3OD)δ:6.74 (1H,d,J=2.5 Hz,H-6 ),6.69 (2H,d,J=2.5 Hz,H-4),4.63 (2H,s,H-7);13C NMR (125 MHz,CD3OD)δ:151.6 (s,C-2),144.3 (s,C-5),131.9 (s,C-3),121.9 (s,C-1),115.5 (d,C-4),114.6 (d,C-6),61.2 (d,C-7)。以上数据与文献[18]报道基本一致,故鉴定该化合物为3-Chlorogentisyl alcohol。
化合物11无色针状晶体(甲醇);1H NMR (500 MHz,CD3OD)δ:7.58 (1H,t,J=8.0 Hz,H-6),7.08 (1H,d,J=7.5 Hz,H-5),6.94 (1H,t,J=8.5 Hz,H-7),4.56 (1H,m,H-3),4.55 (1H,m,H-4),1.47 (3H,d,J=6.0 Hz,3-CH3);13C NMR (125 MHz,CD3OD)δ:170.2 (s,C-1),162.9 (s,C-8),144.1 (s,C-4a),137.8 (d,C-6),117.8 (d,C-7),117.7 (d,C-5),108.0 (s,C-8a),81.6 (d,C-3),69.5 (d,C-4),18.2 (q,3-CH3)。以上数据与文献[19]报道基本一致,故鉴定该化合物为4-Hydroxymellein。
化合物12白色针状晶体(甲醇);1H NMR (700 MHz,CD3OD)δ:6.45 (1H,d,J=2.1 Hz,H-7),6.33 (1H,d,J=2.1 Hz,H-4),6.28 (1H,s,H-5),4.19 (1H,m,H-10),3.90 (3H,s,H-12),2.58 (2H,m,H-9),1.57 (3H,d,J=6.3 Hz,H-11);13C NMR (175 MHz,CD3OD)δ:168.7 (s,C-1),165.1 (s,C-6),162.6 (s,C-8),156.4 (s,C-3),143.6 (s,C-4a),106.5 (d,C-4),104.8 (d,C-5),101.1 (d,C-7),100.5 (s,C-8a),66.2 (d,C-10),56.2 (q,C-12),43.8 (t,C-9),23.3 (q,C-11)。以上数据与文献[20]报道基本一致,故鉴定该化合物为Diaporthin。
化合物13黄色无定型粉末;1H NMR (700 MHz,CD3OD)δ:7.33 (2H,m,Phe-H-3′,5′),7.29 (1H,t,J=7.0 Hz,Phe-H-4′),7.22 (2H,d,J=7.0 Hz,Phe-H-2′,6′),4.33 (1H,t,J=4.9 Hz,Phe-H-2),3.69 (1H,m,Leu-H-2),3.32(1H,dd,J=4.2,14.0 Hz,Phe-H-3a),2.98 (1H,m,Phe-H-3b),1.46 (1H,m,Leu-H-4),0.89 (1H,m,Leu-H-3a),0.76 (3H,d,J=6.3 Hz,Leu-H-5),0.71 (3H,d,J=6.3 Hz,Leu-H-6),0.07 (1H,m,H-3b);13C NMR (175 MHz,CD3OD)δ:170.6 (s,Leu-C-1),168.9 (s,Phe-C-1),136.7 (s,Phe-C-1′),131.8 (d,Phe-C-2′,6′),129.6 (d,Phe-C-3′,5′),128.5 (d,Phe-C-4′),57.4 (d,Phe-C-2),54.1 (d,Leu-C-2),45.2 (t,Leu-C-3),40.2 (t,Phe-C-3),24.6 (d,Leu-C-4),23.4 (q,Leu-C-5),21.4 (q,Leu-C-6)。以上数据与文献[21]报道基本一致,故鉴定该化合物为环(L-苯丙-L-亮)二肽。
化合物14无色针状晶体(甲醇);1H NMR (700 MHz,CD3Cl)δ:7.36 (2H,t,J=7.7 Hz,Phe-H-3′,5′),7.30 (1H,t,J=7.7 Hz,Phe-H-4′),7.23 (2H,d,J=7.0 Hz,Phe-H-2′,6′),5.91 (1H,s,Phe-NH),5.79 (1H,s,Ile -NH),4.25 (1H,m,Phe-H-2),3.93 (1H,m,Ile-H-2),3.45 (1H,dd,J=3.5,7.0 Hz,Phe-H-3a),2.92 (1H,dd,J=2.8,7.0 Hz,Phe-H-3a),2.03 (1H,m,Ile-H-3),1.30 (1H,m,Ile-H-4a),1.10 (1H,m,Ile-H-4b),0.99 (3H,d,J=7.0 Hz,Ile-H-6),0.90 (3H,m,Ile-H-5) ;13C NMR (175 MHz,CD3Cl)δ:167.1 (s,Phe-C-1),166.7 (s,Ile-C-1),135.5 (s,Phe-C-1′),129.7 (d,Phe-C-3′,5′),129.3 (d,Phe-C-2′,6′),127.7 (d,Phe-C-4′),60.2 (d,Phe-C-2),56.2 (d,Ile-C-2),40.5 (t,Phe-C-3),38.2 (d,Ile-C-3),23.7 (t,Ile-C-4),15.4 (q,Ile-C-6),11.9 (q,Ile-C-5)。以上数据与文献[22]报道基本一致,故鉴定该化合物为环(D-苯丙-L-异亮)二肽。
化合物1~14的核磁及其它相关详细结构鉴定数据原始图谱可从本刊官网免费下载( www.trcw.ac.cn)。
3 结论
此次研究从红树植物秋茄内生真菌Colletotrichumsp.SCSIO KcB3-2的次级代谢产物中共分离得到14个次级代谢产物,包括苯环衍生物(1~12)和环二肽类化合物(13~14),3~14均为首次从红树植物秋茄内生真菌中分离得到。文献报道显示3-chlorogentisyl alcohol(10)对耐甲氧西林以及多药耐药Staphylococcusaureus(MRSA,MDRSA)具有显著的抗菌活性,其MIC(最低抑菌浓度)为12.5 μM,并且表现了显著的抗氧化活性(DPPH 自由基清除能力),其IC50值为7.0 μM[18]。4-hydroxymellein(11)对Cladosporiumcladosporioides,C.sphaerospermum和S.aureus表现了一定的抑菌活性,其MIC值分别为 5.00,10.0,8.0 μg/mL[23,24]。真菌是红树林微生物资源多样性的主要类群,也是海洋天然产物以及新药研发的重要源泉。本研究丰富了红树植物内生真菌化学多样性,为进一步对红树林内生真菌次级代谢产物研究提供了参考。

