黄芩茎叶和藤茶抑菌作用及其联合应用研究
张 琳,宿晓蓉,徐 园,许利嘉,朱振华,曾建国,赵 明*,段金廒*
1南京中医药大学 江苏省中药资源产业化过程协同创新中心 中药资源产业化与方剂创新药物国家地方联合工程研究中心国家中医药管理局中药资源循环利用重点研究室,南京 210023;2中国医学科学院北京协和医学院药用植物研究所,北京 100193;3湖南农业大学 兽用中药资源与中兽药创制国家地方联合工程技术研究中心,长沙 410128
中药黄芩为唇形科植物黄芩ScutellariabaicalensisGeorgi.的干燥根,味苦性寒,为清热燥湿、泻火解毒常用药[1]。近年来,随着黄芩资源产业经济的快速发展,黄芩种植面积不断扩大,生产过程中产生了大量的黄芩茎叶且大都被废弃不用,不仅造成了资源的巨大浪费,同时亦衍生了较重的社会和环境压力。现代研究证实黄芩茎叶与根化学成分类别相似,均为黄酮类,根部作为药用具有苦、寒之性,主要含有黄芩苷、汉黄芩苷、黄芩素、汉黄芩素等成分,而茎叶黄芩苷、汉黄芩苷、黄芩素、汉黄芩素等含量较低,野黄芩苷、芹菜素7-O-β-D-葡萄糖醛酸苷、白杨素7-O-β-D-葡萄糖醛酸苷等成分含量相对较高,减弱了根部苦、寒的药性,但保留了清热燥湿、泻火解毒、消炎等功效[2]。研究发现黄芩茎叶及其成分对金黄色葡萄球菌、大肠杆菌、绿脓杆菌具有良好的抑菌效果[3-5]。
藤茶为葡萄科蛇葡萄属显齿蛇葡萄Ampelopsisgrossedentata(Hand.-Mazz.)W.T.Wang的嫩茎叶,是典型的民间药食两用藤本植物。据《中草药汇编》、《广西药用植物名录》、《广东药用植物手册》等记载,该药性味甘淡,功效清热解毒,主治黄疸型肝炎、风热感冒、咽喉肿痛等。藤茶在加工嫩枝干及生产操作中产生的碎叶片含有较高量的黄酮类成分,其中含量较高的二氢杨梅素可达到30%左右[6],且对大肠杆菌、金黄色葡萄球菌、痢疾杆菌等的生长具有较明显的抑制作用[7]。
金黄色葡萄球菌和痢疾杆菌均可通过食物污染引起人类常发细菌性疾病,危害人体健康[8];在食源性动物养殖中,金黄色葡萄球菌可引起食源性动物的伤口感染、乳腺炎、关节炎、腹泻等多种疾病,是奶牛乳房炎的主要致病因素之一,对食品安全及产业发展影响较大[9]。
本文以金黄色葡萄球菌和痢疾杆菌为研究对象,探究黄芩茎叶和藤茶的联合抑菌作用,以期为黄芩茎叶的资源化利用提供科学依据。
1 仪器与材料
DHG-9023A 型电热恒温鼓风干燥箱(上海昕仪),TDL-80-2B型离心机(上海安亭),FW80型高速万能粉碎机(天津泰斯特),超净工作台,恒温生化培养箱,Quitix125D电子天平(德国赛多利斯),IS-RDV1型恒温振荡器(美国精骐),KH-500型超声波清洗器(昆山),S-B50L型立式压力蒸汽灭菌器(江苏省金坛市医疗器械厂),96孔微量板(美国 Coring 公司),可调式移液枪(美国 Eppendorf 公司)。注射用青霉素钠(批号:H23020943);MH肉汤 (南京森贝伽生物科技有限公司)。金黄色葡萄球菌Staphylococcusaureus(ATCC 25923)、痢疾志贺氏菌Shigelladysenteriae(CICC 23829)。
黄芩茎叶,2017年8月采集于陕西省商洛,经南京中医药大学段金廒教授鉴定为唇形科黄芩属植物黄芩ScutellariabaicalensisGeorgi.的干燥茎叶,凭证标本存放于南京中医药大学江苏省中药资源产业化过程协同创新中心(编号SB-201708)。藤茶样品由中国医学科学院药用植物研究所许利嘉副研究员提供并鉴定为葡萄科蛇葡萄属显齿蛇葡萄Ampelopsisgrossedentata(Hand.-Mazz.)W.T.Wang的嫩茎叶,凭证标本存放于南京中医药大学江苏省中药资源产业化过程协同创新中心(编号AG-201701)。
2 方法
2.1 样品制备
2.1.1 黄芩茎叶黄酮富集部位(SSTF)
干燥黄芩茎叶,粉碎,10倍量70%乙醇热回流提取3次,减压回收溶剂后得黄芩茎叶醇提物。醇提物经石油醚萃取,萃余部分用30%乙醇溶解,经AB-8大孔树脂柱层析,收集60%乙醇洗脱馏分,浓缩并冷冻干燥,得黄芩茎叶黄酮富集部位(SSTF),该部位黄酮含量为22.42%,其中野黄芩苷的含量为6.14%。
2.1.2 藤茶醇提物(TE)
干燥藤茶,粉碎,10倍量70%乙醇热回流提取3次,减压浓缩并冷冻干燥,得藤茶醇提物(TE),测得藤茶中二氢杨梅素的含量为23.47%。
2.1.3 样品储备液
用灭菌MH肉汤将SSTF和TE分别配置成32、4 mg/mL的储备液。
2.2 菌悬液的制备
将各试验菌株接种于LB固体培养基,37 ℃活化培养增菌 18~24 h,取单个菌落于LB液体培养基中,37 ℃培养18~24 h。用灭菌MH肉汤培养基调整浊度至0.5麦氏(约为 1.5 × 109CFU/mL),备用。
2.3 SSTF和TE最小抑菌浓度(MIC)的测定
参照美国临床标准协会(CLSI)M07-A9微量肉汤稀释法[10]。600 nm OD值为1的菌液用麦氏比浊管稀释至0.5麦氏比浊度,继续稀释1 000倍得到试验用菌液(约为1.5 × 106CFU/mL),备用。分别测定SSTF和TE对金黄色葡萄球菌和痢疾杆菌两种试验菌株的MIC值。在灭菌96孔平底微量板上,第1列每孔加入100 μL供试药液和100 μL的MH肉汤培养基,混匀后,自第1列每孔取100 μL加至第2列每孔,并于第2列每孔续加100 μL的MH肉汤培养基,混匀,依次按上述2倍稀释法将SSTF和TE分别稀释至8~0.062 5 mg/mL 和 1~0.007 8 mg/mL。同时做空白培养基对照、氯霉素和注射用青霉素钠阳性药物对照。最后,各孔加入试验菌株的菌悬液100 μL(约为1.5 × 106CFU·mL-1)。置于37 ℃培养箱中培养 18~24 h,观察细菌生长状态,并用酶标仪检测各孔OD (600 nm)值。试验重复3次,每次平行3个复孔,取平均值测得SSTF、TE对金黄色葡萄球菌和痢疾杆菌的MIC值。
2.4 SSTF和TE的24 h时间—杀菌曲线
采用时间—杀菌曲线试验法[11],考察SSTF和TE对金黄色葡萄球菌、痢疾杆菌的杀菌效果。以各试验菌株的MIC值为依据,将SSTF和TE分别配置为1/2 × MIC、1 × MIC、2 × MIC、4 × MIC和8 × MIC浓度,各浓度取2 mL加入试管,再加入1.5 × 108CFU/mL的菌悬液2 mL,另取两支试管,其中一支试管加4 mL培养基做空白对照,另一支试管加入2 mL培养基和2 mL菌悬液做菌对照。于37 ℃下振荡培养,并于0、2、4、6、8、12、24 h分别取100 μL菌悬液,10倍倍比稀释后,取100 μL稀释液均匀涂布于LB固体平板上。37 ℃培养18~24 h后进行菌落计数。以时间点为横坐标,以不同时间点生长的菌落数的对数为纵坐标绘制时间杀菌曲线。试验重复3次,每次平行3份。
2.5 SSTF和TE联合用药指数的测定
采用微量棋盘稀释法[12],测定SSTF和TE联合应用的抑菌效果。在96 孔平底微量培养板上,以二维棋盘的纵向(A~H)和横向(1~12)两个方向,根据两药单用时对试验菌株的MIC值,将两药分别以4 × MIC~1/16 × MIC的质量浓度联合应用,每孔加入50 μL供试药液。最后加入1.5 × 106CFU/mL的菌悬液100 μL。在37 ℃下培养 18~24 h后观察各孔中细菌生长情况,通过酶标仪检测各孔600 nm OD值。试验重复3次,每次试验平行3个复孔。FIC指数 =C(SSTF 联合)/MIC(SSTF 单用)+C(TE 联合)/MIC(TE 单用),式中的MIC(SSTF 单用)和MIC(TE 单用)分别为SSTF和TE单用时的最低抑菌浓度,C(SSTF 联合)和C(TE 联合)为两药联用时MIC浓度下两药各自的浓度。(对于同一块96孔板,计算数据获得一系列FIC指数值,若FIC指数≤0.5,两药具协同作用;0.5
3 结果
3.1 SSTF和TE对金黄色葡萄球菌的抑制作用
3.1.1 SSTF和TE对金黄色葡萄球菌的抑菌曲线及MIC测定
SSTF和TE对金黄色葡萄球菌的抑菌曲线如图1,由图中可以看出,SSTF和TE对金黄色葡萄球菌MIC值分别为1.0 mg/mL和0.25 mg/mL,阳性对照青霉素的MIC为 0.25 μg/mL。

图1 SSTF(a)和TE(b)对金黄色葡萄球菌的抑菌作用Fig.1 Antibacterial effects of SSTF (a) and TE (b) against S.aureus
3.1.2 SSTF和TE对金黄色葡萄球菌的时间-杀菌曲线
SSTF和TE对金黄色葡萄球菌的时间-杀菌曲线分别如图 2(a)、2(b)所示。由图可知,空白对照样品中的金黄色葡萄球菌菌落数随培养时间增加而持续上升至饱和后趋于稳定,而添加SSTF和TE的样品中菌落数随培养时间增加而下降,表明细菌生长受到明显的抑制。
图2(a)所示,浓度为1×MIC的SSTF样品中金黄色葡萄球菌菌落数量明显低于空白对照组,并于4 h达到最低,说明MIC条件下SSTF可有效抑制金黄色葡萄球菌生长,4 h时达最强抑菌效果。当SSTF浓度为2×MIC、4×MIC时,菌落数随着时间持续下降,12 h后菌落全部死亡,表明添加2×MIC及以上浓度的SSTF对金黄色葡萄球菌具有良好抑制和杀灭作用。

图2 不同浓度SSTF(a)和TE(b)对金黄色葡萄球菌的时间-杀菌曲线Fig.2 Time-bactericidal curves of SSTF (a) and TE (b) against S.aureus under different concentrations
如图2(b)所示,MIC条件下TE可有效抑制金黄色葡萄球菌生长,6 h时达最强抑菌效果。2×MIC及以上浓度TE对金黄色葡萄球菌具有良好抑制和杀灭作用。
3.1.3 SSTF和TE联用对金黄色葡萄球菌的抑菌结果
SSTF联合TE对金黄色葡萄球菌的抑制活性OD值测定结果见图3。以空白培养基和非加药组的数值为指示OD值,OD值大于0.1的数值标记为灰色,即有菌生长,OD值小于0.1的数值标记为黑色,即无菌生长。由结果可知,在1/4×MIC SSTF-1/2×MIC TE和1/2×MIC SSTF-1/4×MIC TE的作用下,两药联合使用开始表现明显的抑菌作用。

图3 SSTF及TE对金黄色葡萄球菌的抗菌作用Fig.3 Antibacterial effects of SSTF and TE against S.aureus
基于SSTF和TE联合应用时的最低抑菌浓度计算相应的FIC值,并对两者联合作用进行评价。由表1中FIC值可以推断:SSTF和TE联合应用,对金黄色葡萄球菌生长抑制具有相加作用。

表1 SSTF和TE对金黄色葡萄球菌的联合抗菌作用
注:*两药联用时MIC浓度下各药的浓度。
Note:Concentration of each drug at MIC concentration in two drug-associated drugs.
3.2 SSTF和TE对痢疾杆菌的抑制作用
3.2.1 SSTF和TE抑菌曲线及MIC测定
SSTF和TE对痢疾杆菌的抑菌曲线如图4,由图可知,SSTF和TE对痢疾杆菌的MIC值分别为4 mg/mL和0.5 mg/mL,阳性对照氯霉素的MIC为10 μg/mL。{

图4 SSTF(a)和TE(b)对痢疾杆菌的抑菌作用Fig.4 Antibacterial effects of SSTF (a) and TE (b) against S.dysenteriae
3.2.2 SSTF和TE对痢疾杆菌的时间-杀菌曲线
SSTF和TE对痢疾杆菌的时间-杀菌曲线分别如图 5(a)、5(b) 所示。由图可知,空白对照样品中的痢疾杆菌菌落数随培养时间增加而持续上升至饱和后趋于稳定,而添加SSTF和TE的样品中菌落数随培养时间增加而下降,表明细菌生长受到明显的抑制。
与空白组对照,当加入浓度为1×MIC的SSTF时,菌落数量明显低于空白对照组,对痢疾杆菌的生长起到了抑制作用。当加入浓度为4×MIC和2×MIC的SSTF时,菌落数随时间持续下降,并于8 h后全部死亡,说明添加2×MIC及以上浓度SSTF对痢疾杆菌具有杀灭作用(图5(a))。

图5 不同浓度SSTF(a)和TE(b)对痢疾杆菌的时间-杀菌曲线Fig.5 Time-bactericidal curves of SSTF (a) and TE (b) against S.dysenteriae under different concentrations
如图5(b)所示,当加入浓度为MIC的TE时,菌落数明显小于对照组且随时间上下浮动较小,说明该药对痢疾杆菌的生长具有抑制作用。当加入浓度为 2×MIC、4×MIC 的TE时,菌落数随时间持续下降并于8 h后全部死亡,说明添加2×MIC及以上浓度TE对痢疾杆菌具有杀菌作用。
3.2.3 SSTF和TE联用对痢疾杆菌的抑菌作用
SSTF联合TE对痢疾杆菌的抑制活性OD值测定结果见图6,以空白培养基和非加药组的数值为指示OD值,OD值大于0.1的数值标记为灰色,OD值小于0.1的数值标记为黑色。结果显示,在1/4×MIC SSTF-1/2×MIC TE、1/2×MIC SSTF-1/4×MIC TE、1/2×MIC SSTF-1/8×MIC TE作用下,联合用药开始表现明显的抑菌作用。
基于SSTF和TE联合应用时的最低抑菌浓度计算相应的FIC值,并对两者联合作用进行评价。由表2中FIC值可以推断:SSTF和TE联合应用,对痢疾杆菌生长抑制具有相加作用。
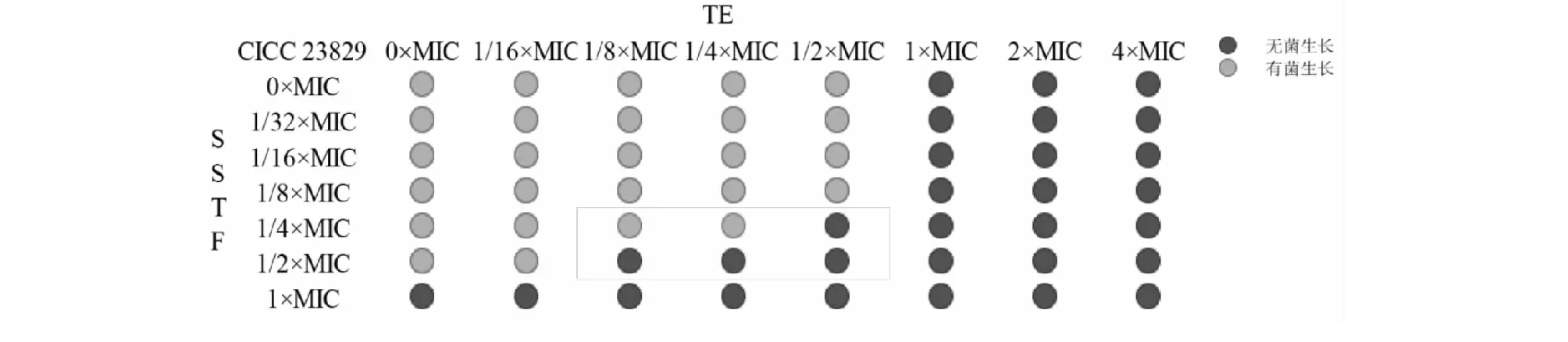
图6 SSTF和TE联合对痢疾杆菌的抗菌作用Fig.6 Antibacterial effects of SSTF and TE against S.dysenteriae

组别Group联用Combination(mg/mL)∗SSTFTEFIC指数FICI作用效果Efficacy1/4×MIC SSTF-1/2×MIC TE10.250.75相加1/2×MIC SSTF-1/4×MIC TE20.1250.75相加1/2×MIC SSTF-1/8×MIC TE20.06250.625相加1×MIC SSTF40--1×MIC TE00.5--
注:*两药联用时MIC浓度下各药的浓度。
Note:Concentration of each drug at MIC concentration in two drug-associated drugs.
4 讨论
金黄色葡萄球菌及痢疾杆菌是引起人类常发食源性疾病的主要原因之一。金黄色葡萄球菌可产生肠毒素,感染后引起恶心呕吐、腹部痉挛、水性或血性腹泻等胃肠道症状;而痢疾杆菌感染后则会出现发热、腹痛、腹泻、呕吐等典型症状[9]。金黄色葡萄球菌还可引起食源性动物的伤口感染、乳腺炎、关节炎、腹泻等多种疾病,是引起牛乳房炎的主要致病菌之一。目前全世界奶牛乳房炎感染率高达50%左右,我国奶牛乳房炎的平均感染率为70%(包括隐性型乳房炎)[13]。
本研究证实了黄芩茎叶与藤茶对金黄色葡萄球菌和痢疾杆菌均具有抑制作用,并通过时间-杀菌曲线证明在一定浓度下黄芩茎叶和藤茶均可对金黄色葡萄球菌和痢疾杆菌呈现杀菌作用。本文参照抗菌素联合作用常用的FIC指数值评价法,证实黄芩茎叶与藤茶联合应用抗菌具有相加作用,可在一定程度上起到对食源性疾病的预防作用。
本研究仅对黄芩茎叶同藤茶联合应用的抑菌作用做了初步探究,初步例证了基于联合应用策略从中药资源非药用部位发展应对致病菌感染有效措施的可行性。除了直接抑杀作用,中药资源尚可通过抗炎[14](抑制炎症因子表达、调节炎症相关信号通路)、增强溶菌酶活性、降解内毒素、影响内毒素释放、机体免疫调节等多个环节发挥防治致病菌感染疾病的作用。如黄芩苷对金黄色葡萄球菌致乳房炎具有明确抗炎作用,同时可增强实验动物溶菌酶活性[15],可降解革兰氏阴性菌内毒素[16];黄芩素可作用于革兰氏阴性菌第三分泌系统,影响毒力因子的合成与释放等[17]。而黄芩茎叶中包括黄芩苷、黄芩素在内的黄酮类成分,具备了标(抗炎等)本(杀菌)兼治相关致病菌感染疾病的物质基础。因此,可基于联合应用策略全面提升黄芩茎叶抑菌、抗炎、对抗毒力因子等功效,最终实现黄芩茎叶在食源性动物养殖及人类临床防治相关致病菌感染的资源化利用,不仅可解决其资源化利用问题、缓解环境压力,尚可一定程度上减少抗生素的使用,具有多重意义。

