CRISPR-Cas9敲除Notch1对CNE2细胞增殖及辐射敏感性的影响
汪宇洁,吕 涛,王孝深
复旦大学附属肿瘤医院放疗科,复旦大学上海医学院肿瘤学系,上海 200032
Notch信号转导通路在多种恶性肿瘤中被激活,并在肿瘤发生、发展、血管生成、肿瘤干细胞自我更新、辐射敏感性、化疗药物耐药[1-8]中具有重要作用。有学者发现在鼻咽癌(nasopharyngeal carcinoma,NPC)中,抑制Notch信号通路可降低NPC细胞增殖能力,增加辐射敏感性[9-11],相关microRNA可通过下调Notch1的表达降低NPC侵袭迁移能力[12]。Notch信号通路有4种Notch受体,功能多样,尽管一些临床试验已经研究了Notch抑制剂对实体瘤的作用,然而很少有研究确定对每个Notch受体及其相关基因的影响。既往关于Notch受体的实验研究多运用RNA干扰技术或γ-分泌酶抑制剂(γ-secretase inhibitors,GSI),然而两者均难以实现Notch信号途径中特定基因功能完全丧失。成簇规律间隔短回文重复序列及其关联核酸酶9(clustered regularly interspaced short palindromic repeat/CRISPR-associated nuclease 9,CRISPR-Cas9)系统作为第三代基因编辑技术,与以往的基因编辑技术相比,廉价、简单、精确、高效,已广泛应用于各种细胞乃至生物的基因编辑研究[13-16]。用CRISPR-Cas9技术特异性完全敲除Notch的体外研究尚未见报道。本研究在人鼻咽癌细胞CNE2中运用CRISPR-Cas9基因编辑技术成功敲除Notch1基因,观察特异性Notch1基因敲除对CNE2细胞增殖能力、辐射敏感性、侧群细胞比例的影响,为进一步体外研究Notch1在NPC细胞中的作用以及与其他信号通路相互作用关系奠定基础。
1 材料和方法
1.1 主要试剂
pSpCas9(BB)-2A-Puro(PX459)V2.0(Plasmid #62988)质粒受赠于复旦大学放射医学研究所华国强教授课题组。BbSI内切酶、Fast AP购自美国Fermentas公司,琼脂糖凝胶胶回收试剂盒、质粒提取试剂盒购自天根生化科技(北京)有限公司,大肠杆菌Stbl3、DNA Ligation试剂盒购自宝生物工程(大连)有限公司。LipofectamineTM2000、嘌呤霉素购自美国Invitrogen公司,DNA Marker、T4PNK购自英国New England Biolabs公司,免疫荧光固定液、荧光二抗、山羊血清购自上海碧云天生物技术有限公司,Notch1抗体购自美国Abcam公司。Hoechst33342、维拉帕米购自Sigma公司,细胞计数试剂盒(Cell Counting Kit-8,CCK-8)购自日本同仁化学研究所。
1.2 细胞系与细胞培养
人鼻咽癌低分化细胞系CNE2及人鼻咽正常永生化上皮细胞NP69为本课题组液氮保存细胞系,CNE2细胞系用含10%血清+1%青霉素、链霉素的RPMI-1640培养基培养,NP69细胞系用含1%青霉素、链霉素的KSFM培养基培养。
1.3 基因敲除载体构建
根据美国麻省理工学院张峰教授实验室CRISPR-Cas9基因编辑实验方案[17],利用在线设计工具(http://crispr.mit.edu/)设计针对Notch1基因的sgRNA并在上、下游引物添加相应的碱基。sgRNA退火形成双链后与经过BbsI酶切的PX459质粒连接,转化Stbl3感受态细菌,经过氨苄青霉素抗性平板筛选、挑克隆、摇菌、提取质粒,测序鉴定并选取正确克隆,获得基因敲除载体。
1.4 细胞转染、药物筛选、单克隆获取
将CNE2细胞铺种于6孔板,分为未转染的空白组(normal control,NC)、转染PX459空质粒对照组(control,Ctrl)、转染PX459-Notch1-sgRNA的实验组(Notch1),每孔细胞数约为5×105个。培养24 h待细胞密度达80%左右时用LipofectamineTM2000转染。转染48 h后使用嘌呤霉素3 μg/mL筛选抗性细胞,将24 h后存活的细胞进行梯度稀释后种于96孔板中,培养10 d后挑选单克隆细胞继续扩大培养。
1.5 蛋白质印迹法(Western blot)检测Notch1蛋白水平
将各个单克隆细胞系和对照组扩大培养后,使用RIPA裂解液裂解细胞提取蛋白并定量。利用10%的SDS-PAGE凝胶电泳分离蛋白后,采用恒定电流400 mA转膜80 min,用5%脱脂奶粉室温封闭2 h,加入一抗4 ℃温育过夜,TBST缓冲液洗膜3次,加入二抗37 ℃温育1 h,TBST缓冲液洗膜3次,采用ECL化学发光检测试剂盒检测蛋白水平。
1.6 免疫荧光染色观察Notch1蛋白水平
以5×105个细胞爬片,次日免疫染色固定液固定15 min,用0.5%Triton-X100通透15 min,10%山羊血清37 ℃封闭1 h,温育一抗(兔抗Notch1抗体,免疫荧光抗体稀释液,1∶200),放置湿盒中4 ℃过夜,FITC标记羊抗兔IgG抗体室温避光温育1 h,DAPI稀释液染核5 min,最后滴加荧光抗淬灭剂,指甲油封片。即刻荧光显微镜下观察。
1.7 CCK-8检测增殖活力
取对数期Parental组、Ctrl组和Notch1-KO组3组细胞,以500个细胞/孔接种于5块96孔板上,每组设5个复孔,每24 h进行CCK-8检测,共5 d。检测前每孔加入10 μL CCK-8,以RPMI-1640培养基设为空白对照。继续培养2 h后在自动酶标仪上测450 nm处的吸光度(D)值。
1.8 克隆形成实验检测辐射敏感性
放射线照射使用复旦大学放射医学研究所的137铯放射源装置,剂量率为0.75 Gy/min。对数期Parental组、Ctrl组和Notch1-KO组3组细胞用胰酶消化制备成单细胞悬液,计数后进行细胞梯度稀释,将不同数量细胞接种到6孔板中,细胞数分别为200、300、600、1 000和2 500个,吸收剂量分别为0、2、4、6和8 Gy,照射后12 d弃去培养液,PBS清洗,甲醇固定,结晶紫染色。计数形成的克隆数(≥50个细胞),计算接种效率(plating efficiency,PE)、存活分数(survival fraction,SF)。PE(%)=未照射组形成克隆数/接种细胞数,SF(%)=(形成克隆数/接种细胞数)/PE。在Origin 8.0软件中,使用多靶单击模型y=1-[1-exp(-x/D0)]n,拟合剂量存活曲线、计算放射生物学参数。
1.9 流式细胞法检测侧群细胞
将对数期Parental组、Ctrl组和Notch1-KO组3组细胞分别制备成1×106个/mL的单细胞悬液;检测组加Hoechst33342至终浓度5 μg/mL,对照组加50 μmol/L维拉帕米温育30 min,再加入Hoechst33342至终浓度5 μg/mL;37 ℃避光温育90 min,每隔15 min混匀1次;1 500 rpm 4 ℃离心5 min,PBS洗2次,加碘化丙啶至终浓度1 μg/ mL。用Beckman流式细胞仪检测:Hoechst 33342 被350 nm紫外光激发,荧光发射用405/BP30(Hoechst blue)和570/BP20(Hoechst red)滤光器测定,630/BP30滤光器去除死亡细胞(被碘化丙啶标记)。Gate设置为侧群细胞与主群细胞的交界处,每次以维拉帕米完全抑制这群细胞为准。
1.10 统计学处理
应用SPSS l9.0软件进行统计学分析。两组间均数比较采用t检验,多组均数比较采用单因素方差分析,两两比较采用最小显著性差异法,P<0.05为差异有统计学意义。
2 结 果
2.1 Notch1在鼻咽癌细胞株中表达量升高
经过与内参β-actin灰度值对比分析结果发现,CNE2中Notch1蛋白表达量比NP69高(P<0.001,图1)。
2.2 成功构建基因敲除载体
针对Notch1 CDS区设计了综合评分最高的sgRNA(图2A),Notch1-sgRNA上、下游序列见表1,测序验证sgRNA正确插入到PX459质粒中(图2B),成功构建了基因敲除载体。
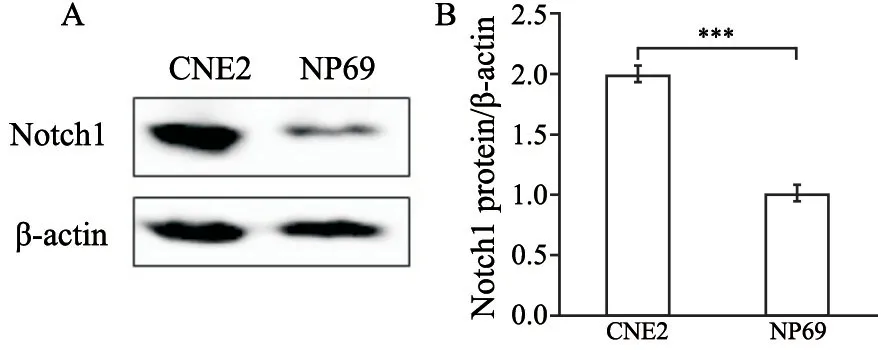
图1 CNE2细胞中Notch1蛋白水平升高Fig.1 Notch1 expression was higher in CNE2 cell line
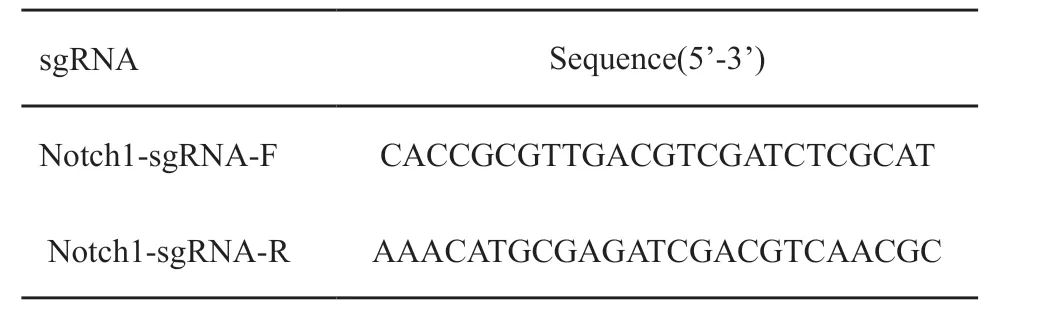
表1 sgRNA寡核苷酸序列Tab.1 The oligonucleotide sequence of sgRNA
图2 Notch1 sgRNA设计及重组载体测序验证Fig.2 Design of Notch1 sgRNA and verification of recombinant vector via sequencing
2.3 Western blot验证单克隆细胞中Notch1表达
图3A显示与NC和Ctrl组相比,挑取的8个CNE2单克隆细胞株中clone 3和clone 7未检出Notch1蛋白。将这两个克隆细胞继续扩大培养,再次验证(图3B)clone 7的Notch1完全无表达,将clone 7细胞继续培养,用于进一步实验。
2.4 免疫荧光验证Notch1无表达
图4显示DAPI染核呈蓝色荧光,Notch1呈绿色荧光,融合图像显示Parental、Ctrl细胞的Notch1位于细胞质、细胞膜区域,而Notch1-KO细胞未见Notch1绿色荧光。
2.5 Notch1基因敲除对CNE2细胞的增殖抑制作用
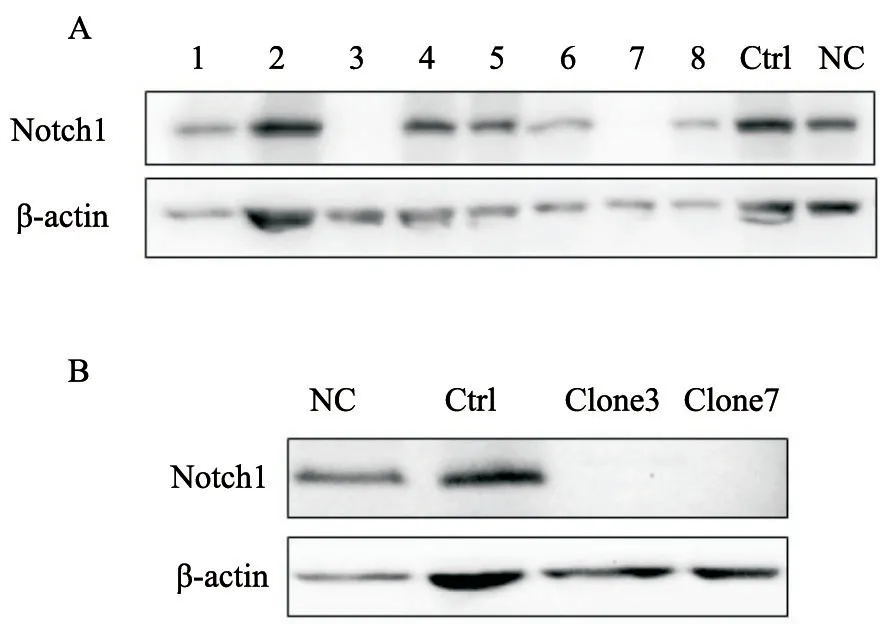
图3 Western blot鉴定Notch1基因敲除细胞系Fig.3 Identification of Notch1 gene knockout CNE2 cell line by Western blot

图4 免疫荧光检测Notch1-KO中无Notch1表达Fig.4 No Notch1 expression was detected in Notch1-KO by immunofluorescence

图5 Notch1敲除抑制CNE2细胞增殖能力Fig.5 Notch1 knockout inhibited proliferation of CNE2 cells
如图5所示,随着培养天数增加,Parental和Ctrl组的增殖曲线较一致,Notch1-KO组增殖曲线较平缓,经单因素方差分析两两比较,与Parental、Ctrl组相比,第1~5天Notch1-KO的吸光度均降低,差异有统计学意义(P<0.05)。Parental、Ctrl组之间比较差异无统计学意义(P>0.05)。
2.6 Notch1基因敲除增加CNE2的辐射敏感性
Parental组、Ctrl组和Notch1-KO组3组细胞经2、4、6、8 Gy γ射线照射的存活分数分别为0.715、0.269、0.063、0.008,0.679、0.256、0.056、0.007、0.567、0.153、0.028和0.005。克隆形成情况如图6A所示,运用多靶单击模型在Origin 8.0软件中拟合细胞存活曲线(图6B),从曲线模型计算的放射生物学参数见表2。结果显示,与Parental、Ctrl组相比,Notch1-KO组的D0、Dq、SF2降低,Notch1-KO组的辐射敏感性增加(P<0.001),Parental、Ctrl组之间辐射敏感性差异无统计学意义(P>0.05)。
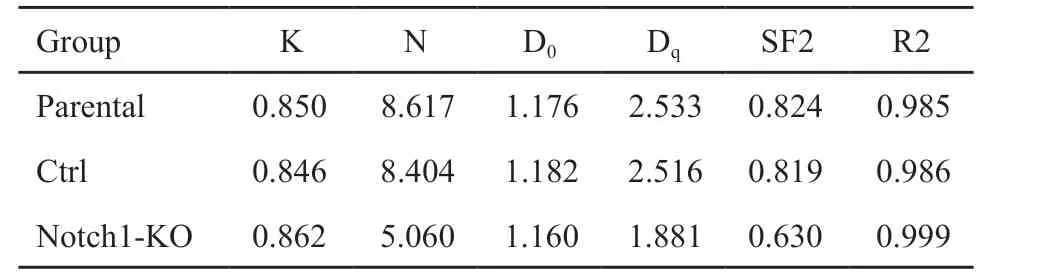
表2 细胞存活曲线放射生物学参数Tab.2 Radiobiological parameters of the cell survival curve
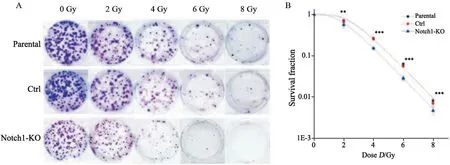
图6 Notch1敲除增加CNE2细胞辐射敏感性Fig.6 Notch1 knockout increased radiosensitivity of CNE2 cells
2.7 Notch1敲除降低CNE2的侧群细胞比例
Notch 1-K O 组中侧群细胞比例为(1.13±0.01)%,较Parental组的(3.81±0.03)%和C t r l 组的(3.7 0±0.0 3)%明显下降(P<0.001)。Parental、Ctrl组之间差异无统计学意义(P>0.05)。加入维拉帕米后,由于其具有拮抗ABCG2将染料Hoechst33342泵出细胞外的作用,上述3种细胞的侧群细胞比例分别降为0.000%、0.001%和0%(图7)。

图7 Notch1敲除降低CNE2细胞中侧群细胞的比例Fig.7 Notch1 knockout decreased the side population proportion of CNE2 cells
3 讨 论
哺乳动物中Notch信号通路有 4 种同源Notch受体,多种恶性肿瘤中都检测到Notch受体不同程度和类型的突变,不同受体在不同细胞中发挥的功能各异。体外研究中既往多使用RNA干扰技术、GSI、单克隆抗体抑制Notch信号通路活性,然而siRNA干扰不能完全丧失受体功能,单克隆抗体目前缺乏针对Notch4的抗体,GSI为非特异性抑制剂,临床研究发现GSI可诱发严重的不良反应,如胃肠毒性、肝毒性和肾毒性[18-19],临床特异性靶向Notch受体对提高肿瘤治疗效果、减轻不良反应尤为重要,因此仍需针对特异性受体的功能进行深入研究。
CRISPR-Cas9基因编辑技术可实现单个基因、位点的特异性突变,从而使特定基因完全丧失生物学功能。在头颈部鳞癌中,外显子组测序显示Notch1是继TP53后第二常见的突变基因[20-21]。本研究构建了靶向Notch1基因的CRISPR-Cas9基因敲除质粒,使鼻咽癌细胞CNE2中的 Notch1基因完全敲除。Notch1基因敲除后CNE2细胞的增殖能力下降,克隆形成实验结果显示Notch1基因敲除组D0、Dq、SF2均降低,D0为平均致死剂量,即照射后存活37%的细胞所需要的放射线剂量,D0值越低表示放射敏感性越高,Dq值表示细胞对亚致死损伤修复能力大小,Dq值越小,表明细胞的亚致死损伤修复能力越弱,放射线对细胞的杀伤力越大。Notch1基因敲除可增加CNE2细胞的辐射敏感性,与既往受体非特异性研究结果一致[9,11]。
Notch信号转导通路影响肿瘤细胞辐射敏感性的机制包括改变肿瘤细胞DNA损伤修复能力,改变肿瘤干细胞状态,调节上皮-间质转化,影响肿瘤血管生成,改变细胞乏氧状态等[22]。肿瘤干细胞目前被认为是导致辐射抵抗、化疗药物耐药的重要原因,Wang等[23]首次在鼻咽癌细胞CNE2中分离出侧群细胞,侧群细胞被认为是一群富含肿瘤干细胞的群体。本实验进一步检测侧群细胞比例,结果显示,Notch1基因敲除后SP比例较对照组下降约71%,既往使用非特异性Notch抑制剂的研究中CNE2细胞中侧群细胞比例下降约73%[10],由此推测Notch1受体在维持CNE2细胞群体中侧群细胞比例方面发挥着至关重要的作用,其潜在分子机制尚需进一步深入研究。
总之,本研究发现Notch1在鼻咽癌CNE2细胞中被激活,并运用CRISPR-Cas9技术特异性敲除Notch1基因进一步证实Notch1基因在CNE2细胞中的促进增殖和辐射抗性作用,Notch1基因缺失所致辐射增敏作用可能与降低干细胞样侧群细胞比例有关。本研究结果有助于进一步了解Notch1在鼻咽癌及其他头颈部鳞癌细胞中的特异性作用及其机制。
——一道江苏高考题的奥秘解读和拓展

