既往未行ALK抑制剂治疗的ALK阳性NSCLC应用布加替尼对比克唑替尼的Ⅲ期随机对照研究
本期分享的是2018年9月25日在线发表在《新英格兰医学杂志(New England Journal of Medicine,NEJM)》上的ALTA-L1研究的第一次中期分析结果。ALTA-L1研究是对既往未行ALK抑制剂治疗的ALK阳性非小细胞肺癌(nonsmall cell lung cancer,NSCLC)应用布加替尼(brigatinib)对比克唑替尼(crizotinib)的Ⅲ期随机对照临床试验(randomized controlled trial,RCT)[1]。
1 研究背景
间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)通路的异常活化是NSCLC的重要致病机制。ALK通路的异常活化是通过ALK基因发生融合突变,即致病必须通过与融合伴侣基因结合来发挥作用。主要的发生在Exon20外显子上的融合伴侣基因是EML4,其他的融合伴侣基因还有KIF5B、TFG、KLC1和PTN3等,ALK基因的激酶域共有10个外显子(Exon 20-29),目前发现ALK基因有27种融合突变形式,因此检测时需确保这些融合位点都做了详细的覆盖,避免漏检[2]。ALK相关的ATP竞争性酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)可与EML4-ALK受体中的ATP区域结合,竞争性抑制ATP结合,产生抗肿瘤作用。但是激酶域突变会影响药物进入ALK活性位点的能力,使药物失效,导致耐药。三代ALK抑制剂的特点如下:一代ALK抑制剂克唑替尼,特点是抑制作用广泛的小分子TKI,但其脑组织中浓度较低,不能透过血脑屏障[3-5];二代A L K 抑制剂包括艾乐替尼(alectinib)、布加替尼、色瑞替尼和恩沙替尼(ensartinib),二代较一代在化学结构中添加了基团,增加脂溶性,这样更容易透过血脑屏障;三代lorlatinib,属于全能抑制剂,几乎对所有耐药位点均有效。ALK的耐药机制主要包括4个方面:① ALK激酶域继发性耐药突变,继发耐药突变则主要发生在21-25外显子上,与融合基因的结合发生在20外显子上有所不同。② ALK融合基因拷贝数扩增。以上两种是ALK占优势的继发性耐药突变,可以使用更有效的后代ALK抑制剂。目前常见的耐药激酶域有:L1196M(守门员突变)、C1156Y、F1174L、L1153R、D1203N、S1206Y、G1260A、G1269A、1151Tins及G1202R等。它们很多时候都是同时存在的,即突变具有广谱性,使得ALK药物耐药机制异常复杂。③ 旁路和下游通路的激活,其驱动基因转换为其他基因的靶向药物。④ 上皮-间质转化,需要二次检测后决定[6-8]。
肺癌ALK突变的患者有以下临床特点:突变率低,仅占晚期NSCLC的5%[9-11];年轻、女性、亚裔、不吸烟的患者较易出现该基因突变,组织学亚型中,黏液型腺癌中出现的比例较大;无合并表皮生长因子受体(epidermal growth factor receptor,EGFR)基因或KRAS突变,与其他驱动基因存在互相排斥,即如果有ALK突变,那么其他驱动基因的突变可能性比较小;不治疗预后最差,对化疗不敏感;ALK抑制剂治疗效果佳,客观缓解率(objective response rate,ORR)为70%;间变性大细胞淋巴瘤(anaplastic large cell lymphoma,ALCL)、炎性肌纤维母细胞瘤(inflammatory myofibroblastic tumor,IMT)等也存在不小比例的ALK阳性患者。
基于PROFILE 1014和PROFILE 1029两项研究结果,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南推荐对于ALK重排阳性的NSCLC的一线治疗为使用一代或二代ALK抑制剂而不是化疗。ORR分别为74%和45%(PROFILE 1014研究),87%和46%(PROFILE 1029研究);无进展生存期(progression-free survival,PFS)为10.9个月和7.0个月(PROFILE 1029研究)[12]。
布加替尼是二代ALK-TKI,覆盖范围广,可覆盖ALK、ROS1、胰岛素样生长因子1受体(insulin-like growth factor 1 receptor,IGF-1R)、FLT-3以及EGFR突变等多个靶点。可用于ALK(L1196M)/EGFR(T790M)双靶点治疗。另外它不是Pgp作用的底物,脑内浓度高[13-16]。
克唑替尼耐药后的Ⅱ期研究ALTA研究显示222例Ⅳ期ALK阳性的NSCLC患者应用克唑替尼失败,按1∶1随机分为两组,A组患者每天口服布加替尼 90 mg qd,B组患者给予应用布加替尼180 mg qd。该研究的研究终点是研究者评估的ORR,高剂量组 ORR达到54%,PFS达到16.7个月,总生存期(overall survival,OS)达到34.1个月。另外对于脑转移患者而言,颅内ORR为67%,颅内疾病控制率(disease control rate,DCR)为83%[17-20]。
2 研究方法
该研究是开放标签Ⅲ期随机对照临床试验。主要研究终点:独立评审委员会确定的PFS(与ALEX不同);次要研究终点:研究者评估的PFS、ORR和OS;分层因素:是否有基线脑转移,是否完成至少一次化疗。
该研究采用了独立评审委员会确定的PFS,之所以采用这个研究终点,与美国食品药品管理局(Food and Drug Administration,FDA)的相关规定有关。对于以PFS作为研究终点的研究,FDA要求应当尽可能地采用双盲设计。对于开放标签的研究,应当采用独立评审委员会评估的PFS作为主要研究终点或者至少是次要研究终点。对于双盲研究,可以采用研究评估的PFS作为主要研究终点。评价间隔在两组之间要统一,评价间隔的设定应当可以基于预期中位PFS合理设定。
样本量计算:预计对照组中位PFS为10个月,试验组可以延长PFS到16个月(HR=0.625,α=0.05,Power=90%),需要事件数为198。其中包括两次期中分析,一共3次分析。计算样本量时使用Group-Sequential设计。3次分析,第1次是在50%的事件发生时进行,第2次是在75%的事件发生时进行,第3次是在100%的事件发生时进行。通过计算需要266例患者,194个事件发生。3次分析的α值分别是0.003、0.018和0.044。第1次期中分析就已达到了界值,得到了阳性结果,因此本文是基于第1次期中分析的结果报道的。
3 结果
该研究2016年4月—2017年8月入组的全部结束,共有275例患者纳入研究,试验组137例,对照组138例。所有的基线因素[性别、美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分、FDA批准的ALK检测方式、既往应用化疗的情况及对化疗的最佳反应情况]两组均衡。275例中基线有脑转移的患者为81例,试验组为29%,对照组为30%(表1)。
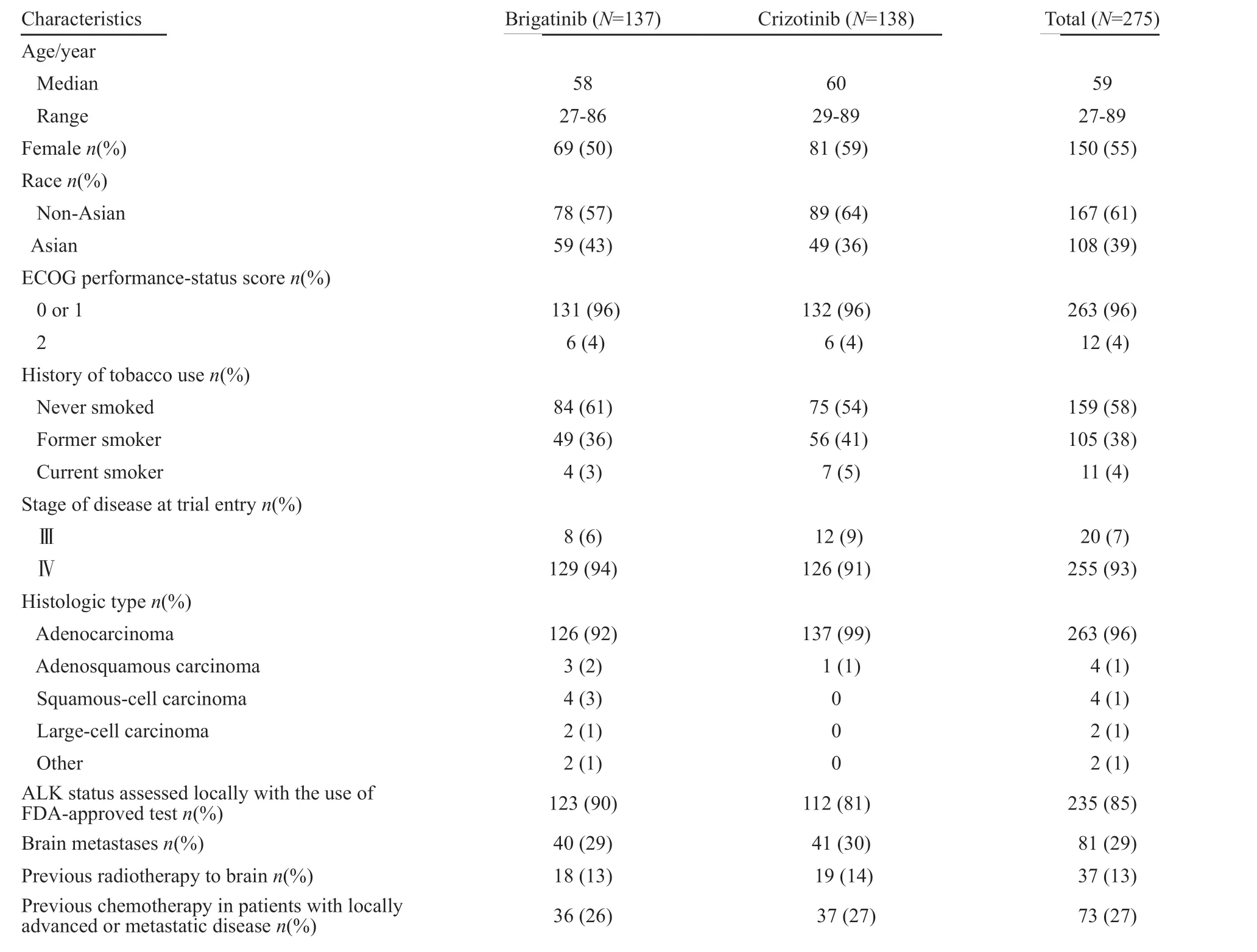
表1 意向性原则(intention to treat,ITT)分析集人群中的基线情况Tab.1 Baseline patient characteristics in the intention-to-treat (ITT) population
两组患者的主要研究终点:布加替尼组的PFS未达到,克唑替尼组为9.8个月(HR=0.45,P=0.000 1),布加替尼组1年PFS为67%,克唑替尼组为43%(图1)。布加替尼组1年OS率为85%,克唑替尼组为86%。亚组分析中,所有亚组都倾向于布加替尼组更好(图2)。
两组的ORR分别是71%对比60%,多次评估ORR分别为76%和73%,差异不显著。对于脑转移的患者两组ORR及多次评估ORR分别为78%和29%,83%和33%,试验组明显提高。基线有脑转移的患者1年无颅内失败率分别为67%和21%(表2)。

图1 主要研究终点PFS差异有统计学意义Fig.1 Primary end point PFS showed statistically significant differences between brigatinib group and control group

图2 亚组分析Fig.2 All subgroups preferred brigitinib to control group

表2 独立评审委员会评估的系统及颅内客观缓解情况Tab.2 Rates of systemic and intracranial objective response assessed by blinded independent review
OS结果还未达到。ITT人群中两组共有34例死亡,布加替尼组17例(12%),克唑替尼组有17例(12%)。1年OS率布加替尼组为85%,克唑替尼组为86%,中位生存时间未达到。
所有患者最常见的不良反应有胃肠道反应、肌酐激酶升高、转氨酶升高,布加替尼组3级以上的不良反应发生率为61%,克唑替尼组为55%。布加替尼组发生率较高的不良反应有肌酐升高、咳嗽、高血压、脂蛋白升高。克唑替尼不良反应的发生率相对更高,主要有恶心、呕吐、食欲下降、腹泻、便秘、周围水肿、转氨酶升高、闪光幻觉、视觉损伤及味觉异常(表3)。

表3 两组不良反应情况Tab.3 Adverse events of any grade that differed by more than 5 percentage points in frequency between groups[n(%)]
4 讨论
4.1 HR的解读
总体HR=0.49,总体较克唑替尼组降低了51%的疾病进展死亡风险;既往未行化疗的HR=0.55,既往行化疗的患者与未行化疗的患者相比差异显著(HR=0.35);基线有脑转移的患者,两组早期脑部病灶的进展差异最显著(HR=0.20);基线无脑转移的患者,差异无统计学意义(HR=0.72,P>0.05)。
4.2 ALEX研究
ALEX研究中,二代药物艾乐替尼完胜克唑替尼[21]。艾乐替尼组的总体有效率为82.9%,克唑替尼组的有效率为75.5%。对于有明确脑部病灶的患者,艾乐替尼的有效率为81%,克唑替尼组的有效率只有50%(表4)。在ALEX研究的后续分析研究中艾乐替尼组的PFS为34.8个月,克唑替尼组只有10.4个月[22]。ALTA-L1研究和ALEX研究设计上有以下几点不同:ALEX研究的主要研究终点是研究者评估的PFS,之前无化疗是真正的一线应用艾乐替尼,并且观察组进展后不能交叉。ALTA-L1研究的主要研究终点是独立评审委员会评估的PFS,之前可行一线以内的化疗,应用观察组进展后可交叉,因此后者更符合实际临床的情况。
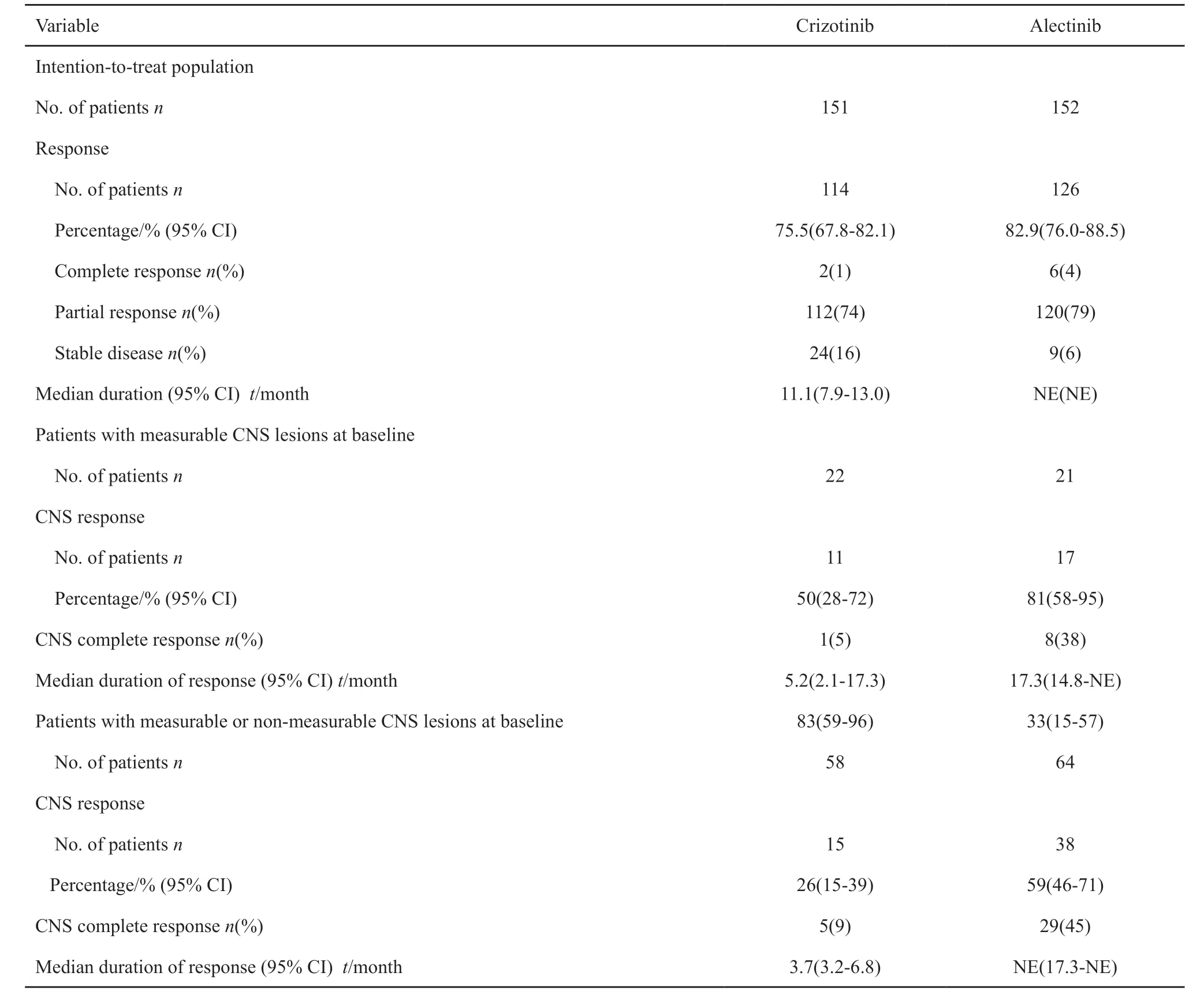
表4 ITT人群及脑转移患者的客观缓解率Tab.4 Objective response rates in the intention-to-treat population and among patients with CNS lesions at baseline
4.3 局限性
研究结束后后续治疗的应用可能会使OS的结果产生混杂,期待其长期随访的结果。
4.4 思考
克唑替尼应该继续作为一线治疗药物,把二代抑制剂留到耐药以后,还是一开始就应该使用更强的ALK抑制剂来获得更好的效果和更长的缓解时间?ALEX研究和J-ALEX研究更新数据似乎已经给出了一致的答案:在未经治疗的ALK阳性NSCLC中,一线艾乐替尼在疗效和安全性方面显著优于克唑替尼。通过以上我们提到的研究,NCCN指南(2019.V2)指出对于ALK重排阳性患者一线治疗,布加替尼被添加到一线治疗中,目前一线可用药物包括克唑替尼、色瑞替尼、艾乐替尼和布加替尼,在一线的四种药物中,艾乐替尼作为首选,克唑替尼放在了最后。
5 结论
布加替尼是ALK(L1196M)/EGFR(T790M)双靶点治疗药物,并且血脑屏障透过率好;既往Ⅱ期研究及第一次Ⅲ期RCT中期分析结果喜人:PFS未达到vs 9.8个月(HR=0.45,P=0.000 1),1年PFS为67% vs 43%;安全性可耐受,有望超过艾乐替尼的数据。期待今后会有长期随访的结果,使其成为一线治疗首选药物。

