一种结肠癌干细胞上皮-间质转化分层模型的建立和验证
李 鹏,马晓莹,李小嘉,金文琪,丁旭枫,郭修田
1.上海中医药大学附属市中医医院肛肠科,上海 200070;2.华东理工大学药学院,上海 200237
结直肠癌(colorectal cancer,CRC)是世界范围内第二位常见的癌症类型,也是导致癌症相关死亡的第四大原因,占全部癌症病例的9.7%,占全部癌症死亡人数的8.5%[1]。由于肿瘤干细胞(cancer stem cells,CSC)群体的存在,大多数癌症对化疗药物具有抗性,最终导致复发[2]。CSC是具有自我更新、去分化、致瘤性及固有化学和放射疗法抗性的肿瘤细胞亚群[3]。通过结肠癌细胞表面表达的标志分子如CD133、CD44、CD29及乙醛脱氢酶1(aldehyde dehydrogenase 1,ALDH1)等从结肠癌中分离得到少部分具有干细胞特性的结肠癌细胞即结肠癌干细胞,以这部分肿瘤干细胞作为肿瘤治疗靶点将为肿瘤治疗拓展新的方向[4]。
上皮-间质转化(epithelial-mesenchymal transition,EMT)是在原肠胚形成期间创建中胚层的发育过程,其中上皮细胞获得迁移间充质表型[5],其是肿瘤侵袭和转移的重要驱动因素,导致许多癌症患者死亡。有研究者[6]指出特定表面标志物不能作为分选肿瘤干细胞的标志分子,不同文献中对分选后CSC功能性实验结果也存在矛盾与差异。有研究者[7]认为CSC存在不同的细胞亚型,且不同CSC亚型对化疗抵抗的程度不尽相同。表型可塑性的不同是CSC亚系中治疗抵抗不同的关键因素。在肿瘤侵袭和转移中,表型可塑性很重要,同时预示表型可塑性和治疗抵抗的CSC亚系可能成为治疗干预的重要靶标。本文以CD44和细胞上皮黏附分子/上皮特异性抗原(epithelial cell adhesion molecule/epithelial specific antigen,EpCAM/ESA)为肿瘤干细胞标志物,分选人结肠癌细胞系HCT116移植裸小鼠形成的皮下移植瘤和腹腔转移瘤中不同分型的结肠癌干细胞亚群(Epi-S、Epi-P、pEMT-S和pEMT-P),以分析它们之间多药耐药和自我更新能力表型的差异性,从而建立一种新型结肠癌干细胞EMT分层模型,以评价不同活性物质对不同分型的结肠癌干细胞表型的影响。并用当下研究成熟的miR-139-5p及其靶基因TCF4验证该模型评价EMT的可行性,为临床研究提供理论依据。
1 材料和方法
1.1 实验材料
1.1.1 动物
SPF级健康雄性BALB/c-nu/nu小鼠10只,4~6周龄,体质量14~18 g,购自上海杰思捷实验动物有限公司[生产许可证号:SCXK(沪)2018-0004],适应性喂养1周,置于无菌、恒温、恒湿的环境中,自由摄取食物和饮水。
1.1.2 试剂
戊巴比妥钠、DMEM培养基和B27购自美国Sigma公司,胎牛血清购自美国Gibco公司,青霉素、链霉素购自华北制药股份有限公司,一抗CD44-FITC、ESA-PE购自美国Thermo Fisher公司,E-cadherin、N-cadherin、vimentin和β-actin购自上海泊湾生物科技有限公司,作为二抗的HRP标记山羊抗兔IgG抗体购自美国Jackson公司,高纯度质粒小提试剂盒购自天根生化科技(北京)有限公司。采用美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库搜索目的基因mRNA序列,Primer Premier 5软件设计PCR引物,引物序列均由华大基因科技有限公司合成。
1.1.3 仪器和设备
电子分析天平购自上海精密科学仪器有限公司(型号:FA2004N),高速冷冻离心机(型号:V14/14R)购自美国Dynamica公司,荧光显微镜(型号:Ti-S)购自日本尼康公司,流式细胞仪(型号:FACSCalibur)购自美国BD公司,PCR基因扩增仪(型号:T100TM)、荧光定量PCR仪(型号:CFX96)均购自美国Bio-Rad公司,生物电泳图像分析系统(型号:FR-980)购自上海复日科技有限公司。
1.2 方法
1.2.1 皮下移植瘤和转移瘤造模及原代细胞提取
将150 μL约1×106个HCT116细胞接种于BALB/c裸小鼠双侧腋下;将100 μL约1×107个HCT116细胞原位接种于BALB/c裸小鼠小肠壁上,并于腹腔内注射1×106个细胞。剪碎组织,切成1 mm3小块,加入2 000 U/mL胶原酶。在37 ℃水浴中消化30 min,去除消化液,用PBS洗2次,300×g离心8 min,培养基洗1次后,用含5%FBS的DMEM/F12完全培养基悬浮,并用吸管吹打分散制成细胞悬液,计数。
1.2.2 流式细胞仪分析与分选
收集消化后的含有约1×107个细胞的细胞悬液,300×g离心,2.5%BSA于37 ℃封闭30 min;CD44-FITC抗体和ESA-PE抗体4 ℃同时温育45 min,PBS洗2遍;用500 μL流式缓冲液重悬细胞上机。分选细胞时注意无菌操作。
1.2.3 MTT法检测
根据实际需要设计空白组及实验组的平行孔,对细胞进行特定的前处理,不同浓度奥沙利铂(oxaliplatin,LOHP)(0、6.25、12.50、50.00和100.00 μg/mL)和氟尿嘧啶(fluorouracil,5-FU)(0、12.50、25.00、50.00和200.00 μg/mL)作用细胞48 h。在前处理终止后,用移液器吸去细胞上清液,并加入含有5 mg/mL MTT的培养基;放置在37 ℃、CO2体积分数为5%的培养箱温育4 h;再次吸走上清液,加入100 μL的二甲基亚砜(dimethyl sulfoxide,DMSO),震荡1 min,待甲臜完全溶解后,采用Enspire多功能微孔板检测系统(美国Perkin Elmer公司)在492和630 nm双波长处分别检测其光密度值(D值);根据以下公式计算细胞存活率:细胞存活率=[D实验组平均值-D背景组平均值]/[D空白对照组平均值-D背景组平均值]×100%。
1.2.4 实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)检测
配置反转录体系(7 μL ddH2O;1 μL Oligo(dT)18引物;10 μL R-Mix;1 μL E-Mix;1 μL gDNA去除剂)于掌式离心机上快速离心1 min,驱除气泡;反转录RTFQ-PCR程序:2 5 ℃ 5 m i n,4 2 ℃ 3 0 m i n,8 5 ℃5 min。配制20 μL RTFQ-PCR反应体系:10 μL SYBR® Premix EX TaqTMⅡ,2 μL cDNA模板,0.2 μL顺义链引物(50 μmol/L),0.2 μL反义链引物(50 μmol/L),7.6 μL DEPC H2O。反应条件为95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,共循环40次;65 ℃ 15 s;95 ℃ 10 s。反应结束后通过扩增曲线和融峰曲线对引物特异性进行验证,每项反应做3个复孔,重复3次,结果取平均值。
1.2.5 Transwell侵袭实验
将Matrigel基质胶从-20 ℃取出于4 ℃冰箱过夜,在4 ℃条件下将Matrigel基质胶用无血清的DMEM/F12细胞培养基稀释至300 μL/mL,取100 μL均匀涂抹一层于PET膜上表面,37 ℃放置3 h左右。在下室(即24孔板底部)加入600 μL含10%血清的培养基,上室加入150 μL 5×104个细胞悬液,继续在温箱培养48 h;将其下表面浸泡在4%多聚甲醛溶液中,固定30 min,用0.1%结晶紫染色、镜检,并计算PET膜下表面的细胞数,计算中间和四周8个视野,取平均值。
1.2.6 蛋白质印迹法(Western blot)检测
采用7.5%蛋白质SDS聚丙烯酰胺凝胶电泳,按蛋白定量结果上样,以70伏电压使溴酚蓝条带电泳离开浓缩胶,以120 V电压电泳约1.5 h;之后进行转膜,使用0.45 μm PVDF膜,采用250 mA电流湿转2 h,TBST漂洗2 h,5%BSA室温封闭2 h,加入一抗[E-cadherin(AB3386)、N-cadherin(CY5015)、vimentin(AB3339)和抗鼠抗体]按1∶1 000比例稀释,4 ℃过夜温育、漂洗、二抗封闭、漂洗、显影,最后采用Image J图像处理软件分析条带。
1.2.7 miR-139-5p过表达载体构建
依据pcDNA3.1+载体和目的片段设计引物正义链为5'-CGTGTATTCTACAGTGCACGTGT CTCCAGTGTGGCTCGGAGGCTGGAGACGCG GCCCTGTTGGAGTAACC-3',反义链为5'-TC GAGGTTACTCCAACAGGGCCGCGTCTCCAG CCTCCGAGCCACACTGGAGACACGTGCAC TGTAGAATACACGGTAC-3';引物退火:5 μL上游引物,5 μL下游引物,5 μL 10×NEB缓冲液235 μL ddH2O,95 ℃ 4 min,70 ℃ 10 min。双酶切载体采用Kpn I和XhoI双酶切pcDNA3.1+,连接参考普通过表达载体的连接体系,转化参考普通过表达载体的转化体系,阳性克隆检验采用通用引物进行菌落验证将阳性克隆送测序公司进行测序。
1.2.8 TCF4(NM_001083962.1)过表达载体构建
依据pEGFP-n1载体和目的片段设计引物。正义链为5'-CCGCTCGAGGCCACCATGCATCA CCAACAGCGAATGGCTG-3',反义链为5'-CC GGAATTCGCATCTGTCCCATGTGATTCGATG CG-3'。扩增TCF4片段,切胶回收,DNA纯化(StarPrep快速DNA胶回收试剂盒);对载体和纯化片段进行EcoRI和XhoI双酶切;16 ℃过夜酶连,酶连试剂盒购自宝生物工程(大连)有限公司;将酶连产物进行重组反应,转化,涂板,长出单克隆点;对克隆进行挑点摇菌扩增,提取质粒后送测序。
1.2.9 TCF4敲低载体构建
根据Sigma-Aldrich网站(http://rnaidesigner.thermofisher.com/rnaiexpress/)给出的shRNA序列和pSilencer2.1_U6载体说明书设计引物。正义链为5'-GATCCGTCATTGGACCTTCTCATAACTC AAGAGATTATGAGAAGGTCCAATGATTTTTT GGAAA-3',反义链为5'-AGCTTTTCCAAAAA ATCATTGGACCTTCTCATAATCTCTTGAGTTA TGAGAAGGTCCAATGACG-3'。两条引物退火[寡核苷酸退火缓冲液(5×),上海碧云天生物技术有限公司],载体HindⅢ和BamHI双酶切;16 ℃过夜酶连[宝生物工程(大连)有限公司],将酶连产物进行重组反应、转化、涂板、长出单克隆点;对克隆进行挑点摇菌扩增,提取质粒后送测序。
1.2.10 统计学处理
使用Graphpad Prism 5.0进行统计学分析后作图,实验数据统一以x±s的形式表示,Student's t检验评价各受试组与对照组之间的差异,P<0.05为差异有统计学意义。
2 结 果
2.1 流式细胞术分析结直肠癌细胞株CD44+/ESA+细胞比例
透明质酸受体CD44是一类重要的黏附分子,与肿瘤转移密切相关。EpCAM/ESA是一种单次跨膜蛋白,于1979年由Herlyn等在结肠癌中发现,被认为是人类结肠癌组织主要的肿瘤相关抗原,可作为结肠癌靶向给药的潜在靶点。我们选取了5种常用的人结直肠癌细胞系HT-29、Caco-2、HCT116、LOVO和HCT8。采用流式细胞术分别检测了这些细胞的CD44-FITC和ESA-PE抗体染色的双阳性比率。HT-29、Caco-2、HCT116、LOVO和HCT8中ESA+CD44+百分比分别为29.900%、0.410%、24.100%、0.135%和0.970%(图1)。我们最终选取了HCT116细胞作为后续动物模型和细胞分选的材料。
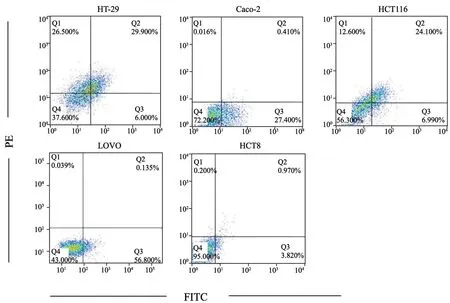
图1 流式细胞仪分析结直肠癌细胞株HT-29、Caco-2、HCT116、LOVO和HCT8细胞表面CD44-FITC和ESA-PE双阳性亚群情况Fig.1 Flow cytometry was used to analyze the expressions of CD44-FITC and ESA-PE double positive subpopulation on the surface of colorectal cancer cell lines HT-29, Caco-2, HCT116, LOVO and HCT8
2.2 构建HCT116 BALB/c裸小鼠皮下移植瘤和转移模型
按之前所示方法构建小鼠皮下瘤和转移瘤模型。皮下接种细胞5 d即肉眼可见突起的结节。4周后,皮下瘤生长至100 mm3,无菌环境下,提取皮下瘤原代细胞。打开小鼠腹腔,观察到小肠壁上肉眼可见瘤块,腹膜上形成转移结节,仔细剥离腹膜上5个白色米粒大小的转移结节,提取并收集转移灶细胞,于37 ℃、CO2体积分数为5%的环境中培养,连续传代(图2)。
2.3 流式细胞术分选
以CD44和ESA为结肠癌干细胞标志物,采用流式细胞仪分选1×107个台盼蓝染色鉴定细胞活力>95%皮下移植瘤原代细胞中CD44+ESA+、CD44+ESA-细胞亚群和转移瘤中CD44+ESA+、CD44+ESA-细胞亚群,分别命名为Epi-S、Epi-P、pEMT-S和pEMT-P。亲本株HCT116作为后续实验的阴性对照。Epi-S的CD44+ESA+占90.3%,Epi-P的CD44+ESA-占90.4%,pEMT-S的CD44+ESA+占97.8%,以及pEMT-P的CD44+ESA-占78.1%。结果见图3。分选后的各分型细胞培养在肿瘤干细胞培养基中:DMEM/F12 5 mL、20 ng/mL EGF、10 ng/mL bFGF、5 μg/mL胰岛素、0.4% BSA、2%B27和100 U/mL P/S)。
2.4 验证分选后不同细胞亚群的多药耐药性、克隆形成能力
不同的CSC分型对细胞侵袭转移,体内癌症转移和化疗抵抗的程度不尽相同。我们采用MTT和克隆形成实验验证不同细胞亚群的多药耐药性和克隆形成能力,分选后的细胞亚群在干细胞培养基中适应性培养1周后,传代一次,用于功能鉴定实验的初始细胞浓度为1×106个/mL(图4)。相较于HCT116亲本细胞株,Epi-S、Epi-P、pEMT-S和pEMT-P共4种CSC分型均对LOHP和5-FU产生了不同程度的抗性。其中,亲本细胞株对LOHP和5-FU的IC50值分别为11.89和3.09 μg/mL,Epi-S为37.41和27.29 μg/mL,Epi-P为15.67和14.97 μg/mL,pEMT-S为34.95和26.26 μg/mL,pEMT-P为16.15和45.70 μg/mL。在2% FBS血清中培养7 d后,各组培养物于4%多聚甲醛中固定,用0.1%结晶紫染色。结果发现,Epi-S、Epi-P、pEMT-S和pEMT-P共4种CSC分型与亲本株相比,克隆形成能力均增强,这可能与分选后的细胞获得了干细胞的自我更新能力相关。
2.5 构建miR-139-5p过表达、TCF4过表达/敲低质粒
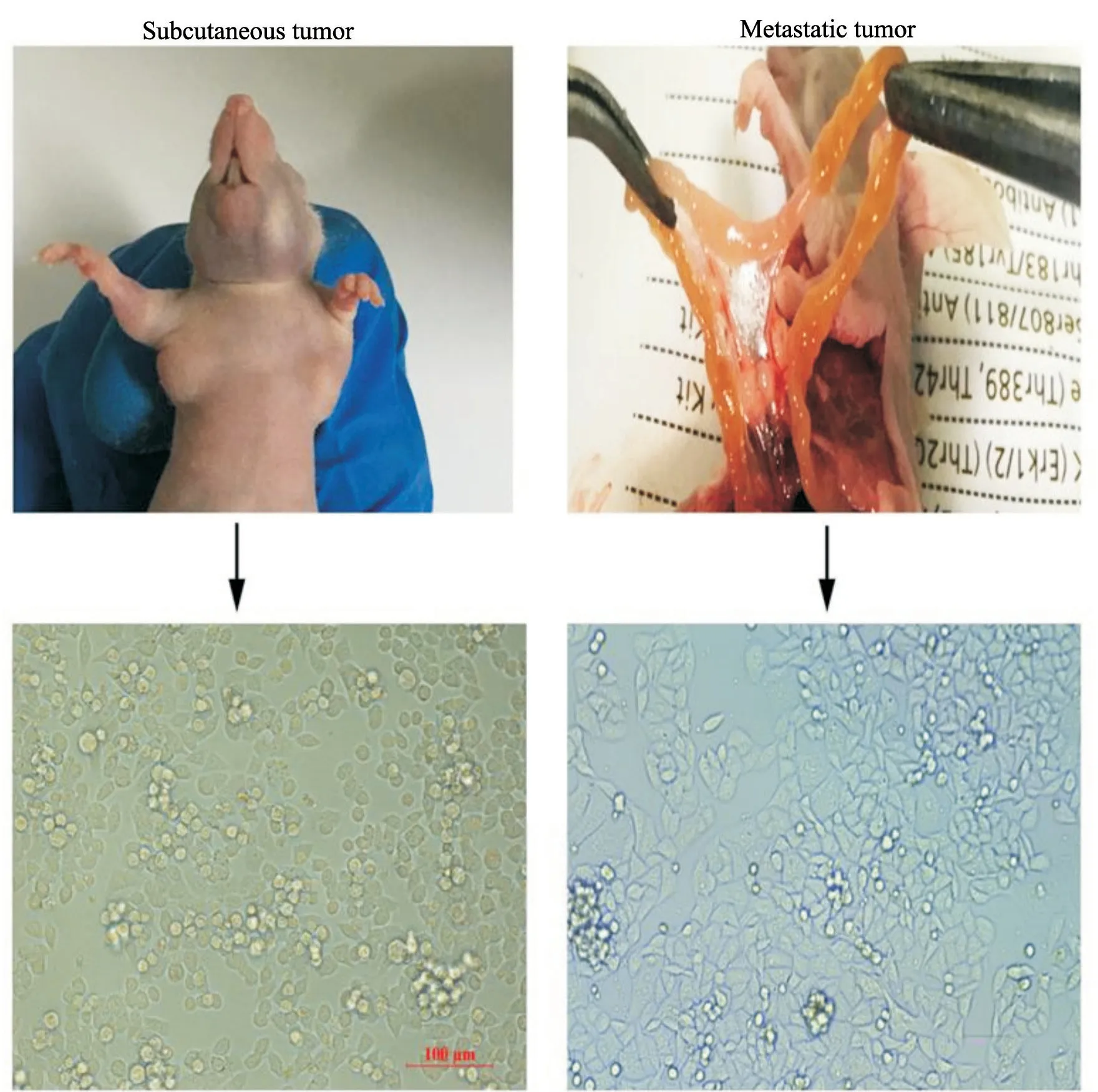
图2 HCT116细胞分别接种于BALB/c裸小鼠腋下和小肠壁成瘤情况检测Fig.2 Tumor formation of HCT116 cells inoculated into the axilla and small intestinal wall of BALB/c nude mice
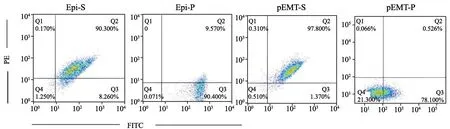
图3 以CD44和ESA为结肠癌干细胞标志物Fig.3 CD44 and ESA were used as markers of colon cancer stem cells

图4 MTT检测HCT116亲本株Fig.4 MTT assay was used to detect HCT116 parental strains
按照实验方法中的步骤构建 hsa-miRNA-139-5p过表达质粒,用NCBI blast序列,100%匹配。采用脂质体法瞬时转染亲本株HCT116,于48 h后采用RTFQ-PCR验证miR-139-5p过表达效率(P<0.01)。利用开放在线工具Ambion(http://www.invitrogen.com)、siDRM(sidrm.biolead.org)和Promega (http://www.promega.com)设计靶序列。两条正反义链分别包括了BamHI和HindⅢ黏性末端、shRNA两条互补链和9-mer的loop结构。两条链退火杂交后,2%琼脂糖凝胶电泳验证、转化、涂板、挑点、摇菌、提质粒后,送测序。用NCBI blast序列,100%匹配。瞬时转染亲本株HCT116,48 h后采用RTFQ-PCR和Western blot验证TCF4敲低效率(P<0.001)。TCF4过表达序列包含整个CDS区,采用RTFQ-PCR和Western blot验证TCF4过表达效率(P<0.05,图5)。
2.6 采用RTFQ-PCR检测不同分选后细胞中干性相关转录因子SOX2、OCT4和EMT相关蛋白E-cadherin、N-cadherin、vimentin的表达情况
采用RTFQ-PCR检测干性相关转录因子SOX2、OCT4和EMT相关蛋白E-cadherin、N-cadherin、vimentin在HCT116亲本细胞株、Epi-S、Epi-P、pEMT-S和pEMT-P中的表达情况,以分析它们之间自我更新能力表型以及EMT表型的差异。其中,干性相关转录因子OCT4和SOX2在4种CSC分型中表达均升高,与亲本株相比,差异有统计学意义(P<0.05)。OCT4在塑性EMT(pEMT-P)的亚系中较具有稳定EMT表型(pEMT-S)的亚系中表达升高(P<0.05)。上皮相关标志物E-cadherin,间充质相关标志物N-cadherin和vimentin在4种CSC分型中表达均升高,与亲本株相比,差异有统计学意义(P<0.05)。分选后的细胞,E-cadherin转录因子在mRNA水平被过度激活。其中,经历塑性EMT的亚系(ESA-)中E-cadherin表达水平要低于具有稳定上皮表型的亚系(ESA+)(P<0.01)。N-cadherin和vimentin在塑性EMT(pEMT-P)的亚系中较具有稳定EMT表型(pEMT-S)的亚系表达升高(P<0.05,图6)。
2.7 Transwell验证miR-139-5p、TCF4对不同亚型细胞侵袭能力的影响
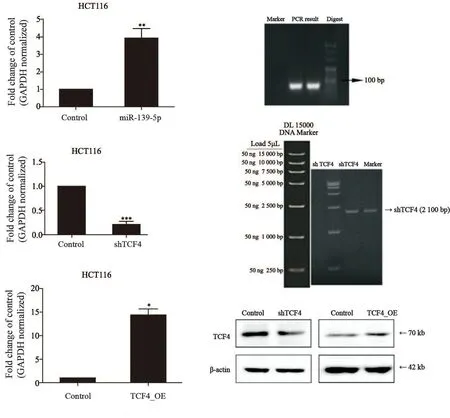
图5 构建miR-139-5p过表达、TCF4敲低/过表达质粒Fig.5 The miR-139-5p overexpression and TCF4 knockdown/overexpression plasmids were constructed and sequenced respectively

图6 RTFQ-PCR检测在HCT116亲本株(Parental)、Epi-S、Epi-P、pEMT-S和pEMT-P中干性相关转录因子SOX2、OCT4和EMT相关蛋白E-cadherin、N-cadherin和vimentin的表达情况Fig.6 RTFQ-PCR was used to detect stem cell transcription factor SOX2, OCT4 and EMT-related proteins in HCT116 parental strains(Parental), Epi-S, Epi-P, pEMT-S and pEMT-P
以CD44和ESA为标志物分选并鉴定了结肠癌干细胞4种不同的分型后,我们为了评价这种结肠癌干细胞上皮-间质转化分层模型研究的可行性,以先前在结肠癌细胞以及CD133+/CD44+结肠癌干细胞中研究过的miR-139-5p以及其靶蛋白TCF4作为参照品,Transwell分别检测miR-139-5p过表达,TCF4敲低对Epi-P和pEMT-P CSCs分型以及TCF4过表达对Epi-S和pEMT-S CSCs分型侵袭能力的影响,发现过表达miR-139-5p或敲低TCF4均能抑制Epi-P和pEMT-P 结肠癌干细胞亚型的侵袭能力(P<0.01)。在表型稳定未经历EMT的上皮亚系Epi-S中,过表达TCF4,能够显著促进其侵袭能力(P<0.01,图7)。
2.8 Western blot检测miR-139-5p、TCF4对不同亚型细胞中E-cadherin、N-cadherin和vimentin蛋白水平的影响
在Epi-P和pEMT-P中过表达miR-139-5p或敲低TCF4;在Epi-S和pEMT-S中过表达TCF4。Western blot检测EMT标志分子E-cadherin、N-cadherin和vimentin,验证是否促进分型间的转化。实验结果表明,Epi-P和pEMT-P中过表达miR-139-5p和敲低TCF4,上皮标志物E-cadherin水平增加,间充质标志物N-cadherin和vimentin水平下降。Epi-S和pEMT-S中过表达TCF4,上皮标志物E-cadherin水平下降(pEMT-S变化不明显),间充质标志物N-cadherin和vimentin增加(图8)。
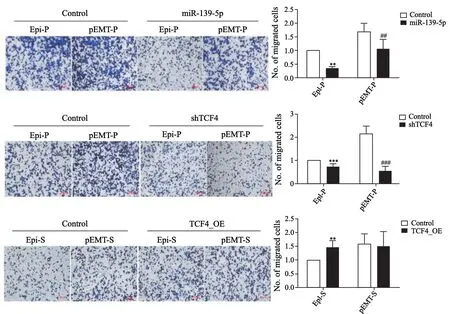
图7 Transwell实验检测miR-139-5p、TCF4对细胞侵袭能力的影响Fig.7 The effect on invasion ability of miR-139-5p and TCF4 detected by Transwell assay

图8 Western blot检测EMT标志物的蛋白水平Fig.8 Western blot was used to detect EMT marker proteins
3 讨 论
通常,CSC被定义为肿瘤细胞亚群,其具有肿瘤起始能力和重建原始肿瘤典型细胞异质性的能力[8]。我们认为结肠癌干细胞包括两种具有不同表型的CSC,一种类似于正常上皮干细胞,另一种类似于Mani等[9]描述的EMT CSC。这与文献报道的“迁移性癌干细胞”概念非常吻合[10],其中恶性干细胞获得两种表型,一种与生长有关,另一种与迁移有关,其特征是“上皮细胞向间充质转化相关基因的瞬时表达,可通过MET逆转,导致上皮细胞再分化”,从而实现在转移部位形成继发性肿瘤。
CSC通常和成体干细胞(somatic stem cells SSC)共享表面标志物。然而,轻微的表面抗原差异以及信号转导通路和代谢改变可以区分CSC和SSC[11]。在这方面,许多CSC标志物包括CD44、CD133、受体酪氨酸激酶(receptor tyrosine kinase,RTK)、ALDH、EpCAM/ESA和ATP结合盒亚家族G成员2(ATP-binding cassette, subfamily G, member 2,ABCG2)是用于限定实体瘤中CSC群体的有用靶分子[12]。其中CD44是一类重要的黏附分子,与结肠癌肝转移密切相关,其在结肠癌干细胞中普遍高表达,其与低表达的上皮标志物ESA一起提示了CD44high/ESAlow这一亚群与EMT CSC亚群相对应。
本文中我们提出了一种结肠癌干细胞EMT分层模型,它定义了肿瘤内的分层细胞关系,可充分体现肿瘤细胞的表型可塑性。在该模型中,CD44+ESA+是非迁移性的结肠癌干细胞亚型(non-EMT CSC),CD44+ESA-是迁移性的EMT CSC。而CD44+ESA+及CD44+ESA-的来源又分为皮下移植瘤以及小肠原位接种后的转移瘤。这四种亚型分别为:① 表型稳定的上皮亚系,其具有有限的经历EMT的能力(Epi-S);② 具有增强的经历EMT的能力的塑性上皮亚系(Epi-P);③ 稳定的后EMT亚系不能经历MET(pEMT-S);④ 可以经历MET的塑性后EMT亚系(pEMT-P)[7]。4种亚型均较亲本细胞株,表现出增强的多药耐药性和克隆形成能力,提示它们均获得结肠癌干细胞的干性特征,但由于EMT表型的差别,导致其CSC自我更新能力不尽相同。这种模型可以评价不同活性药物对结肠癌干细胞中不同细胞亚型之间表型转化的影响。为了验证这一模型的实用性,我们选取了课题组之前研究过的抑癌基因miR-139-5p以及其靶蛋白TCF4。miR-139-5p抑制结肠癌细胞转移。TCF4(又名E2-2)是基本螺旋-环-螺旋转录因子,在决定各种组织细胞命运和分化中起关键作用[13]。我们前期研究发现其在CD133+/CD44+结肠癌干细胞中受到miR-139-5p靶向抑制。TCF4是Snail1、Snail2和E47的直接或间接下游靶点,诱导E-钙黏蛋白(E-cadherin)的抑制和间质标志物的表达。我们发现在能够经历EMT的Epi-P和pEMT-P CSCs分型中过表达miR-139-5p和敲低TCF4均能抑制结肠癌干细胞亚型的侵袭能力,同时上皮标志物E-cadherin表达增加,间充质标志物N-cadherin和vimentin表达下降。而在稳定表达上皮特质的Epi-S和pEMT-S中过表达TCF4显著促进细胞侵袭能力,间充质标志物N-cadherin和vimentin表达增加。
综上,本研究首次建立了以CD44和ESA为标志物的结肠癌干细胞EMT分层模型,可用于评价不同生物活性物质对结肠癌干细胞EMT的影响。

