白藜芦醇对阿霉素诱导心肌细胞凋亡的保护作用及机制研究
阿霉素是一种广泛应用于治疗实体肿瘤和血液系统肿瘤的细胞毒药物,该药物的心脏毒性限制了其应用[1]。研究表明,阿霉素的心脏毒性与化疗周期中阿霉素的总累积剂量相关,长期高剂量使用可导致严重且不可逆的退行性心肌病和充血性心力衰竭[2-4]。阿霉素引起心脏不良反应的机制尚未完全明确,可能涉及多种途径,包括氧自由基生成、过氧亚硝酸盐形成、钙超载、线粒体功能障碍、细胞凋亡及自噬等[5-6]。
E2F转录因子1(E2F1)通过影响细胞周期,在癌症进展中发挥重要作用[7]。研究表明,E2F1调节腺苷酸活化蛋白激酶α2(AMPKα2),参与阿霉素诱导的心脏毒性[8-9]。白藜芦醇(RSV)是一种天然的植物抗毒素,可以通过减少氧化应激、抑制细胞凋亡和调节自噬过程,部分逆转阿霉素的心脏毒性[11-13]。本研究拟通过建立细胞模型,探讨RSV对阿霉素诱导的心肌细胞凋亡的调控作用,以及E2F1/AMPKα2信号通路在其中发挥的作用。
1 材料与方法
1.1 细胞培养
大鼠心肌细胞系(H9c2)购自美国组织培养中心(ATCC),采用含10%胎牛血清(FBS)、100 U/mL青霉素、100 μg/mL链霉素的DMEM培养基培养细胞。用无血清培养基冲洗细胞后,将细胞予以不同时间梯度的1 μmol/L阿霉素处理。细胞处理后,取96孔板,每孔加入细胞悬液100 μL,细胞浓度为2×105个/mL,加入5 g/L MTT溶液20 μL,于37 ℃反应4 h。加入二甲基亚砜(DMSO)150 μL,酶标仪检测490 nm波长处的吸光度值。
1.2 细胞转染
待H9c2细胞生长至70%融合度时,根据Lipofectamine Plus(Invitrogen公司)说明书,采用终浓度为40 nmol/L的E2F1的小干扰RNA siE2F1转染H9c2细胞(siE2F1转染组),靶序列为5′-CCUGGAGCAUGUUAAAGAAUU-3′。siRNA阴性对照组转染终浓度为40 nmol/L的siRNA阴性对照,空白对照组加入等量生理盐水培养,转染6 h后更换为完全培养基继续培养48 h,收集细胞检测E2F1的表达水平。实时聚合酶链反应(qRT-PCR)检测E2F1转染效率,Trizol法提取细胞总RNA,以反转录试剂盒(TOYOBO公司)将总RNA反转录合成cDNA,以cDNA为模板进行PCR扩增。扩增条件:95 ℃,10 min解链;随后95 ℃ 5 s,60 ℃ 30 s,40个循环。内参GAPDH引物序列:上游引物5′-ATGGGGAAGGTGAAGGTCG-3′,下游引物5′-GGGGTCATTGATGGCAACAATA-3′。E2F1引物序列:上游引物5′-GCAACGCCGCAGGCG CCC-3′,下游引物5′-GAGTTGGATGCCCTCCA GG-3′。采用 2-ΔΔCt法计算E2F1 mRNA的相对表达量。
1.3 实验分组
将H9c2细胞分为6组:对照组、阿霉素组、 siE2F1组、阿霉素+siE2F1组、RSV组、阿霉素+RSV组。阿霉素组加入终浓度为1 μmol/L的阿霉素,siE2F1组在siE2F1转染细胞中加入等量的生理盐水,阿霉素+siE2F1组为siE2F1转染细胞,加入终浓度为1 μmol/L的阿霉素,RSV组加入终浓度为20 μmol/L的RSV,阿霉素+RSV组同时加入终浓度为1 μmol/L的阿霉素和20 μmol/L的RSV,对照组加入等量的生理盐水,干预24 h后收获细胞。
1.4 细胞凋亡检测
按照凋亡检测试剂盒(BD Pharmingen公司)使用说明书,采用Annexin V-FITC和PI各5 μL对细胞进行双染色。室温避光孵育15 min后,流式细胞仪检测细胞凋亡水平。
1.5 Western blot法检测蛋白表达水平
采用RIPA细胞裂解液提取细胞蛋白,BCA 法测定蛋白浓度。十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)对蛋白(20 μg)进行分离,转移到硝酸纤维素膜上。5%脱脂牛奶封闭1 h,E2F1兔多克隆抗体(1∶1 000,Sigma-Aldrich公司)、AMPKα2兔单克隆抗体(1∶1 000,Sigma-Aldrich公司)、胱天蛋白酶-3(caspase-3)兔多克隆抗体(1∶1 000,Cell Signaling Technology公司)、GAPDH兔多克隆抗体(1∶1 000,Sigma-Aldrich公司)4 ℃孵育过夜,山羊抗兔二抗(1∶5 000)常温孵育1 h。滴加ECL化学发光剂,化学发光成像系统(Bio-rad公司)显影,并用ImageJ软件对条带灰度值进行分析。
1.6 统计学分析
采用SPSS 22.0软件对数据进行统计学分析。连续变量以均数±标准差表示,两个独立样本间比较用t检验,多个独立样本间比较采用单因素方差分析,组间比较采用Dunnett-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 阿霉素降低心肌细胞活力
阿霉素损伤可显著降低心肌细胞活力,并呈时间依赖性(阿霉素不同处理时间与0 h相比,P均<0.05),当处理时间为24 h时,细胞活力下降约50%,损伤程度适宜,以该浓度进行后续实验。
2.2 siE2F1转染抑制E2F1表达
转染48 h后,siE2F1转染组E2F1 mRNA和蛋白的表达水平与siRNA 阴性对照组和空白对照组相比均显著降低(P均<0.001),见表1。

表1 转染后各组E2F1 mRNA和蛋白表达水平比较
2.3 阿霉素通过上调E2F1诱导心肌细胞凋亡
采用Annexin V/PI双染流式细胞术检测细胞凋亡,与对照组相比,阿霉素组H9c2心肌细胞凋亡率显著升高,siE2F1组凋亡率显著降低,阿霉素+siE2F1组凋亡率显著升高(P均<0.05)。与阿霉素组相比,阿霉素+siE2F1组凋亡率显著降低(P<0.001)。见图1A、表2。
采用Western blot法检测细胞内蛋白水平,与对照组相比,阿霉素组E2F1、AMPKα2和caspase-3剪切体(cleaved caspase-3)的蛋白表达水平显著升高(P均<0.001);siE2F1组E2F1、AMPKα2的蛋白表达水平显著降低(P均<0.001),cleaved caspase-3的蛋白表达水平无统计学差异;阿霉素+siE2F1组E2F1、AMPKα2的蛋白表达水平显著降低,cleaved caspase-3的蛋白表达水平显著升高(P均<0.001)。但与阿霉素组相比,阿霉素+siE2F1组E2F1、AMPKα2和cleaved caspase-3的蛋白表达水平均显著降低(P均<0.001)。见图1B、表2。
2.3 RSV通过抑制E2F1部分逆转阿霉素介导的心肌细胞凋亡
Annexin V/PI双染流式细胞术检测显示,RSV组细胞凋亡率与对照组、阿霉素组相比显著降低(P均<0.05);阿霉素+RSV组细胞凋亡率虽高于对照组,但显著低于阿霉素组(P均<0.001)。见图2A、表3。
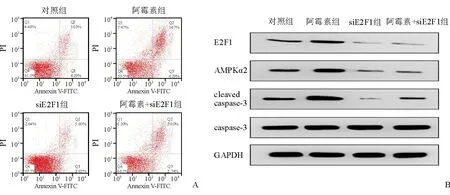
注:A为Annexin V/PI双染色法检测各组心肌细胞凋亡水平;B为Western blot法检测各组心肌细胞蛋白表达情况

表2 siE2F1转染后各组H9c2心肌细胞凋亡率及凋亡相关蛋白表达水平的比较
RSV组E2F1、AMPKα2和cleaved caspase-3的蛋白表达水平与对照组、阿霉素组相比显著降低(P均<0.05)。阿霉素+RSV组E2F1、AMPKα2和cleaved caspase-3的蛋白表达水平虽高于对照组,但与阿霉素组相比显著降低(P均<0.001)。见图2B、表3。
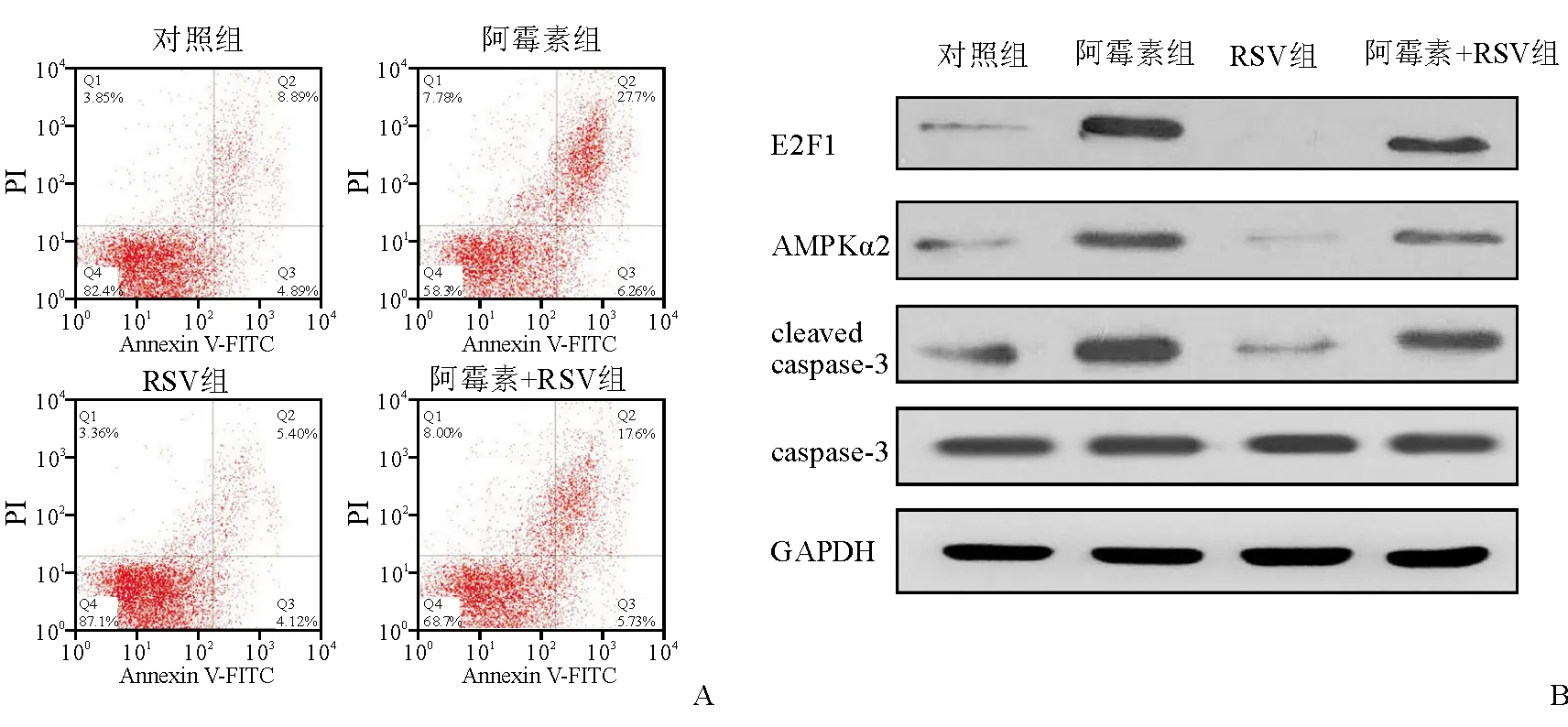
注:A为Annexin V/PI双染色法检测各组心肌细胞凋亡水平;B为Western blot法检测各组心肌细胞蛋白表达情况

表3 RSV干预后各组H9c2心肌细胞凋亡率及凋亡相关蛋白表达水平的比较
3 讨论
阿霉素属蒽环类抗肿瘤药物,广泛应用于实体肿瘤和血液系统肿瘤的治疗[14]。阿霉素在发挥抗肿瘤作用的同时,可对正常细胞产生毒性,由于其容易在心肌细胞中积累,故有明显的心脏毒性[2-4,15]。本研究结果提示阿霉素能够降低心肌细胞的活力,促使心肌细胞发生凋亡。
我们既往的研究证明阿霉素诱导的心脏毒性与p38丝裂原活化蛋白激酶(p38MAPK)/p53和AMPK/哺乳动物雷帕霉素靶蛋白(mTOR)/自噬相关蛋白1(Ulk1)的信号通路有关[11-12,16]。但有关阿霉素对AMPK活化作用的研究得出了不同结论[9,17-19]。AMPK可能有具有双重作用的亚型,即具有维持细胞存活特性的亚型(AMPKα1)和诱导细胞凋亡的亚型(AMPKα2)[9]。另外,E2F1可通过转录激活G1/S转换和调节有丝分裂的相关基因,使细胞进行不可逆的DNA复制,在癌症进展中发挥重要作用[7]。随后的研究表明,与增殖和恶性转化相关的其他生物过程也受E2F1调节,包括细胞生长、自噬、侵袭和转移[20-21]。E2F1还可通过激活AMPKα2,参与阿霉素诱导的心脏毒性过程[9]。本研究结果显示,在H9c2心肌细胞中,阿霉素可诱导E2F1和AMPKα2的激活,抑制E2F1可减轻阿霉素诱导的AMPKα2的激活和细胞凋亡过程。
RSV是一种在葡萄中大量存在的多酚化合物,具有抗氧化、抗炎和抗癌特性[10]。RSV的心脏保护作用与减少氧化应激、抑制细胞凋亡和调节自噬等相关[11-12]。研究表明,RSV可减少过氧化氢诱导的心肌细胞氧化应激,从而在糖尿病心肌病大鼠模型中发挥心脏保护作用[13,22]。RSV还可通过抑制Bax和caspase-3的活化,抑制缺氧诱导的心肌细胞凋亡[23-25]。既往的研究表明,RSV与阿霉素联合使用可以预防阿霉素的心脏毒性,并在体内和体外协同抑制肿瘤细胞的增殖和迁移[11-12,16]。RSV能够通过下调E2F1和抑制磷酸化的丝氨酸/苏氨酸激酶(p-AKT),增加鼻咽癌(NPC)细胞对放射的敏感性,促进NPC凋亡[26]。本研究发现,RSV可部分逆转阿霉素引起的H9c2心肌细胞凋亡,抑制E2F1和AMPKα2的激活,提示RSV对阿霉素所致心肌细胞凋亡的保护作用可能是通过调控E2F1/AMPKα2信号通路实现的。

