应用基因芯片筛选HBV对肝癌细胞耐药相关基因影响的初步研究
余小花,占 静,马 瑞,魏 柏
华中科技大学同济医学院附属梨园医院肿瘤内科,湖北 武汉 430077
肝癌是常见的消化道肿瘤,目前化疗是晚期肝癌的主要治疗手段之一,然而多药耐药常常限制了肝癌的治疗疗效[1]。近年来,逐步有学者解释HBV在肝癌多药耐药发生、发展中可能起到一定作用,但其作用机制尚未明确[2]。因此,本研究以整合了HBV DNA的HepG2.2.15细胞来模拟被HBV感染状态[3],利用基因芯片技术研究肝癌细胞HepG2.2.15和HepG2的基因表达差异,通过寻找差异基因表达为后续研究HBV相关的肝癌多药耐药发展的分子机制提供新的思路。
1 材料与方法
1.1材料人肝癌细胞株HepG2细胞购自中国典型培养物保藏中心,HepG2.2.15细胞由华中科技大学同济医学院附属协和医院卢银平教授馈赠。基因芯片为Affymetrix的GeneChip primeview human;基因芯片杂交,洗涤和染色试剂盒购自GeneChip Hybridization Wash and Stain Kit;RNA质检为Agilent RNA 6000 Nano试剂盒;胎牛血清,DMEM培养液,RNA提取试剂Trizol和PCR试剂Power SYBR®Green PCR Master Mix购自Life Technologies公司;PCR引物购自Invitrogen公司。
1.2方法
1.2.1 细胞系和细胞培养:肝癌细胞株HepG2和HepG2.2.15采用质量浓度为100 g/L胎牛血清的DMEM,置于37 ℃,体积分数为5%的CO2培养箱内培养。生长至60%~80%时融合用于后续实验。
1.2.2 RNA抽提和质检:采用Trizol法进行样品的总RNA抽提,抽提所得总RNA送至上海吉凯生物公司使用NanoDrop 2000和Agilent Bioanalyzer 2100质检,合格样本进入基因芯片和Real time-PCR实验。
1.2.3 基因芯片检测差异基因:质检合格的RNA样品由上海吉凯生物公司使用Affymetrix公司提供的“GeneChip primeview human 100 format”芯片进行基因芯片分析。将筛选差异基因的标准设置为:P<0.05且fold change (|FC|) ≥2,通过Gene Ontology功能进一步对差异表达基因的生物过程进行分析,根据表达强弱排序后,我们选取前十位加以展示。
1.2.4 Real time-PCR验证基因芯片结果:用Tirzol提取细胞RNA,反转录cDNA,以cDNA为模板行Real time-PCR检测MDR1、MRP2、LRP和GST的表达(见表1)。

表1 验证基因引物序列及扩增片段长度Tab 1 The sequence and length of gene primer
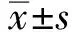
2 结果
2.1总RNA质控提取HepG2细胞及HepG2.2.15细胞的总RNA,其A260/A280为1.7~2.2,RIN≥7.0,28S/18S>0.7,证实已提取到高纯度的RNA(见表2)。
表2 RNA样本质检结果Tab 2 RNA quality
2.2基因芯片分析差异表达基因与生物学信息分析以肝癌细胞株HepG2和HepG2.2.15为研究对象,通过基因芯片筛选到差异表达的基因1 263个,其中上调基因数671个,下调基因数592个(见图1)。
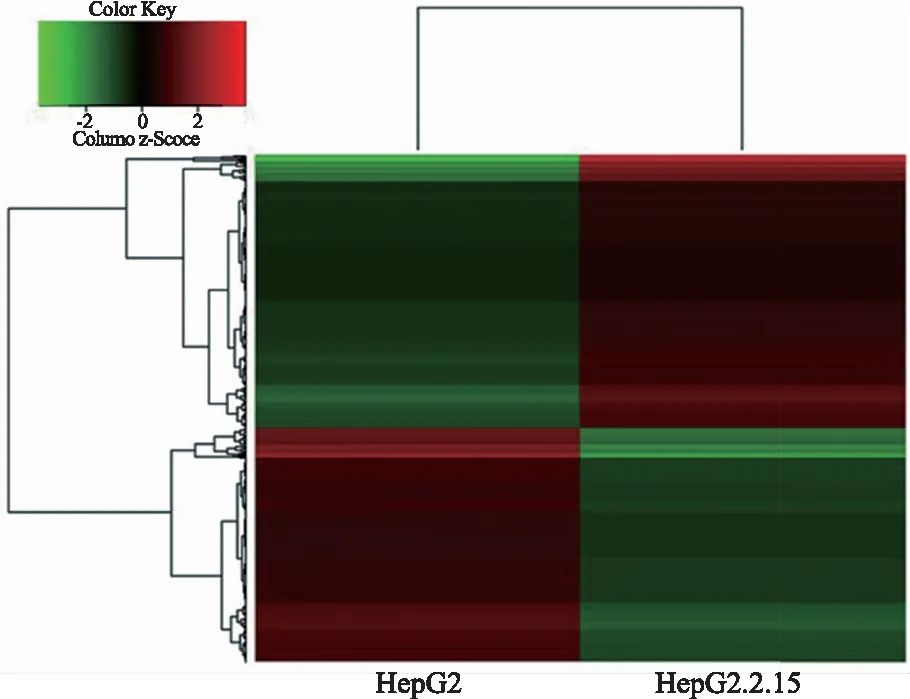
注:横轴代表聚类分析的样品,纵轴代表差异基因,颜色代表Log10转换后的表达量。
2.3药物相关差异表达基因生物过程分析以肝癌细胞HepG2和HepG2.2.15为研究对象,通过Gene Ontology功能进一步对差异表达基因的生物过程进行分析,发现和药物相关基因58个,其中上调基因数31个,下调基因数27个。涉及药物转运相关基因、药物代谢相关基因、细胞增殖相关基因、细胞周期调控基因等。根据表达强弱值排序后,我们选取前十位加以展示(见表3~4)。
2.4Realtime-PCR验证基因芯片中表达差异基因根据既往研究结果和本次差异表达基因,选择了4个基因进行验证。结果显示,与HepG2细胞比较,利用Real time-PCR检测MDR1、MRP2和LRP基因在HepG2.2.15细胞中表达量增高,但GST未见明显变化。将其在芯片中的FC值和Real time-PCR结果中的差异倍数进行比较,可见上述基因表达变化与基因芯片一致,说明基因芯片结果可靠(见图2、表5)。

表4 药物相关差异表达下调基因的功能富集分析Tab 4 Functional enrichment analysis of down-regulated drug resistance related genes
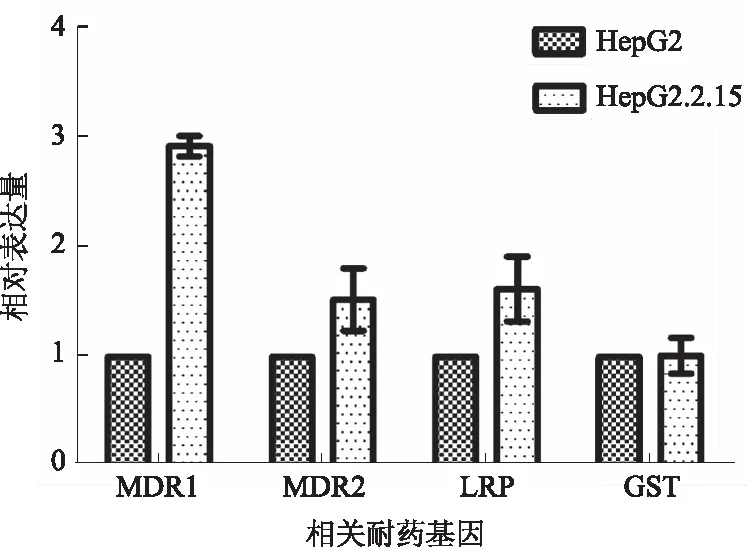
图2 部分多药耐药基因在RNA水平的表达 Fig 2 Drug resistance related genes expression at mRNA level
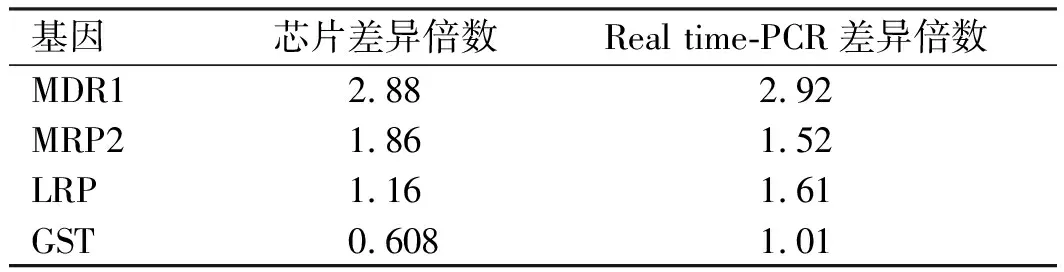
表5 差异表达基因的Real time-PCR验证结果 Tab 5 The results of Real time-PCR validation of gene expression in differentially expressed genes
3 讨论
既往研究表明,肝癌多药耐药可能涉及多阶段、多基因的参与,前期我们的团队和其他学者也证实了HBV参与多药耐药基因的调控,但其确切机制尚未阐明[4-6]。与传统的研究方法相比,基因芯片可以获得大量差异表达基因,从而实现从全局来预测这些基因的功能和基因间的相互关系[7]。因此,本研究利用基因芯片技术得到差异表达基因1 263个,进一步对差异表达基因进行功能分析发现药物相关基因58个,涉及药物转运相关基因、药物代谢相关基因、细胞增殖相关基因、细胞周期调控基因等。
本研究结果表明,在药物相关基因中上调最为明显的是CDH1、SEMA3C和FOS等。CDH1是E钙黏蛋白的编码基因,CDH1过甲基化常导致其功能丧失,最终引起肿瘤细胞的增殖、侵袭和耐药等,进一步研究表明,肝癌细胞转染CDH1增强多柔比星的摄取,减少MDR1的表达及细胞凋亡[8]。SEMA3C在肝癌等多种肿瘤组织中高表达,并起到促进肿瘤细胞生长和转移的作用,在体外细胞的研究中发现,SEMA3C通过ERK1/2信号通路促进上皮间质转化从而影响细胞的增殖、转移[9]。原癌基因c-FOS是即刻早期基因家族中的一员,通过和c-JUN、ATF/CREB家族成员形成异源二聚体,识别细胞内特定的DNA序列,进而促进细胞生长与分化,在肿瘤发生、发展过程中起非常重要的作用。近年来,原癌基因c-FOS在肿瘤耐药中的作用渐受重视,对其进行研究有助于认识和了解肿瘤化疗过程中所出现的多药耐药相关的分子机制[10]。
本研究结果提示,在药物相关表达下调的27个基因中有代表性的是ABCG2、ARG1和CYP1A1等。ABCG2在多种实体瘤中均有表达,且越来越多的研究揭示了ABCG2和多药耐药的相关性[11-12],但涉及的调节机制还有待进一步研究。ARG1是近几年发现并应用于肝癌细胞的免疫标志物[13],有研究表明,转染ARG1的293T细胞诱导了MRP和GST等耐药相关基因表达,推测其在克服肿瘤耐药提供新的治疗靶点可能具有重要的意义。CYP1A1主要代谢多环芳烃,间接参与了肿瘤的发生[14],然而对于不同肿瘤化疗疗效的影响值得进一步探索[15]。
既往研究表明,肝癌多药耐药与ABCB1、MRP2、LRP和GST-pi异常表达相关[16-20],以这些基因为靶点改变药物泵或代谢酶活性从而逆转肝癌细胞多药耐药也逐渐受到广泛关注。本实验采用Real time-PCR检测了上述基因在HepG2.2.15及HepG2中的异常表达,再次验证HBV参与了肝癌多药耐药的调节,同时也表明基因芯片结果可信。
本研究应用基因芯片筛选了HBV对肝癌细胞药物代谢相关基因表达的影响,在基因功能分析中获取了HBV可能作用的与多药耐药相关的靶基因,此外实验采用Real time-PCR检测了HBV对目前常见多药耐药基因表达的影响,验证了芯片结果的可靠性,提示这些基因可能成为临床逆转肝癌多药耐药的新靶点,为深入探讨HBV在肝癌中的作用提供了新的线索。然而本研究中采用的芯片结果主要反映了基因在转录水平的变化,仍具有一定局限性,尚需进一步研究。

