下调G6PD表达对肝癌细胞增殖、凋亡的影响及其机制
任丽丽,张 然,古同男,吴常伟,陈 坚
1.首都医科大学燕京医学院生化分子生物学教学实验室,北京 101300; 2.北京市顺义区医院疼痛科;3.武警上海市总队医院肿瘤科
肝癌是实体瘤中预后极差的恶性肿瘤[1-2]。肝细胞具有生长增殖能力较强的特性,是肝癌患者预后不良的主要原因之一[3-5]。因此,寻找能显著抑制肝癌细胞增殖、促进其凋亡的分子靶向标志物,成为临床研究的重点。既往研究认为,肿瘤的发展过程涉及多个基因突变,在细胞的凋亡过程中起关键作用[6-7]。葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6PD)是磷酸戊糖途径初始阶段的第一个酶,同时也是磷酸戊糖途径的限速酶。G6PD是由Xq28区域的管家基因编码,广泛表达于机体各种细胞中。在糖酵解过程中,G6PD可催化葡萄糖进入磷酸戊糖途径,最终产生细胞活动所需要的能量。近年来的研究发现,G6PD在肿瘤中高表达,可显著促进肿瘤的发生、发展[8-9]。但G6PD在肝癌中的作用并不清楚,因此,本文通过下调G6PD在肝癌HepG2细胞中的表达量,观察HepG2细胞增殖、凋亡的变化及初步探究其可能的作用机制。
1 材料与方法
1.1实验主要试剂和仪器肝癌HepG2细胞系、DMEM培养基、胎牛血清购自美国ThermoFisher公司,siRNA由上海吉玛有限公司合成,MTT细胞增殖检测试剂盒、BCA试剂盒、碘化丙啶(propidium iodide,PI)、凋亡试剂盒购自碧云天生物技术研究所,二甲基亚砜(dimethyl sulphoxide,DMSO)购自美国Promega公司,LipofectamineTM2000购自美国Invitrogen公司,B细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)抗体、G6PD抗体、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体购自美国Abacm公司,含半胱氨酸的天冬氨酸蛋白水解酶3(Cysteinyl aspartate specific proteinase 3,Caspase-3)抗体、含半胱氨酸的天冬氨酸蛋白水解酶9(Cysteinyl aspartate specific proteinase 9,Caspase-9)抗体购自美国Santa Cruz公司,甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)。CO2生化培养箱、酶标仪购自美国Thermo公司,凝胶成像系统购自美国Pharmacia Biotech公司。
1.2细胞的培养和转染HepG2细胞培养于质量浓度为100 g/L的胎牛血清、质量浓度为10 g/L双抗的DMEM培养基,放入37 ℃、体积分数为5% CO2浓度培养箱中,其浓度为80%~90%,以1∶3进行传代。选取生长状态良好的对数期细胞,分为对照组、siRNA阴性组、siRNA G6PD组。对照组为常规培养的HepG2细胞,siRNA阴性组、siRNA G6PD组细胞采用LipofectamineTM2000分别将携带阴性对照和G6PD序列的siRNA转染入细胞,置于37 ℃生化培养箱中继续培养。
1.3转染后细胞中G6PD蛋白的表达收集转染后48 h各组细胞,提取细胞中总蛋白,根据BCA试剂盒所示进行蛋白定量。吸取25 μg蛋白,加入5倍体积的溴酚蓝,100 ℃加入5 min,冷却后进行聚丙烯酰胺凝胶电泳,电压调整至200 V,电泳至溴酚蓝迁移至分离胶底部,停止电泳;然后将凝胶所携带的目的蛋白转移至剪裁好的PVDF膜中,100 V转膜1.5 h,置于5%封闭液中2 h;加一抗,转鼓中孵育2 h,清洗,加二抗,转鼓中孵育2 h,清洗,显色,曝光,凝胶成像系统中拍照,与内参GAPDH的比值为目的蛋白的相对表达量。
1.4细胞增殖的检测收集各组细胞,以每孔2×104个接种于96孔板,每孔加入20 μl MTT,37 ℃孵育4 h,每孔加入150 μl DMSO,酶标仪中检测细胞在570 nm的吸光值。
1.5细胞凋亡的检测根据凋亡试剂盒说明书,细胞浓度调整为1×106ml-1,每孔设置4个复孔,加入10 μl Annexin V-FITC、5 μl PI,避光,染色15 min,流式细胞仪计算细胞的凋亡率。
1.6细胞中凋亡相关蛋白的检测根据1.3所示,检测各组细胞中Bcl-2、Bax、Caspase-3、Caspase-9蛋白的表达量。
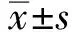
2 结果
2.1转染后细胞中G6PD蛋白水平免疫印迹法(Western blotting)检测转染后48 h各组细胞中G6PD蛋白的表达量,结果显示,siRNA G6PD组细胞中G6PD蛋白的表达量显著低于对照组,差异有统计学意义(P<0.05);siRNA阴性组与对照组G6PD蛋白的表达量差异无统计学意义(P>0.05)(见图1、表1)。

图1 转染后细胞中G6PD蛋白水平Fig 1 The level of G6PD protein in transfected cells

组别G6PD蛋白水平对照组0.759±0.072siRNA阴性组0.748±0.076siRNA G6PD组0.351±0.033∗F值40.359P值0.000
注:与对照组相比,*P<0.05。
2.2下调G6PD对细胞增殖的影响MTT检测转染后48 h各组细胞的增殖状况,结果显示,siRNA G6PD组细胞的增殖显著低于对照组,差异有统计学意义(P<0.05);siRNA阴性组与对照组间细胞的增殖差异无统计学意义(P>0.05)(见表2)。
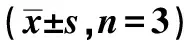
表2 下调G6PD对细胞增殖的影响Tab 2 The effect on cell proliferation by down-regulating
注:与对照组相比,*P<0.05。
2.3下调G6PD对细胞凋亡的影响流式细胞仪检
测转染后48 h各组细胞的凋亡状况,结果显示,siRNA G6PD组细胞的凋亡率显著高于对照组,差异有统计学意义(P<0.05);siRNA阴性组与对照组间细胞的凋亡差异无统计学意义(P>0.05)(见图2、表3)。
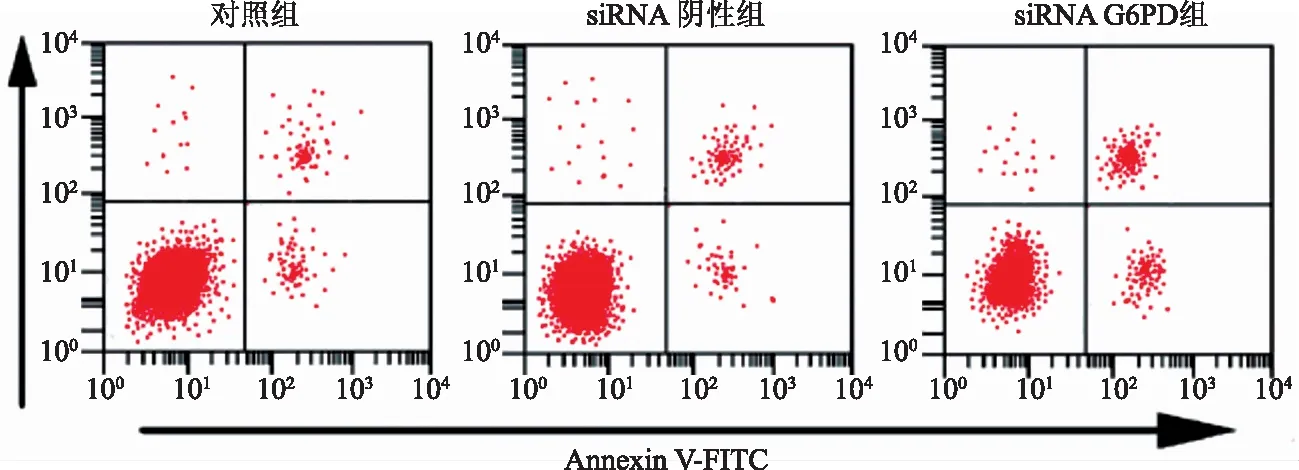
图2 下调G6PD对细胞凋亡的影响Fig 2 The effect on apoptosis by down-regulating G6PD
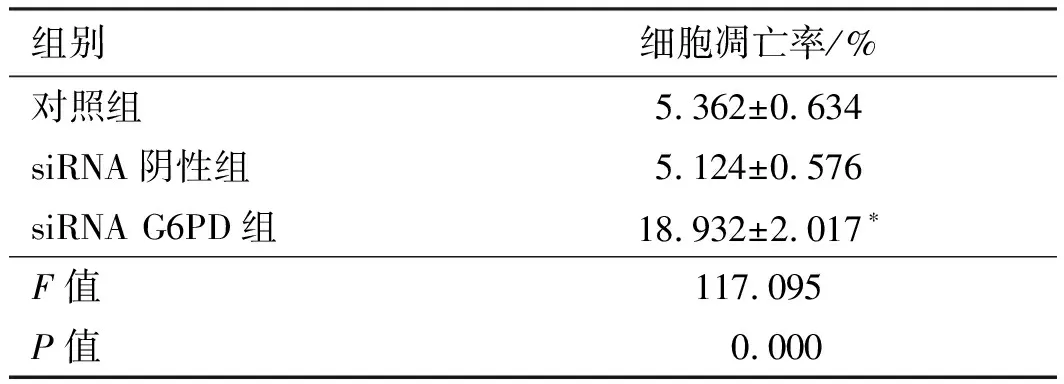
组别细胞凋亡率/%对照组5.362±0.634siRNA阴性组5.124±0.576siRNA G6PD组18.932±2.017∗F值117.095P值0.000
注:与对照组相比,*P<0.05。
2.4下调G6PD对细胞凋亡蛋白水平的影响Western blotting检测转染后各组细胞中凋亡蛋白的表达量,结果显示,siRNA G6PD组细胞中Bcl-2蛋白的表达量显
著低于对照组,差异有统计学意义(P<0.05),但Bax蛋白、Caspase-3蛋白、Caspase-9蛋白较对照组显著增加,差异有统计学意义(P<0.05);siRNA阴性组与对照组间凋亡蛋白的表达量差异无统计学意义(P>0.05)(见图3、表4)。

图3 下调G6PD对细胞凋亡蛋白水平的影响Fig 3 Down-regulation of G6PD on apoptotic protein level
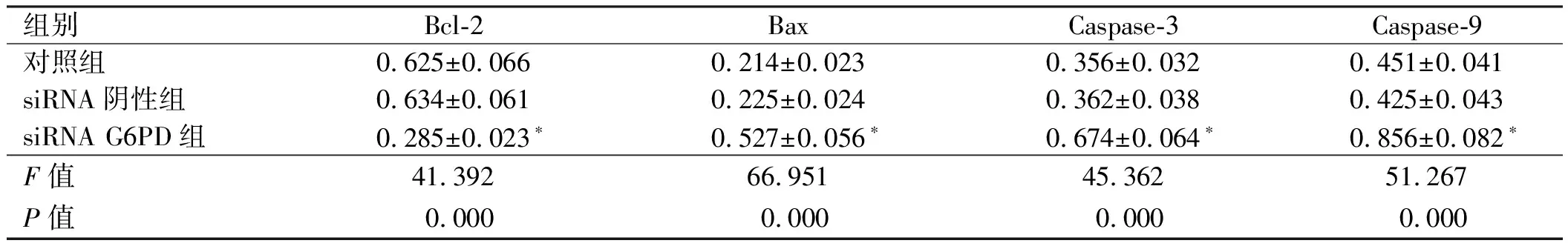
组别Bcl-2BaxCaspase-3Caspase-9对照组0.625±0.0660.214±0.0230.356±0.0320.451±0.041siRNA阴性组0.634±0.0610.225±0.0240.362±0.0380.425±0.043siRNA G6PD组0.285±0.023∗0.527±0.056∗0.674±0.064∗0.856±0.082∗F值41.39266.95145.36251.267P值0.0000.0000.0000.000
注:与对照组相比,*P<0.05。
3 讨论
肝癌是一种恶性程度较高、进展快、预后极差的恶性肿瘤。近年来,随着分子生物学研究的发展,越来越多的研究表明,肝癌的发生、发展过程中常伴随基因的突变、缺失或信号通路的改变[10-11]。G6PD是磷酸戊糖途径的关键酶之一,可促进葡萄糖进入磷酸戊糖途径,为细胞提供能量。肿瘤细胞发展过程中,细胞处于过度增殖的状态,需要机体提供更多的能量,因此在肿瘤细胞中,G6PD的活性增强。研究表明,G6PD在多种肿瘤组织中表达量显著增加,如肝癌、肺癌、胃癌、乳腺癌等[12-15],表明G6PD在肿瘤的发生、发展中发挥重要作用。在本研究中,通过脂质体LipofectamineTM2000将携带G6PD序列的siRNA转染入肝癌HepG2细胞,Western blotting检测结果发现,siRNA G6PD组细胞中G6PD蛋白的表达量显著下降,表明转染成功;MTT和流式细胞仪检测下调G6PD的表达后HepG2细胞的增殖和凋亡状态,结果显示,下调G6PD后HepG2细胞的增殖显著降低,凋亡率增加,表明G6PD表达量降低抑制HepG2细胞的增殖,促进其凋亡,G6PD在肝癌的发生、发展中起癌基因的作用。
细胞凋亡过程是一种由多种基因参与的细胞自主有序的死亡过程。研究表明,抑制细胞的凋亡、促进细胞增殖是肿瘤发生、发展的生物学基础,而细胞的抑制凋亡作用是促进肿瘤发生的主要因素[16-18]。Bcl-2基因是Bcl-2家族中与细胞凋亡密切相关的癌基因,在细胞凋亡过程中发挥抑制凋亡的作用。研究证实,Bcl-2基因及其蛋白在细胞线粒体凋亡信号传导通路中发挥抑制细胞凋亡的作用[19-20]。Bax也是Bcl-2家族的成员之一,在细胞线粒体凋亡信号传导通路中发挥促进细胞凋亡的作用,一般与Bcl-2相互作用于线粒体膜中,调节肿瘤细胞的凋亡。Caspase家族是细胞线粒体凋亡途径中的重要蛋白因子。Caspase-9位于线粒体凋亡通路的上游,是细胞中重要的起始因子,在其他因子的作用下被活化并可激活凋亡通路下游的Caspase-3蛋白,促进细胞发生一系列的级联反应,调控细胞的凋亡过程[21-22]。为进一步探究下调G6PD抑制细胞增殖、促进其凋亡的作用机制,本文检测了各组细胞中Bcl-2、Bax、Caspase-9、Caspase-3蛋白的水平,结果显示,siRNA G6PD组细胞中Bcl-2蛋白水平显著下调,Bax、Caspase-9、Caspase-3蛋白水平显著上调,表明下调G6PD可能是通过调控HepG2细胞线粒体凋亡通路蛋白的水平,从而抑制细胞的增殖和促进凋亡。
综上所述,下调G6PD通过调控线粒体凋亡通路,从而促进肝癌HepG2细胞的凋亡、抑制其增殖,阻碍肝癌的进一步发展,为肝癌的临床治疗和诊断提供理论依据和潜在靶点。

