Netrin-1对高糖诱导的肾小管上皮细胞损伤的影响*
赵 静, 翟 铁, 梁宏霞
(1唐山职业技术学院临床医学系, 河北 唐山 063000; 2承德市中心医院内分泌科, 河北 承德 067000)
糖尿病肾病是常见的糖尿病并发症之一,高血糖是诱发糖尿病肾病发生的关键。糖尿病肾病的发生与肾小管上皮细胞损伤有关,肾小管上皮细胞氧化损伤、炎性损伤和细胞凋亡等是肾小管上皮细胞损伤的重要组成部分[1]。Netrin-1是一种神经导向因子,具有抑制组织炎症和促进血管生成等作用,对肾组织损伤具有保护作用[2-3]。Netrin-1具有保护肾组织的作用,阻断netrin-1的糖尿病小鼠发生更为严重的肾脏疾病,netrin-1还能够抑制糖尿病肾病患者炎症等的发生[4-5]。本实验用慢病毒感染的方法提高肾小管上皮细胞中netrin-1的表达水平,探讨netrin-1在高糖诱导的肾小管上皮细胞损伤中的作用,为明确糖尿病肾病的发病机制提供基础。
材 料 和 方 法
1 主要材料
人肾小管上皮HK-2细胞购自武汉普诺赛生命科技有限公司,培养于含有10%胎牛血清的DMEM培养基中。cDNA第一链合成试剂盒购自Biomiga;SYBR Green Realtime PCR试剂盒购自上海索宝生物科技有限公司;抗netrin-1抗体购自Bioworld;抗cleaved caspase-3抗体购自Santa Cruz;乳酸脱氢酶(lactate dehydrogenase,LDH)活性检测试剂盒和丙二醛(malondialdehyde,MDA)含量检测试剂盒购自Abnova;白细胞介素1β(interleukin-1β,IL-1β)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)含量检测试剂盒购自南京建成生物工程研究所;引物均由生工生物工程(上海)股份有限公司合成。
2 方法
2.1高糖对肾小管上皮细胞中netrin-1表达的影响 HK-2细胞分别用含5.5 mmol/L[对照(control)组]和30 mmol/L葡萄糖[高糖(high glucose,HG)组]的细胞培养液培养2 d,以real-time PCR和Western blot实验测定细胞中netrin-1的表达水平。
2.2慢病毒感染和分组 HK-2细胞分成4组:(1)control组:不做慢病毒感染的HK-2细胞培养于含有5.5 mmol/L葡萄糖的细胞培养液中;(2)HG组:不做慢病毒感染的HK-2细胞培养于含有30 mmol/L葡萄糖的细胞培养液中;(3)阴性对照慢病毒(negative control, NC)+HG组:阴性对照慢病毒感染的HK-2细胞培养于含有30 mmol/L葡萄糖的细胞培养液中;(4)netrin-1+HG组:过表达netrin-1慢病毒感染的HK-2细胞培养于含有30 mmol/L葡萄糖的细胞培养液中。慢病毒感染步骤简述如下:HK-2细胞接种到6孔板内,细胞汇合度为30%~50%时,将培养液上清吸弃,加入适量的病毒液(MOI=30),培养12 h后,将病毒液吸弃,细胞培养液继续培养72 h后,用嘌呤霉素筛选抗性细胞,用于后续实验。用real-time PCR和Western blot方法检测各组细胞中netrin-1表达水平,检测过表达效果。
2.3流式细胞术检测细胞凋亡 各组细胞按照上述方法培养48 h以后,在细胞中添加0.25%的胰蛋白酶消化,转移到离心管中,1 000×g离心10 min。把上清溶液吸弃以后,以PBS将各组细胞洗涤3次。在细胞中添加200 μL的binding buffer混合后,添加10 μL的Annexin V-FITC混合孵育15 min,再加入5 μL的PI染液,混匀后,在用流式细胞仪检测前添加300 μL的binding buffer。
2.4Real-time PCR 取HK-2细胞,用TRIzol法提取细胞中的总RNA,步骤参照TRIzol试剂说明书。提取的各组RNA用DEPC水溶解以后,分装,在-80 ℃的冰箱中保存。提取的RNA经紫外分光光度计测定A260/A280值在1.8~2.0之间。以cDNA第一链合成试剂盒逆转录合成cDNA,步骤同试剂盒说明书。cDNA置于-80 ℃的冰箱中保存。取cDNA,用SYBR Green Realtime PCR试剂盒进行PCR,β-actin作为内参照,用2-ΔΔCt计算netrin-1水平。Netrin-1 的上游引物序列为5’-GGATCCATGCCGCGGAGGGGC-GCGGA-3’,下游引物序列为5’-GATTCCTACGCCTTCCTACACTTC-3’;β-actin的上游引物序列为5’-ACTCTTCCAGCCTTCCTTCC-3’, 下游引物序列为5’-GAGGAGCAATGATCTTGATCTTC-3’。
2.5Western blot检测蛋白水平 取HK-2细胞,常规方法提取细胞中的总蛋白,用BCA法定量后,以每个泳道中加入30 μg蛋白计算,将蛋白同上样缓冲液混合后,置于100 ℃煮沸变性。SDS-PAGE条件为 70 V电压在浓缩胶中电泳,120 V电压在分离胶中电泳。把凝胶取出,以90 V电压将蛋白转移到PVDF膜上,转膜装置置于冰上进行。NC膜用5%牛血清白蛋白常规方法封闭以后,再与1∶400稀释的netrin-1抗体在4 ℃过夜或室温孵育2 h,与1∶5 000稀释的HRP标记的 II 抗置于37 ℃结合2 h后,按照ECL发光试剂盒发光,以 ImageJ 测定条带的灰度值,内参照为β-actin,分析各组netrin-1蛋白表达变化。
各组细胞按照上述方法培养2 d以后,用上述Western blot方法检测细胞中cleaved caspase-3水平,抗cleaved caspase-3蛋白抗体以1∶200稀释。
2.6细胞培养液中LDH活性和MDA含量的检测 各组细胞按照上述方法培养48 h以后,吸取培养液上清,用硫代巴比妥酸(thiobarbituric acid,TBA)法检测上清中MDA含量,TBA可以与MDA结合形成红色物质,检测其在532 nm的A值可计算MDA含量。用2,4-二硝基苯肼法检测培养液中LDH活性,LDH能够将乳酸催化生成丙酮酸,丙酮酸能够同2,4-二硝基苯肼结合生成棕红色物质,通过比色可以计算出LDH活性。
2.7ELISA法检测培养液中IL-1β和TNF-α含量 各组细胞按照上述方法培养48 h以后,吸取培养液上清,用ELISA法测定培养液中IL-1β和TNF-α含量,步骤同试剂盒说明书,在反应孔内加入100 μL的标准品或者待测样品,在空白对照孔内添加100 μL的稀释液,最后用空白对照孔调零以后,上酶标仪检测参比波长450 nm的A值,根据标准品计算IL-1β和TNF-α含量。
3 统计学分析
实验中所有数据均采用SPSS 21.0软件进行处理。结果以均值±标准差(mean±SD)表示。两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间多重比较经SNK-q检验。以P<0.05表示差异有统计学意义。
结 果
1 高糖抑制肾小管上皮细胞中netrin-1的表达
高糖处理后的肾小管上皮细胞中netrin-1的mRNA和蛋白水平较对照组均降低(P<0.05),见图1。
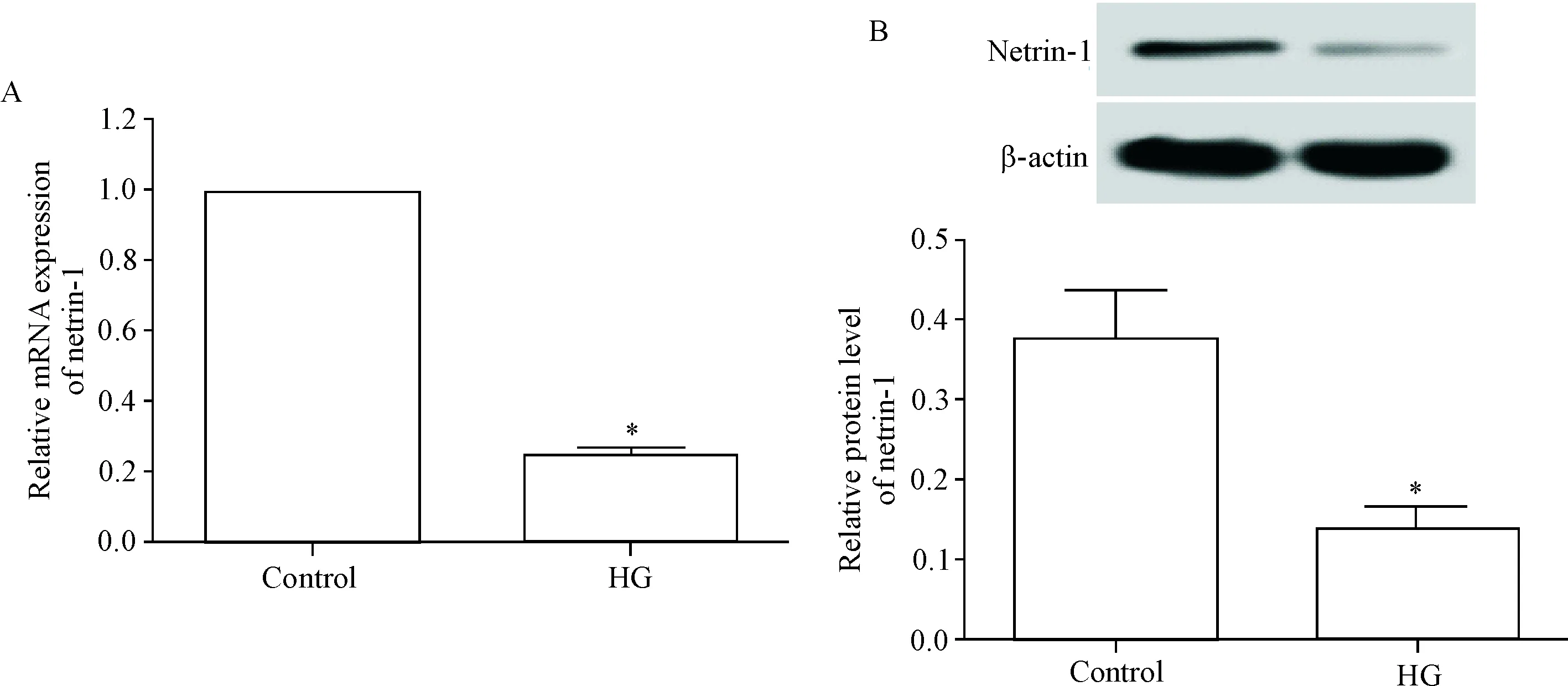
Figure 1.High glucose inhibited the expression of netrin-1 in renal tubular epithelial cells. A: the mRNA expression level of netrin-1 in the renal tubular epithelial cells after high-glucose treatment; B: Western blot was used to detect the level of netrin-1 protein in renal tubular epithelial cells after high-glucose treatment. Mean±SD.n=3.*P<0.05vscontrol group.
图1高糖抑制肾小管上皮细胞中netrin-1的表达
2 过表达netrin-1提高高糖环境下肾小管上皮细胞中netrin-1的表达水平
肾小管上皮细胞感染过表达netrin-1慢病毒载体后,经高糖处理,细胞中netrin-1的mRNA和蛋白表达水平升高(P<0.05),说明过表达netrin-1慢病毒载体能够提高高糖环境下肾小管上皮细胞中netrin-1的表达水平,见图2。
3 过表达netrin-1抑制高糖环境下肾小管上皮细胞凋亡
高糖处理后的肾小管上皮细胞凋亡率升高,同时细胞中活化的caspase-3水平也升高(P<0.05),说明高糖诱导肾小管上皮细胞凋亡;过表达netrin-1的肾小管上皮细胞凋亡率降低,细胞中活化的caspase-3水平也降低(P<0.05),提示netrin-1能够降低高糖环境下的肾小管上皮细胞凋亡水平,见图3。
4 过表达netrin-1降低高糖环境下肾小管上皮细胞培养液上清中LDH活性和MDA水平
高糖处理后的肾小管上皮细胞培养液中LDH活性和MDA水平升高(P<0.05),高糖诱导肾小管上皮细胞氧化损伤;高表达netrin-1的肾小管上皮细胞培养液中LDH活性和MDA水平降低(P<0.05),netrin-1减轻高糖环境下的肾小管上皮细胞氧化损伤,见表1。
5 高表达netrin-1降低高糖环境下肾小管上皮细胞培养液中IL-1β和TNF-α水平的变化
高糖处理后的肾小管上皮细胞培养液中IL-1β和TNF-α水平升高(P<0.05),说明高糖诱导肾小管上皮细胞炎性损伤;高表达netrin-1的肾小管上皮细胞培养液中IL-1β和TNF-α水平降低(P<0.05),netrin-1减轻高糖环境下的肾小管上皮细胞炎性损伤,见表1。

Figure 2.The effect of lentivirus infection on netrin-1 expression in the renal tubular epithelial cells in high-glucose environment. A: the effect of lentivirus infection on the mRNA level of netrin-1 in the renal tubular epithelial cells in high-glucose environment; B: Western blot was used to determine the protein level of netrin-1 in the renal tubular epithelial cells with lentivirus infection in high-glucose environment. Mean±SD.n=3.*P<0.05vsHG group.
图2慢病毒感染对高糖环境下肾小管上皮细胞中netrin-1表达的影响
讨 论
糖尿病肾病是一种慢性微血管并发症,以往的研究认定肾小球病变是其发生的主要机制,近年来发现肾小管病变与肾功能损伤关系更为密切,肾小管上皮细胞凋亡是肾小管病变发生的原因之一,其发生机制与氧化损伤和炎症等多种因素有关[6-7]。高糖诱导肾小管上皮细胞损伤,糖尿病患者长期的高血糖诱发肾小管上皮细胞凋亡是肾功能障碍的关键诱因[8-11]。用高糖处理肾小管上皮细胞是最为常用的糖尿病肾病肾小管上皮细胞损伤模型[12]。本实验的结果显示,高糖处理后的肾小管上皮细胞凋亡增多,说明成功构建了糖尿病肾病肾小管上皮细胞损伤模型。
Netrin家族属于可溶性的神经导向因子,能够促进神经元和轴突信号转导,netrin家族除了在神经系统中表达以外,在胰腺、肺脏和乳腺等组织中也具有广泛表达[13]。Netrin-1是netrin家族的成员,也是第一个被鉴定出来的netrin家族成员,在内囊、脊髓和延髓等组织中广泛表达,其具有诱导神经轴突生长等作用[14-17]。另外,在血管内皮细胞和肾小管上皮细胞等神经系统以外的组织中也发现netrin-1的表达,其具有调控细胞增殖、形态改变和迁移等作用[18]。目前的研究表明,netrin-1与糖尿病、肾组织损伤、肿瘤和动脉粥样硬化等的发生有关,netrin-1具有抑制缺血再灌注肾脏组织细胞凋亡的作用,另外在肾组织纤维化中netrin-1也发挥保护作用[13,19-22]。本实验显示,netrin-1在高糖诱导的肾小管上皮细胞中表达降低,并且上调其表达后可以减少高糖诱导的肾小管上皮细胞凋亡,减少细胞损伤,表明netrin-1具有肾小管上皮细胞保护作用。
糖尿病肾病肾小管上皮细胞损伤的发生与炎症反应和氧化应激等有关,正常组织中存在较低水平的氧自由基,这些氧自由基在维持细胞氧化平衡和信号转导中具有重要作用,当细胞内氧自由基过度积累时,就会引发存在于细胞膜上的脂质发生过氧化反应,导致细胞膜的完整结构被破坏,导致细胞内的LDH等进入细胞外,MDA是脂质发生过氧化的产物,检测细胞培养液中LDH和MDA含量可以间接反应细胞氧化损伤程度[23]。肾脏组织炎症是除了氧化应激以外与肾小管上皮细胞凋亡关系最为密切的诱导因素之一,IL-1β和TNF-α等炎症因子能够杀伤有害病原物的同时还能够引起正常细胞损伤,诱导细胞凋亡发生[24-25]。之前的研究报道称,netrin-1具有抗炎和抗氧化等作用。本实验表明,netrin-1可以减少高糖环境下肾小管上皮细胞分泌IL-1β和TNF-α,同时减少细胞培养液中LDH和MDA水平,提示netrin-1可能具有抑制高糖诱导的肾小管上皮细胞炎性损伤和氧化损伤的作用。
Netrin-1作为一种肾组织损伤保护因子,其具有减轻高糖诱导的肾小管上皮细胞损伤的作用,在糖尿病肾病发生中发挥保护作用。这对于研究糖尿病肾病发生机制具有重要意义。
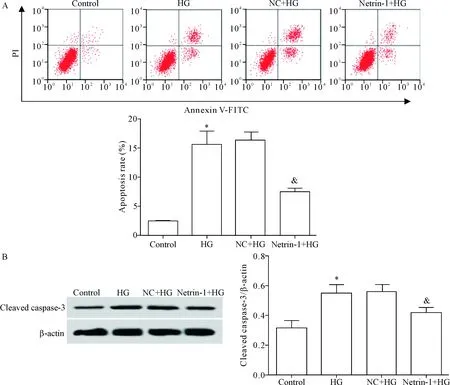
Figure 3.Apoptosis of renal tubular epithelial cells induced by high-glucose was suppressed after up-regulation of netrin-1 expression. A: flow cytometry was used to detect the effect of netrin-1 on the apoptosis of renal tubular epithelial cells in high-glucose environment; B: the effect of netrin-1 on the protein level of cleaved caspase-3 in the renal tubular epithelial cells in high glucose environment was detected by Western blot. Mean±SD.n=3.*P<0.05vscontrol group;&P<0.05vsHG group.
图3过表达netrin-1抑制高糖环境下肾小管上皮细胞凋亡
表1上调netrin-1后的肾小管上皮细胞经高糖处理后细胞培养液上清中LDH和MDA水平的变化
Table 1.The activity of LDH and the content of MDA, IL-1β and TNF-α in the culture supernatant of renal tubular epithelial cells treated with high glucose after up-regulation of netrin-1 expression (Mean±SD.n=3)

GroupLDH (×103 U/L)MDA (μmol/L)IL-1β (μg/L)TNF-α (μg/L)Control23.15±1.461.25±0.185.18±0.414.15±0.23HG39.52±2.17∗2.18±0.13∗16.74±1.46∗12.96±1.17∗NC+HG40.76±2.682.20±0.2516.82±1.2313.85±1.28Netrin-1+HG30.21±1.64&1.74±0.15&10.27±1.05&7.58±0.62&
*P<0.05vscontrol group;&P<0.05vsHG group.

