β-肾上腺素受体介导成纤维细胞旁分泌IL-6促进心脏miR-21表达*
于海奕, 宋 峣, 马晓伟, 冯 伟, 高 炜, 张幼怡
(北京大学第三医院心内科, 血管医学研究所, 国家卫生健康委心血管分子生物学与调节肽重点实验室, 分子心血管学教育部重点实验室, 心血管受体研究北京市重点实验室, 北京 100191)
心脏重构(cardiac remodeling)是多种因素共同作用的结果,神经体液调节失衡、炎性细胞激活、炎性介质释放和内皮功能紊乱等多种因素均参与了心脏重构的发生发展[1],其中β-肾上腺素受体(β-adrenergic receptors,β-ARs)过度激活是生理和病理状态下调节心脏结构和功能的主要神经体液机制[2]。β1-AR和β2-AR转基因小鼠可出现心脏肥厚和纤维化等病理改变[3]。异丙基肾上腺素(isoproterenol,ISO)是β-ARs非选择性激动剂,我们先前采用连续腹腔注射或微渗透泵方式给予小鼠ISO 1~2周可诱导明显的心脏重构[4]。β-ARs过度激活引起心脏重构的主要作用机制包括Gs/AC/cAMP/PKA信号通路、激活细胞外信号调节激酶-丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)级联反应、白介素-6(interleukin-6,IL-6)/ 信号传导及转录激活因子(signal transducers and activators of transcription, STAT3)信号转导以及非经典通路等[5]。
微小RNAs(microRNAs, miR)是一类内源性小分子非编码RNA。业已证明,多种miRNA参与β-ARs过度激活引起的心脏重构[6-7]。激动β-ARs后,采用microRNA芯片检测心脏中多种microRNA表达水平改变,其中miR-21表达显著上调[8]。Tatsuguchi等[9]证明miR-21是体内和体外心脏肥大的重要调节因子。 miR-21可通过靶向负调控软脂酰化磷蛋白(sprouty 1,Spry1)及磷酸酶和张力蛋白同系物(phosphatase and tensin homolog deleted on chromosome ten,PTEN)激活MAPK信号途径等,促进心肌细胞生长及成纤维细胞的增殖和胶原合成[10]。 在不同病因导致的心脏重构中,miR-21上游可受到不同转录因子调控,包括缺氧诱导因子-1α[11]和STAT3[12]等,引起miR-21转录增加,进而发挥下游的促心脏重构作用。
miR-21在β-ARs激动诱导的心脏重构中可发挥重要作用,但β-ARs激动如何调控心脏miR-21表达,目前尚未得知。本研究采用ISO分别作用于心肌细胞和心脏成纤维细胞,探讨β-ARs激动引起miR-21表达增加的主要调控机制,分析细胞间旁分泌作用对miR-21表达的影响,并验证IL-6/ STAT3通路是否介导β-ARs激动引起miR-21表达增加。以期进一步认识心脏细胞之间相互作用参与交感过度激活引起心脏重构的分子机制。
材 料 和 方 法
1 主要试剂
ISO和AG 490购自Sigma;抗p-STAT3抗体购自Santa Cruz Biotechnology;抗p-STAT3抗体购自Cell Signaling; Real-time PCR相关试剂购自ThermoFisher;细胞培养和转染试剂购自Invitorgen;Dual-Luciferase Reporter Assay System购自Promega;其它生化试剂均为进口分装或国产分析纯。
2 主要方法
2.1原代小鼠心肌细胞和心脏成纤维细胞的分离 BALB/c新生小鼠,出生1~2 d,由北京大学医学部实验动物中心提供,动物许可证号为SYXK(京)2016-0041,动物实验伦理批准号为LA2010-036。胸腹部用75%的乙醇消毒后,立即开胸取出心脏,置入4 ℃的Hank’s平衡盐溶液中清洗2次,去除心房和心底部大血管,然后将心室剪碎成小块,用Hank’s平衡盐溶液配制的含0.07%胰蛋白酶和0.04%Ⅱ型胶原酶于37 ℃恒温搅拌条件下消化。收集消化后细胞悬液,用含10% FBS的DMEM培养液混合后离心清洗2次,合并每次所得心肌细胞悬液,接种于培养板中,在37 ℃、5% CO2的培养箱内培养,90 min内贴壁生长的细胞为成纤维细胞P0代,传代1次后为P1代成纤维细胞,用于后续实验;未贴壁细胞悬液(含心肌细胞)加入BrdU(终浓度为0.1 mmol/L)以抑制非心肌细胞生长,所得心肌细胞另行接种,用含10% FBS的DMEM培养液培养36 h后,更换为不含血清的DMEM培养液,继续培养24 h,用于后续实验。
2.2条件培养液的制备 将P1代成纤维细胞撤血清培养24 h,加入ISO(10 μmol/L),分别于1、6、12、24和48 h收集培养液上清,制成共5种梯度条件培养液。在所制备的5种条件培养液中,选取起效早、效应显著的24 h时点培养液,检测条件培养液引起心肌细胞p-STAT3/STAT3和miR-21表达增加的机制。
2.3miRNA提取和定量分析 按照 TRIzol试剂(Invitorgen)操作手册提取新生小鼠心肌细胞中的总RNA。采用TaqMan MicroRNA Reverse Transcription Kit(Applied Biosystems,Cat#4366596)逆转录成cDNA,采用TaqMan MicroRNA Assays试剂盒(Applied Biosystems,Cat#4324018),用实时定量PCR(real-time PCR)检测成熟的miR-21(Applied Biosystems, 货号000397)和U6 RNA(Applied Biosystems,货号001973),PCR扩增条件为:98 ℃预变性10 min;98 ℃变性15 s、60 ℃退火60 s,共40个循环。采用Realplex 2 PCR仪进行real-time PCR反应,读取样本中miR-21和U6 RNA的Ct值,以U6作为内参照,miR-21相对表达量采用2-ΔΔCt法进行计算。
2.4细胞总蛋白的提取 细胞用冰浴的PBS洗涤2遍后加入全细胞裂解液(20 mmol/L Tris-HCl pH7.4,150 mmol/L NaCl, 2.5 mmol/L EDTA, 50 mmol/L NaF,0.1 mmol/L Na4P2O7,1 mmol/L Na3VO4, 1% Triton X-100, 10% 甘油, 0.1% SDS, 1% 脱氧胆酸, 1 mmol/L PMSF和1 mg/L 抑肽酶),在冰上用细胞刮刮下细胞,将裂解液收集至Epperdorf管中,超声处理后于4 ℃、12 000×g离心15 min,将上清移入新的EP管中,-80 ℃冻存。
2.5Western blot法检测蛋白水平 细胞裂解液进行蛋白定量后,取60 μg蛋白进行10%SDS-PAGE凝胶电泳,蛋白分离后转膜至硝酸纤维素膜,置于5%脱脂奶粉中室温封闭1 h,分别孵育抗STAT3抗体(1∶1 000)、p-STAT3抗体(1∶1 000)和eIF5抗体(1∶1 000)4 ℃过夜。次日采用TBST溶液洗膜后,置于HRP标记的山羊抗兔IgG(1∶3 000)中,室温孵育1 h,洗膜后采用ECL发光液显影。
2.6ELISA检测IL-6含量 采用R&D的小鼠IL-6免疫检测试剂盒(Cat#DY406),用ELISA方法检测细胞培养液上清中IL-6含量。以标准品的A450值作线性回归直线,再通过样品的A450值计算出样品的浓度。
2.7miR-21启动子报告基因质粒的构建 采用天根生化公司的基因组提取试剂盒提取新生小鼠基因组,扩增miR-21启动子片段,上游引物序列为5’-CCGCTCGAGCGAGTACATAAA-3’,下游引物序列为5’-CCGCTCGAGCAAAGATCACTATCCCAATC-3’。回收片段,与载体pGL3-basic分别进行XhoI/HindIII双酶切、回收和连接,转化和鉴定质粒。
2.8质粒转染和报告基因活性检测 采用Invitrogen的Lipofectamine 2000进行质粒转染。心肌细胞按约每孔1.5×105个细胞种植于24孔板,贴壁培养24 h后,换液(含BrdU和血清但不含双抗的DMEM,每孔500 μL),转染操作按照说明书进行。转染萤光素酶报告基因质粒(含miR-21启动子区萤光素酶报告基因pGL3-21PPR)每孔0.32 μg,同时共转染每孔0.02 μg海肾(Renilla)萤光素酶报告基因作为内参照,转染24 h后换液(无血清的DMEM每孔1 mL)继续培养24 h后,加入条件培养液处理24 h后,收集细胞裂解液,-80 ℃冻存待测。应用Promega的Dual-Luciferase Reporter Assay System(Cat# E1910)进行检测。检测时应用Promega的CLOMAX仪。预先加好每孔20 μL细胞裂解液放入白板,避光放置5 min,然后启动自动加样的DLR(双报告)程序。每次顺序加入每孔100 μL LARII以及100 μL Stop&Glo Reagent至96孔白板(Costar, Cat# 3922)。读数为目的基因萤火虫萤光素酶(firefly)活性以及内参海肾萤光素酶(Renilla)报告基因的活性,检测结果经内参校正,用相对萤光素酶活性单位(relative luciferase activity,RLU)表示,即目的基因萤光素酶活性与Renilla萤光素酶报告基因的萤光素酶活性的比值。
3 统计学处理
实验结果以均数±标准误(mean±SEM)表示。数据统计采用Prism 5.0软件进行分析(Graphpad Software Inc.)。对照组与处理组之间的比较采用t检验或方差分析。以P<0.05为差异有统计学意义。
结 果
1 ISO处理心脏成纤维细胞的条件培养液可使小鼠心肌细胞miR-21表达增加
采用条件培养液孵育心肌细胞24 h后,检测miR-21表达量的改变。随着ISO孵育成纤维细胞时间越长,所制备的条件培养液引起的心肌细胞miR-21的表达量越高;其中ISO作用24 h产生的条件培养液,可使心肌细胞miR-21表达量比对照组增加130%(P<0.01),ISO作用48 h产生的条件培养液,可使miR-21增加140%(P<0.05),见图1A,而ISO直接作用下的心肌细胞及心脏成纤维细胞miR-21的表达量未见明显增加,见图1B。
2 ISO作用的心脏成纤维细胞条件培养液可使心肌细胞miR-21转录活性显著增加
应用萤光素酶报告基因实验检测了ISO作用不同时间的条件培养液对心肌细胞miR-21转录活性的影响。随着ISO孵育成纤维细胞时间的延长,所制备的条件培养液引起的心肌细胞miR-21的转录活性增加越高,其中ISO作用24 h产生的条件培养液可使心肌细胞miR-21转录活性比对照组增加94.9%(P<0.01),ISO作用48 h产生的条件培养液,可使心肌细胞miR-21增加77.1% (P<0.01),与miR-21表达水平的变化趋势一致,见图2。
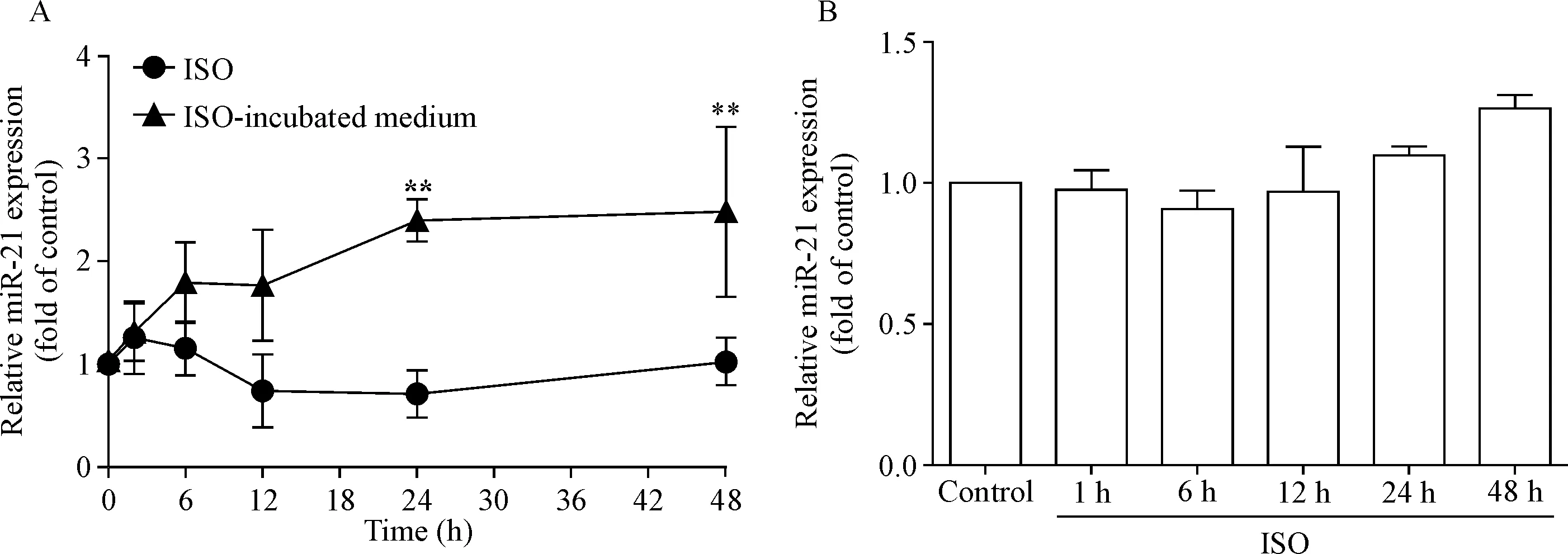
Figure 1.The expression of miR-21 in cardiomyocytes after incubation with conditioned medium from fibroblasts treated with ISO (10 μmol/L) for different time. A: the expression of miR-21 in cardiomyocytes significantly increased after incubation with the medium from ISO-treated fibroblasts, and ISO did not directly induce miR-21 up-regulation in cardiomyocytes; B: miR-21 expression was not induced in fibroblasts by ISO (10 μmol/L) stimulation. Mean±SEM.n=3.*P<0.05,**P<0.01vsISO group.
图1ISO处理心脏成纤维细胞的条件培养液可使小鼠心肌细胞miR-21表达增加
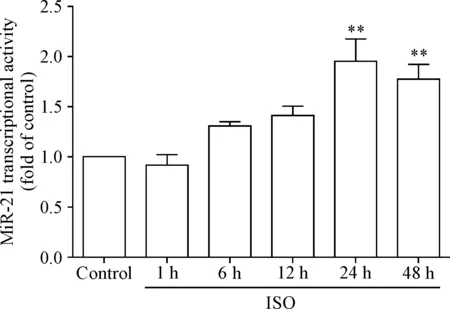
Figure 2.miR-21 transcriptional activity was determined by luciferase activity assay. Transcriptional activity of miR-21 in cardiomyocytes significantly increased after incubation with the medium from ISO-treated fibroblasts. Mean±SEM.n=3.**P<0.01vscontrol group.
图2萤光素酶报告基因实验检测miR-21的转录活性
3 ISO作用成纤维细胞形成的条件培养液增加心肌细胞转录因子STAT3活性
随着ISO孵育成纤维细胞时间越长,所制备的条件培养液引起的心肌细胞磷酸化STAT3(p-STAT3)含量越高,其中ISO作用24 h产生的条件培养液作用于心肌细胞30 min,p-STAT3/STAT3增加96.6%(P<0.01);ISO作用48 h产生的条件培养液,可使心肌细胞p-STAT3/STAT3增加142%(P<0.01),见图3A。
ISO作用成纤维细胞24 h产生的条件培养液使心肌细胞p-STAT3/STAT3和miR-21表达量分别较对照组增加57.7%(P<0.01)和128%(P<0.01)。 应用JAK2/3/STAT3的抑制剂AG490预先孵育细胞30 min抑制JAK-STAT3通路,再给予条件培养液孵育,则可显著抑制条件培养液引起的心肌细胞p-STAT3/STAT3和miR-21表达增加,与只给予条件培养液组相比,分别抑制25.9%(P<0.05)和40.2%(P<0.05), AG490本身不影响心肌细胞p-STAT3/STAT3和miR-21的表达,见图3B、3C。
4 ISO作用的成纤维细胞条件培养液中IL-6水平增加,IL-6可剂量依赖性升高心肌细胞miR-21表达
ISO作用成纤维细胞6、12、24和48 h制成的4种条件培养液,均可显著增加成纤维细胞上清中IL-6的水平,而ISO对心肌细胞IL-6的分泌水平无明显影响,见图4A。直接给予IL-6刺激心肌细胞24 h可以起miR-21表达增加,100 pmol/L的IL-6使心肌细胞miR-21表达增加约153%(P<0.05),与条件培养液的效果类似,见图4B。
讨 论
miR-21通过负调控多种靶基因,如Sprouty、PTEN[10]、Smad7[13]和programmed cell death protein 4(PDCD4)等[14],发挥促细胞增殖和分泌、抑制细胞凋亡的作用。miR-21参与心脏重构的作用已有报道,但miR-21的上游调控机制尚未阐明。本项工作探讨了交感/肾上腺素受体激动引起的心脏重构过程中,引起miR-21这一重要分子表达改变的调控机制,证实了激动β-ARs可介导成纤维细胞合成和表达IL-6,旁分泌作用于心肌细胞,进而通过上调心肌细胞中转录因子STAT3活性,增加miR-21的转录和表达水平,加重心脏重构反应。揭示成纤维细胞旁分泌IL-6,经由细胞间的相互作用,以上调心肌细胞miR-21表达,参与了β-ARs激动所介导的心脏重构的信号转导机制。

Figure 3.Altered p-STAT3 expression in cardiomyocytes after incubation with conditioned medium from fibroblasts treated with ISO for different time. A: the relative expression of p-STAT3/STAT3 of cardiomyocytes were time-dependently increased after incubation with conditioned medium; B: AG490 inhibited the relative expression of p-STAT3/STAT3 in cardiomyocytes induced by ISO-incubated medium from fibroblast; C: AG490 inhibited miR-21 expression in cardiomyocytes induced by ISO-incubated medium from fibroblast. Mean±SEM.n=3.**P<0.01vscontrol medium group;#P<0.05vsISO medium group.
图3ISO作用心脏成纤维细胞的条件培养基增加心肌细胞p-STAT3和miR-21的表达
多种心脏重构模型中均可见miR-21表达增加[15-17]。在不同病因作用下miR-21作用于多种靶基因,发挥促心脏重构的作用[8]。但既往的研究中检测心肌组织中miR-21的表达均为心脏整体表达情况,为了研究整体心脏中增加的miR-21的来源和调控机制,本研究分别在原代心肌细胞和心脏成纤维细胞中进行检测,单独给予这2种细胞ISO处理均不引起miR-21的表达变化,提示miR-21的表达上调可能源于细胞间的交互作用。ISO作用于成纤维细胞形成的培养液上清,可时间依赖性上调心肌细胞miR-21表达,并且条件培养液可显著激活miR-21的转录活性,证实激动β-ARs引起的miR-21表达上调是在转录水平实现的。以往亦有研究报道ISO作用于大鼠心肌细胞,可促进miR-21表达增加[18],与我们研究结果不同,可能原因是细胞来源的动物种属不同所致。
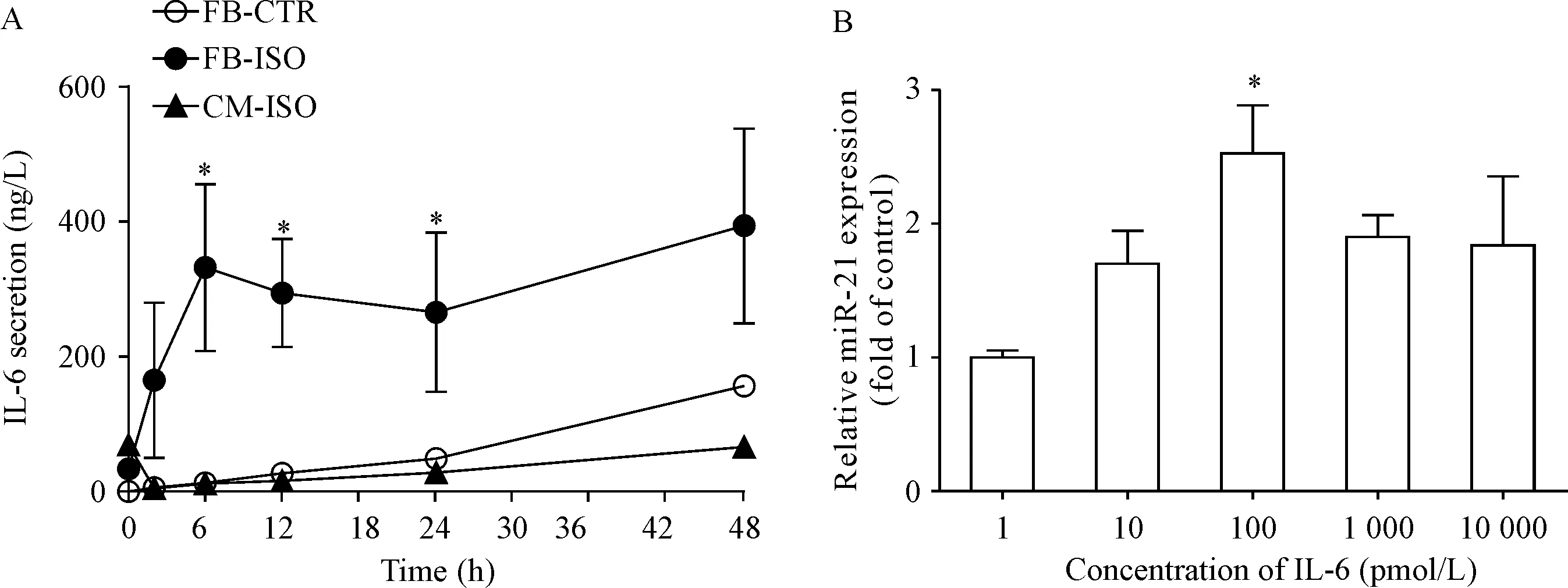
Figure 4.ISO regulates cardiac miR-21 expression through the paracrine action of IL-6 from fibroblasts. A: IL-6 secretion of cardiomyocytes and fibroblasts upon ISO incubation for different time. ISO did not induce IL-6 secretion in cardiomyocytes, but IL-6 secretion was significantly increased in cardiac fibroblasts; B: IL-6 time-dependently increases miR-21 expression in cardiomyocytes. Mean±SEM.n=3.*P<0.05vsother groups;#P<0.05vs1 pmol/L group. FB-ISO: cardiac fibroblast with ISO (10 μmol/L) treatment. CM-ISO: cardiomyocytes with ISO (10 μmol/L) treatment. CTR: control.
图4ISO作用的成纤维细胞培养液中IL-6水平增加
转录因子是引起心肌细胞miR-21转录激活的主要机制之一,miR-21的启动子区含有多个保守的增强子原件,包括激活蛋白1(AP1,由Fos和Jun家族核心癌基因组成)、C/EBP-α(控制造血系统分化的关键因子)及核因子I(NFI)、SRF、p53和STAT3的结合位点[19]。STAT3是miR-21的转录因子[20],STAT3激活可增加miR-21的转录活性和表达水平,同时STAT3是介导肾上腺素受体激活发挥促心脏重构作用的重要信号分子[21-22]。本研究结果与既往报道一致,ISO作用成纤维细胞形成的条件培养液,导致心肌细胞中STAT3活性显著增加,STAT3活性变化与miR-21表达改变一致;给予STAT3通路抑制剂,则可显著抑制条件培养液引起的心肌细胞miR-21的表达增加,证实激动β-ARs引起的心肌miR-21表达上调至少部分依赖于心肌细胞中转录因子STAT3的激活。
我们以往研究表明,小鼠心肌细胞上的β-ARs并不能直接介导STAT3激活,而是首先激动成纤维细胞的β2-AR,使其分泌IL-6水平分泌增加,IL-6旁分泌作用于心肌细胞上的gp130受体,从而导致心肌细胞的STAT3激活[23]。本研究中ISO既不能直接使小鼠心肌细胞miR-21增加,也不能使成纤维细胞miR-21明显增加,但是ISO作用后的成纤维细胞的培养液上清却可使心肌细胞miR-21表达量和转录活性显著增加,表明心脏β-ARs介导的miR-21表达增加可能同STAT3的激活机制相似。有报道发现多发性骨髓瘤细胞IL-6通过激活STAT3,使其与miR-21启动子上游的结合位点结合,促进miR-21的表达,从而保证瘤细胞的存活[24]。我们检测了条件培养液中IL-6水平,观察到了与既往研究一致的结果,随着ISO孵育成纤维细胞时间的延长,培养液中IL-6水平逐渐增加,IL-6可以时间依赖性地增加心肌细胞中miR-21的表达量。近期研究报道,β-ARs通过IL-6旁分泌机制参与心脏重构,ISO通过激活作用于心脏成纤维细胞的p38,促进IL-6合成和释放,进而通过旁分泌作用引起心肌细胞肥大改变[25]。本研究结果进一步补充了上述研究中的级联调控机制,即提示β-ARs通过作用于心脏成纤维细胞,引起其分泌IL-6水平增高,旁分泌作用于心肌细胞,经由转录因子STAT3活化,从而在转录水平激活miR-21,引起miR-21表达显著增高,发挥多靶向作用,促进细胞肥大,抑制细胞凋亡,参与心脏重构。
β-ARs激活引起的心脏重构中,细胞间相互作用机制对细胞和心脏功能产生了重要的影响;成纤维细胞响应刺激信号,合成和分泌细胞因子IL-6水平增加,旁分泌作用于心肌细胞,继而引起心肌细胞STAT3活化和miR-21转录增加。靶向抑制成纤维细胞旁分泌途径中的关键分子,将抑制miR-21上游激活机制,从而抑制β-ARs/STAT3/IL-6/miR-21信号通路的效应,可望阻遏心脏重构的进展,保护心脏功能。

