bFGF对颅脑损伤大鼠脑水肿、神经功能损伤及自噬相关蛋白表达的影响*
王文宏, 孔 君, 林小祥, 李剑侠, 陈陆馗
(1东南大学附属中大医院神经外科, 江苏 南京 210001; 2东南大学附属中大医院江北分院神经外科, 江苏 南京 210044)
创伤性颅脑损伤(craniocerebral injury, CI)又称颅脑外伤,是外伤患者致残和致死的主要原因之一。随着医疗技术的不断发展,颅脑损伤患者的生存率虽有较大提高,但其神经功能障碍给患者及其家属带来诸多困扰[1-2]。颅脑损伤可诱发炎症、脑水肿和氧化损伤等病理过程[3-4]。存在于脑组织中的碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)能够促进创伤愈合、组织修复及组织再生,具有广泛的生物学特性[5]。最近的研究显示,bFGF能够减轻颅脑损伤后的神经元损伤,促进颅脑损伤大鼠运动能力的恢复,但对颅脑损伤大鼠的炎症反应、氧化应激和自噬等的影响尚不明确[6]。本实验构建了颅脑损伤大鼠模型,探讨bFGF对颅脑损伤大鼠神经功能、炎症反应和脂质过氧化等的影响,为bFGF治疗颅脑损伤的临床应用提供理论依据。
材 料 和 方 法
1 实验动物、试剂与仪器
成年雄性SD大鼠共50只,体重250 g~280 g,购自南京大学动物模式研究所实验动物中心,合格证号为SCXK(苏)2015-0001。
丙二醛(malondialdehyde,MDA)含量检测试剂盒购自Solarbio;肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)ELISA检测试剂盒和超氧化物歧化酶(superoxide dismutase,SOD)活性测定试剂盒购自上海碧云天生物技术有限公司;谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性检测试剂盒购自上海信帆生物;白细胞介素6(interleukin-6,IL-6)和IL-1β ELISA检测试剂盒购自Thermo;抗LC3-Ⅱ抗体、抗beclin-1抗体和HRP标记的II抗购自GeneTex; BCA Protein Assay Kit购自Sigma;重组人bFGF购自Promega。StatFax酶标仪购自AWARENESS;电泳仪购自Bio-Rad; Alpha凝胶成像分析系统购自Protein Simple;大脑立体定向仪购自四川成都仪器厂。
2 实验方法
2.1颅脑损伤大鼠模型的构建 大鼠饲养条件为21~25 ℃,12 h光照,不限制饮水和饮食。大鼠颅脑损伤模型构建采用Feeney’s自由落体硬膜外撞击法,步骤参照文献[7],按照50 mg/kg的戊巴比妥钠腹腔注射麻醉大鼠,将大鼠的头部固定于立体定向仪,把顶部的皮毛剪掉,于大鼠右侧头部冠状缝后2 mm,中线旁开2 mm的位置将大鼠的头皮切开,把骨膜分离掉,暴露颅骨,用牙科钻头钻一个直径大小为5 mm的孔,保持硬膜的完整,给予高20 cm、重30 g的击锤自由坠落撞击,引起颅脑损伤,以骨蜡把骨孔封闭以后,将头皮缝合。大鼠随机分为对照(control)组、CI组及bFGF低剂量(low-dose,L)组、中剂量(middle-dose,M)组和高剂量(high-dose,H)组,每组10只。CI组按照上述方法构建颅脑损伤模型;对照组不给予硬膜外撞击,其它同模型组;bFGF低、中和高剂量组在建模成功后30 min分别给予2、4和6 μg的bFGF(溶于1 mL的生理盐水中)腹腔注射,连续注射7 d;CI组和对照组给予注射等量的生理盐水。
2.2大鼠神经功能评分 以改良神经功能评分法对各组大鼠的神经功能进行评分,分值越高神经功能损伤越重。在颅脑损伤后的1 d、4 d和7 d进行评分,评分标准参照文献[7]。最高得分值为18分。
2.3大鼠脑组织中含水量的测定 各组大鼠在颅脑损伤7 d神经功能评分后,取大鼠的全脑组织,于电子天平上称量脑组织的湿重,再把脑组织放在锡纸中包裹以后,100 ℃烤干24 h,再用电子天平称量干重。脑组织水含量(%)=(湿重-干重)/湿重×100%。
2.4大鼠脑组织中TNF-α、IL-6和IL-1β水平的测定 取方法2.3中收集的脑组织,制作脑组织匀浆液,用ELISA法测定TNF-α、IL-6和IL-1β含量,具体操作步骤同试剂盒说明书。简述如下:用冰预冷的PBS将组织洗涤并剪碎以后,进行组织匀浆,5 000×g离心10 min,收集组织匀浆液,将标准品稀释以后,按照每孔50 μL的标准品添加于酶标板上,待测孔每孔添加10 μL,在37 ℃孵育30 min以后,添加酶标试剂,显色剂显色以后,测定波长450 nm处的吸光度(A)值,根据标准曲线计算浓度。
2.5大鼠脑组织中MDA含量及SOD和GSH-Px活性的测定 取方法2.3中收集的脑组织,制作脑组织匀浆液,在组织匀浆液中加入0.5%的硫代巴比妥酸溶液,置于沸水煮沸10 min,检测波长450 nm、532 nm和600 nm处的A值,根据公式:MDA浓度(μmol/L)=[6.45×(A532-A600)-0.56×A450]计算MDA含量。另外取组织匀浆液,根据样品和标准品设置96孔板,在37 ℃孵育30 min以后,检测450 nm处的A值,计算SOD酶活力。GSH-Px是一种硒蛋白酶,可以同苯甲酸显色液发生反应生成黄色的离子,检测422 nm处的A值可以间接推算GSH-Px的活性,GSH-Px活性检测步骤同试剂盒说明书。
2.6大鼠脑组织中自噬相关蛋白LC3-Ⅱ和beclin-1表达水平的检测 取方法2.3中收集的脑组织,研磨后,添加含有PMSF的裂解液,用BCA法测定蛋白浓度。把蛋白样品同1/4体积的5×Loading Buffer混匀后,100 ℃煮沸5 min。配制10%的分离胶和5%的浓缩胶,在上样孔中加入30 μg的蛋白样品,以90 V电压在浓缩胶中电泳,约30 min后,把电压升高至120 V,当溴酚蓝染料达到底部边缘后,把电源关闭,取出蛋白凝胶。把凝胶上的蛋白在90 V电压条件下电转到NC膜上。取出NC膜,置于100 g/L的脱脂奶粉中,室温条件孵育2 h。将抗LC3-Ⅱ和beclin-1抗体用TBST以1∶800稀释以后,与NC膜反应,反应条件为4 ℃过夜; 再将HRP标记的 II 抗用TBST以1∶3 000稀释,于室温中孵育2 h。用ECL发光试剂盒显色,以ImageQuant LAS 4000mini拍照分析灰度值,GAPDH作为内参照,分析LC3-Ⅱ和beclin-1的蛋白水平。
3 统计学处理
数据采用SPSS 21.0软件进行统计分析。所有数据以均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 bFGF改善颅脑损伤大鼠神经功能
CI模型组大鼠神经功能评分高于对照组(P<0.05),而bFGF-L、-M和-H组颅脑损伤大鼠的神经功能评分低于脑损伤组(P<0.05),说明bFGF改善颅脑损伤大鼠神经功能,见表1。研究也发现与对照组相比,CI组大鼠脑组织结构疏松,空泡增多,且肿胀和坏死细胞明显增多,而bFGF处理后病理结构有所改善,且高剂量组的改善效果优于中剂量组,中剂量组的改善效果优于低剂量组,见图1。
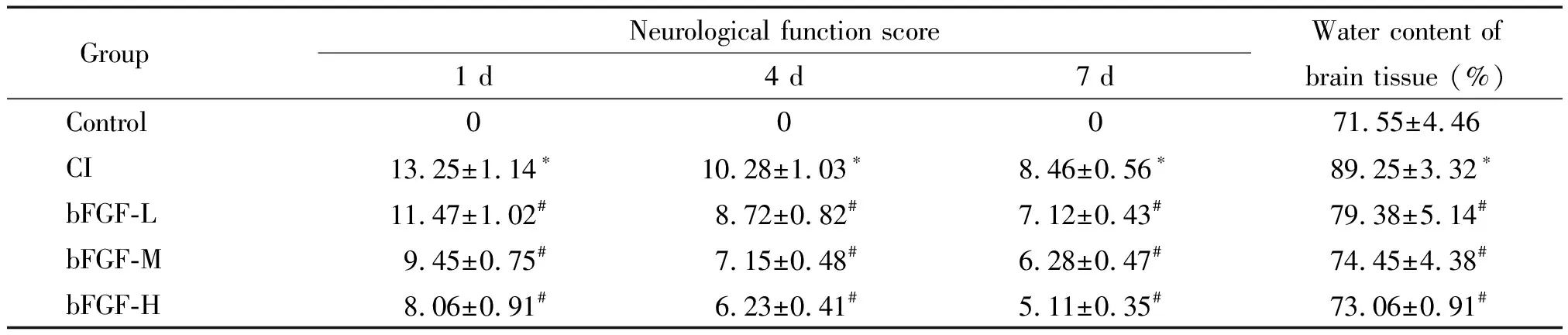
表1 各组大鼠神经功能评分和脑组织含水量的比较
*P<0.05vscontrol group;#P<0.05vsCI group.
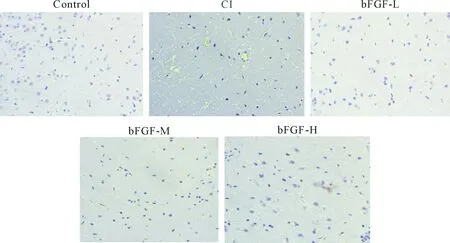
Figure 1.bFGF attenuated craniocerebral injury in the rats (HE staining, ×40).
图1bFGF改善大鼠颅脑损伤
2 bFGF降低颅脑损伤大鼠脑组织含水量
脑损伤组大鼠的脑组织含水量高于对照组(P<0.05),而bFGF-L、-M和-H组颅脑损伤大鼠脑组织的含水量低于脑损伤组(P<0.05),说明bFGF降低颅脑损伤大鼠脑组织含水量,见表1。
3 bFGF降低颅脑损伤大鼠脑组织中TNF-α、IL-6和IL-1β的含量
脑损伤组大鼠脑组织中TNF-α、IL-6和IL-1β的含量高于对照组(P<0.05),而bFGF-L、-M和-H组颅脑损伤大鼠脑组织中的TNF-α、IL-6和IL-1β含量低于脑损伤组(P<0.05),说明bFGF降低颅脑损伤大鼠脑组织中TNF-α、IL-6和IL-1β含量,减轻脑组织炎症,见表2。
表2各组大鼠脑组织中TNF-α、IL-6和IL-1β水平的比较
Table 2.The changes of TNF-α, IL-6 and IL-1β levels in the brain tissues of the rats in each group (Mean±SD.n=10)

GroupTNF-α (ng/g)IL-6 (ng/g)IL-1β (ng/g)Control79.25±6.141.54±0.1256.23±5.27CI241.78±22.86∗5.45±0.57∗185.26±14.02∗bFGF-L194.25±12.45#4.36±0.32#148.21±12.56#bFGF-M175.48±11.20#3.12±0.20#121.45±10.37#bFGF-H164.25±14.58#2.46±0.15#112.57±10.89#
*P<0.05vscontrol group;#P<0.05vsCI group.
4 bFGF减轻颅脑损伤大鼠脑组织氧化损伤
脑损伤组大鼠脑组织中的MDA水平高于对照组,而SOD和GSH-Px活性低于对照组(P<0.05);bFGF-L、-M和-H组颅脑损伤大鼠脑组织中MDA水平低于脑损伤组,而SOD和GSH-Px活性高于脑损伤组(P<0.05),说明bFGF降低颅脑损伤大鼠脑组织氧化损伤,减轻氧化应激,见表3。
表3各组大鼠脑组织中MDA含量及SOD和GSH-Px活性的比较
Table 3.The content of MDA and the activity of SOD and GSH-Px in the brain tissue of each group (Mean±SD.n=10)
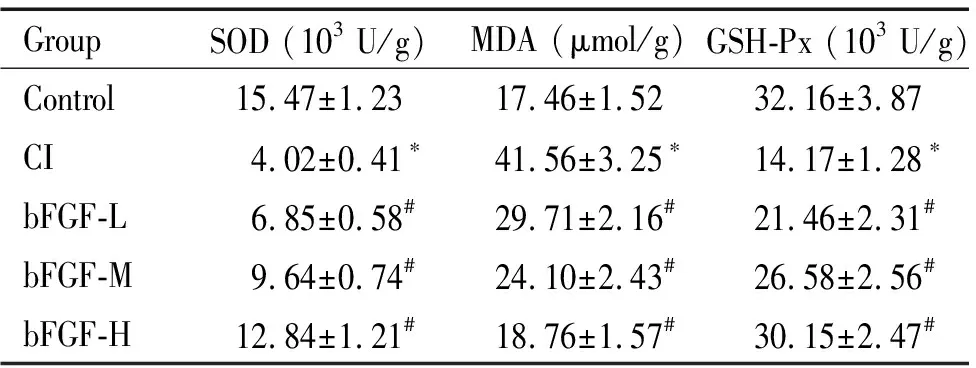
GroupSOD (103 U/g)MDA (μmol/g)GSH-Px (103 U/g)Control15.47±1.2317.46±1.5232.16±3.87CI4.02±0.41∗41.56±3.25∗14.17±1.28∗bFGF-L6.85±0.58#29.71±2.16#21.46±2.31#bFGF-M 9.64±0.74#24.10±2.43#26.58±2.56#bFGF-H12.84±1.21#18.76±1.57#30.15±2.47#
*P<0.05vscontrol group;#P<0.05vsCI group.
5 bFGF降低颅脑损伤大鼠脑组织中自噬相关蛋白LC3-Ⅱ和beclin-1的表达
脑损伤组大鼠脑组织中LC3-Ⅱ和beclin-1蛋白水平高于对照组(P<0.05);bFGF-L、-M和-H组颅脑损伤大鼠脑组织中的LC3-Ⅱ和beclin-1蛋白水平低于脑损伤组(P<0.05),说明bFGF降低颅脑损伤大鼠脑组织的自噬水平,见图2和表4。

Figure 2.The images of Western blot for determining the protein expression of autophagy related proteins in the brain tissues of the rats in each group.
图2Westernblot测定各组大鼠脑组织中自噬相关蛋白的表达
表4各组大鼠脑组织中LC3-Ⅱ和beclin-1蛋白水平比较
Table 4.The protein levels of LC3-II and beclin-1 in the brain tissue of each group (Mean±SD.n=10)

GroupLC3-ⅡBeclin-1Control0.15±0.030.26±0.02CI1.03±0.12∗0.79±0.08∗bFGF-L0.84±0.10#0.51±0.06#bFGF-M0.55±0.06#0.43±0.02#bFGF-H0.35±0.04#0.31±0.04#
*P<0.05vscontrol group;#P<0.05vsCI group.
讨 论
bFGF含有155个氨基酸,具有促进神经元和胶质细胞生长的作用,其在体内可以抑制兴奋性氨基酸等对神经元的毒性作用,此外,外源性的bFGF可以促进雪旺细胞、内皮细胞和成纤维细胞等多种细胞的增殖,参与组织伤口愈合[8]。近年来的研究表明,bFGF具有减轻脑缺血再灌注损伤的作用,对于脑梗塞、脊髓损伤和脑震荡等均有抑制作用[9-10]。bFGF治疗后的重型颅脑损伤患者的脑水肿现象逐渐消退,脑组织供血明显改善[11]。本实验的结果显示,bFGF处理后的颅脑损伤大鼠模型神经功能评分明显降低,说明bFGF具有改善颅脑损伤神经功能的作用。
颅脑损伤后脑组织的局部会发生炎症反应,加上颅脑损伤导致的感染,会产生大量的TNF-α等炎性因子,诱导组织中炎性细胞的激活,激活的炎性细胞进入脑组织后可以再次释放炎症因子,导致血脑屏障被破坏,引起脑水肿,导致脑损伤[12-13]。TNF-α、IL-1β和IL-6等炎症因子在颅脑损伤大鼠模型脑组织中表达升高,并且与大鼠神经功能评分和脑水肿程度等有关[14]。IL-6是启动炎症反应的重要因子,TNF-α是炎症早期出现的炎性因子[15]。除了组织炎症,氧化应激是引起颅脑继发性损伤的另一个重要原因,颅脑创伤可以引起脑组织中产生大量的氧自由基,正常组织中少量的氧自由基是信号转导的关键因子,而过量的氧自由基会引起脂质发生过氧化,MDA是脂质过氧化的产物之一[16]。SOD是细胞内氧自由基的主要清除剂,具有降低氧自由基水平的作用,GSH-Px具有催化过氧化氢分解的作用,其是降低组织中氧自由基含量的另外一种蛋白酶[17]。有研究表明,bFGF具有降低细胞中氧自由基水平的作用,在心肌细胞、成肌细胞和神经细胞等细胞中已经得以证实[18-20]。本实验的结果表明,bFGF治疗后的颅脑损伤大鼠模型的脑组织含水量降低,脑组织中TNF-α、IL-6和IL-1β平降低,同时MDA含量也降低,SOD和GSH-Px活性升高,说明bFGF可以通过降低组织炎症和氧化损伤减轻颅脑损伤,而对于其在感染诱导的组织炎症中的作用尚不明确。
细胞自噬是除了凋亡和坏死之外细胞的第3种死亡方式,是存在于细胞内的蛋白质和细胞器等通过溶酶体降解的途径。正常情况下,细胞自噬有利于维持细胞内环境的稳定,而在病理条件下,细胞过度自噬会引起细胞死亡,引起组织损伤[21]。LC3是哺乳动物Atg8的同源物,其可以靶向定位自噬体膜,是目前公认的自噬过程中的动力学标志物,LC3-Ⅱ是LC3的细胞形式之一,其可以促进自噬小体的生成,LC3-Ⅱ表达水平的高低是自噬水平高低的标志[22]。Beclin-1参与介导自噬蛋白在吞噬泡中的定位过程,是自噬体形成的必需因子,在自噬过程中表达升高[23]。有研究表明,bFGF能够在体外减轻雷帕霉素诱导的神经细胞过度自噬,发挥神经细胞保护作用[24]。本实验表明,bFGF处理后的颅脑损伤大鼠模型脑组织中LC3-Ⅱ和beclin-1表达水平降低,脑组织中自噬水平降低,提示bFGF可以通过抑制颅脑损伤脑组织中的自噬水平发挥颅脑保护作用。
bFGF具有促进损伤修复的作用,其可以通过减少脑组织中非感染因素所致的炎症介质的释放、减轻氧化损伤、降低自噬水平减缓颅脑损伤,促进颅脑损伤大鼠神经功能恢复,这为bFGF治疗颅脑损伤提供了理论依据。由于本实验中所构建的颅脑损伤模型不能完全模拟人体临床颅脑损伤,临床上感染因素诱导颅脑组织炎症也是颅脑损伤发生的重要原因,在以后的实验中会对感染和非感染诱导的颅脑炎症进行具体探讨。

