京尼平抑制高糖诱导的大鼠心肌H9c2细胞氧化应激及凋亡损伤*
师 岩, 徐 晶▲, 程 昊, 齐晓丹, 樊 丽, 梁丽杰, 宁小美, 李淑艳, 徐文双, 陈庆友, 张春晶△
(齐齐哈尔医学院 1生物化学教研室, 2附属第三医院内分泌科, 3附属第二医院, 4齐齐哈尔市五官医院, 黑龙江 齐齐哈尔 161006)
糖尿病并发症严重危害着人们的健康,持续高血糖导致的糖尿病心肌病(diabetic cardiomyopathy,DCM)是很多糖尿病患者发生心衰和死亡的原因之一。现已明确糖尿病及其并发症的统一发病机制之一是高浓度血糖水平引起人体氧化应激损伤[1],产生大量活性氧簇(reactive oxygen species,ROS)会直接损伤心肌细胞,引起心肌细胞凋亡,常常导致心肌发生严重的功能性障碍[2],因此通过抗氧化防治糖尿病心肌病是一个有效途径,研究天然有效的抗氧化剂具有重要意义。
京尼平(genipin, GEN)属于环烯醚萜类物质,是传统中药栀子花和果实中提取的京尼平苷经β-葡萄糖苷酶水解而生成的[3],具有强抗氧化活性,小剂量应用具有天然无毒、分子量小和易于被机体吸收等优点[4]。研究显示,京尼平对缺氧/复氧引起的心肌细胞氧化应激损伤具有很好的拮抗作用,且能够有效减轻肝脏细胞氧化应激损伤[5],减轻氧化应激损伤导致的脊髓小脑共济失调的症状[6],具有抑制胃癌、前列腺癌、乳腺癌和结肠癌等细胞生长的作用[7-10];在独立的胰岛中加入京尼平还可逆转高葡萄糖和肥胖诱导的β细胞功能障碍[11],并对血管通透性也具有一定的保护作用[12]。但是京尼平对高浓度葡萄糖引起心肌细胞损伤的作用及相关机制报道并不多见。在前期大量抗氧化剂研究的基础上,我们以培养的大鼠心肌H9c2细胞为研究对象,建立高浓度葡萄糖诱导的心肌细胞损伤模型[13],证明京尼平在抑制高浓度葡萄糖诱导的心肌细胞损伤中的作用及其作用机制。
材 料 和 方 法
1 材料
大鼠心肌H9c2细胞由本实验室保存(中国医学科学院基础医学研究所基础医学细胞中心);京尼平(Cayman);胎牛血清和活性氧簇(reactive oxygen species, ROS)检测试剂盒(Invitrogen);葡萄糖(Sigma);0.25%胰酶-0.02% EDTA(吉诺生物医药技术有限公司);DMEM培养基(Thermo);CCK-8检测试剂盒(南京建成生物工程研究所);凋亡检测试剂盒(Roche);线粒体膜电位检测试剂盒、超敏ECL化学发光试剂盒和BCA蛋白浓度测定试剂盒(碧云天生物技术有限公司);抗锰超氧化物歧化酶(manganese superoxide dismutase,Mn-SOD)、细胞色素C(cytochrome C,Cyt C)、Bax和cleaved caspase-3抗体(Santa Cruz和Abcam);抗p-Akt抗体(Cell Signaling Technology);山羊抗鼠抗体(北京中杉金桥生物技术有限公司)。
COULTER® EPICS®XLTM流式细胞仪(Beckman Coulter);凝胶成像系统(Bio-Rad);LSM 710激光扫描共聚焦显微镜(ZEISS);酶标仪(MD)。
2 方法
2.1大鼠心肌H9c2细胞的培养 H9c2细胞使用含10%胎牛血清的DMEM培养液常规培养在37 ℃、5% CO2细胞培养箱中。
2.2实验分组及预处理方式 细胞分组:(1)正常糖浓度对照(normal control, NC)组:葡萄糖浓度为5.6 mmol/L;(2)高浓度葡萄糖损伤(high glucose, HG)组:葡萄糖浓度为50 mmol/L;(3)正常糖浓度葡萄糖+京尼平(NC+GEN)组:葡萄糖浓度为5.6 mmol/L,京尼平浓度为10 μmol/L;(4)高浓度葡萄糖+京尼平(HG+GEN)组:葡萄糖浓度为50 mmol/L,京尼平浓度是10 μmol/L。
2.3CCK-8法检测细胞存活率 将心肌 H9c2细胞以每孔2×104个的细胞数悬液接种到96孔培养板,于37 ℃、5% CO2的细胞培养箱中培养24 h,弃去培养基,PBS清洗3次,京尼平(10 μmol/L)作用于正常糖浓度和高葡萄糖浓度细胞中,每孔培养基体积100 μL,每组设6个平行复孔,分组培养48 h,每孔加10 μL CCK-8试剂后,轻缓地晃动培养板,使试剂和培养基充分混匀,空白对照不加细胞悬液只加110 μL CCK-8试剂,继续孵育2 h后,在450 nm波长处检测吸光度(A)值,再换算成细胞存活率比较,重复实验3次。
2.4细胞内丙二醛(malondialdehyde, MDA)含量、超氧化物歧化酶(superoxide dismutase, SOD)活性和细胞上清液中乳酸脱氢酶(lactate dehydrogenase, LDH)活性的测定 H9c2细胞用0.25%胰酶-0.02% EDTA消化,以(1.5~2)×108/L接种于100 mm培养板中,常规培养24 h后。按试剂盒说明书操作,相应波长处测定各组细胞光密度(A)值,再换算成细胞内MDA含量、SOD活性和细胞培养上清液中LDH活性,比较各组细胞氧化应激水平。
2.5DCF法检测细胞内ROS水平 将心肌 H9c2细胞按照每孔1.5×104个细胞接种于96孔板,分组培养后,根据活性氧簇测定试剂盒说明书操作。采用酶标仪于560 nm波长测定A值。
2.6ELISA检测细胞凋亡 分组收集细胞, 4 ℃、1 500 r/min离心5 min,除上清,重新悬浮于200 μL细胞裂解液中,室温裂解30 min,1 000 r/min离心10 min,小心吸出上清液,链霉亲合素包被的培养板每孔加20 μL,根据试剂盒说明书操作。采用酶标仪于410 nm波长测定A值,每一样品做双孔检测,求其平均值,并计算核小体片段聚集值。
2.7线粒体膜电位的检测 心肌H9c2细胞用PBS洗涤细胞2次,然后加入1 mL JC-1染色工作液,充分混匀,细胞培养箱中37 ℃孵育20 min,在JC-1染色缓冲液(1×)洗涤2次后,使用具有FITC和RITC通道的激光扫描共聚焦显微镜获得图像。检测JC-1单体最大激发波长490 nm,最大发射波长530 nm;检测JC-1聚合物最大激发波长525 nm,最大发射波长590 nm。
2.8Western blot检测蛋白表达 将心肌H9c2细胞接种到培养皿中,常规培养24 h后,细胞密度70%~80%, 按照分组后续实验,收集各组细胞获得总蛋白,BCA蛋白浓度测定试剂盒测定蛋白浓度,每孔以40 μg样品上样进行SDS-PAGE,采用湿法进行Western blot转膜(PVDF 膜)1 h, 5% 脱脂奶粉封闭 2 h, 加入 I 抗(Mn-SOD、p-Akt、Cyt C、Bax、cleaved caspase-3浓度为1∶500~1∶1 000,β-actin浓度为1∶5 000),4 ℃ 孵育过夜, II 抗37 ℃ 孵育 1 h, ECL 化学显色,Quantity One 软件分析蛋白表达水平。
3 统计学处理
运用SPSS 22.0统计软件进行分析。数据采用均数±标准差(mean±SD)表示。在方差齐性检验的基础上行方差分析,并用SNK-q检验行各组均数间的两两比较。以P<0.05为差异有统计学意义。
结 果
1 京尼平对高糖损伤的H9c2细胞活力的影响
CCK-8法检测不同浓度京尼平对H9c2细胞活力的影响。结合前期研究,选择50 mmol/L葡萄糖作用于心肌 H9c2细胞72 h,作为高浓度葡萄糖诱发的氧化应激细胞损伤模型[13]。京尼平(10 μmol/L)作用于正常糖浓度和高葡萄糖浓度细胞,与正常糖对照组相比,高糖损伤组细胞活力显著下降(P<0.05);10 μmol/L京尼平作用于高糖细胞中(HG+GEN组),相对于高糖损伤组(HG组)细胞活力显著提高(P<0.05);京尼平加入正常糖浓度组(NC+GEN)与正常糖对照组(NC)相比,细胞活力的差异无统计学显著性,见图1,提示10 μmol/L京尼平对高糖环境培养的细胞具有抑制损伤的作用。
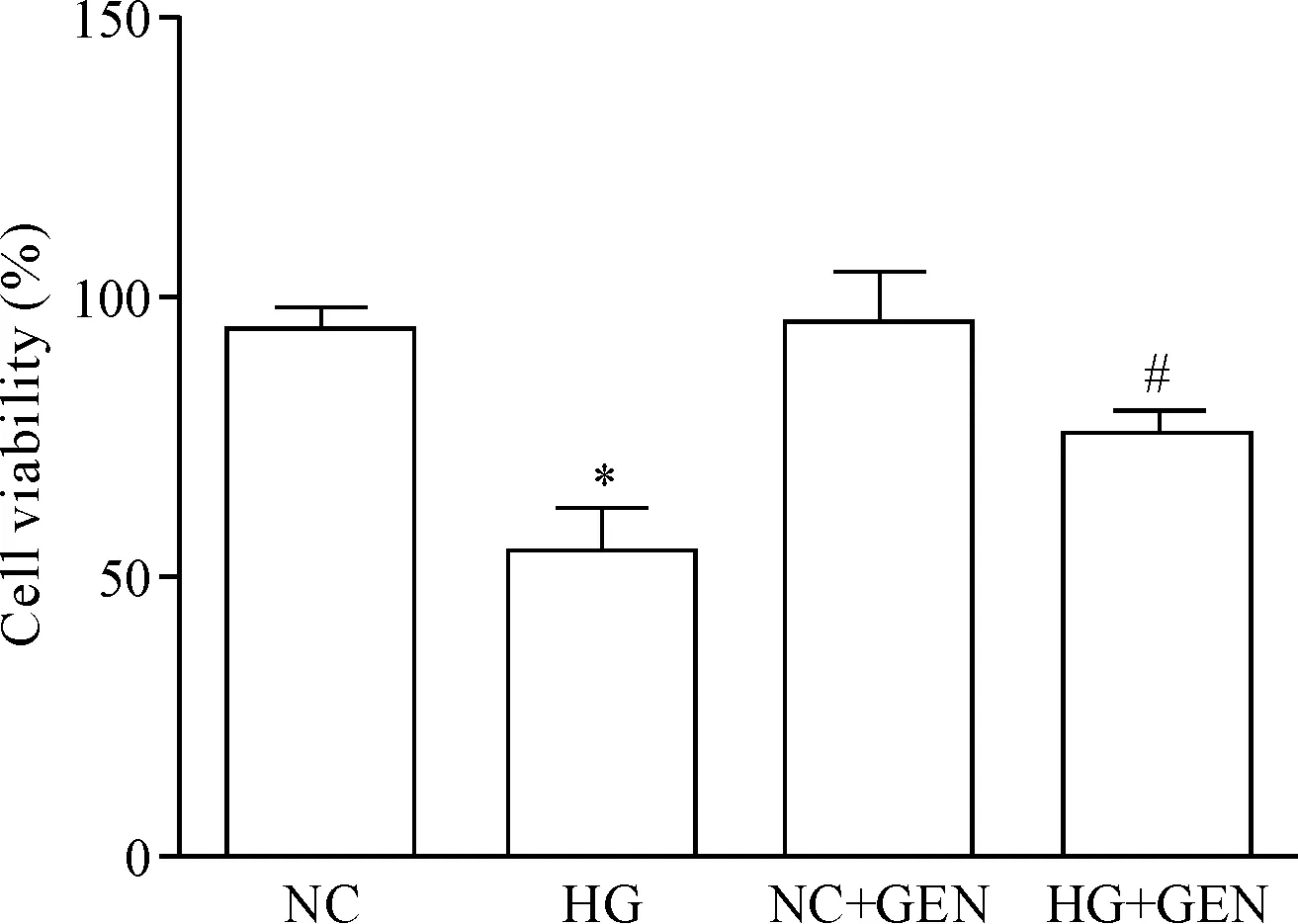
Figure 1.The effects of genipin (GEN) at 10 μmol/L on the viability of H9c2 cells detected by CCK-8 assay. Mean±SD.n=6.*P<0.05vsNC group;#P<0.05vsHG group.
图1CCK-8法检测京尼平(10μmol/L)对H9c2细胞活力的影响
2 京尼平对高糖损伤的H9c2细胞内MDA含量和SOD活性及细胞培养上清液LDH活性的影响
50 mmol/L葡萄糖作用48 h,与正常糖对照组比较,高糖损伤组LDH活性和MDA含量明显增高,SOD活性明显下降(P<0.05);但10 μmol/L浓度京尼平加入高糖中,与HG组比较,其LDH活性和MDA含量明显下降,SOD活性显著上升(P<0.05),提示京尼平能有效抑制高糖引起H9c2细胞的氧化应激损伤,对高糖环境的细胞具有保护作用。NC+GEN组与NC组比较差异无统计学显著性,说明京尼平对正常糖处理的细胞无影响,见表1。
表1各组细胞MDA含量及SOD和LDH活性的比较
Table 1.The changes of the MDA, SOD and LDH levels (Mean±SD.n=9)
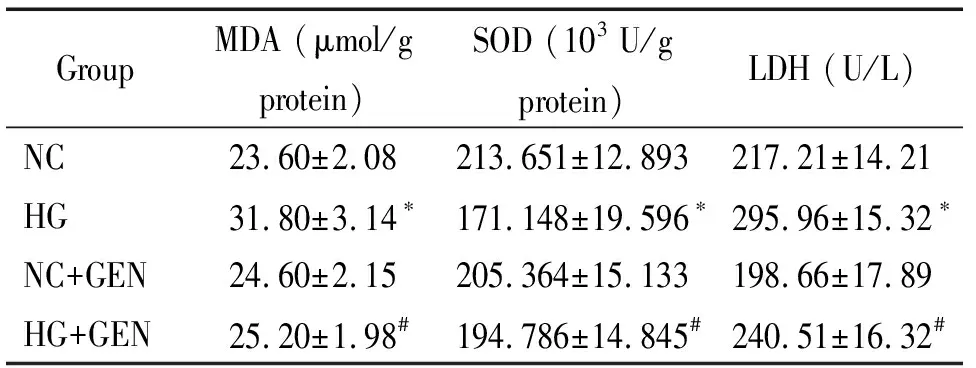
GroupMDA (μmol/g protein)SOD (103 U/g protein)LDH (U/L)NC23.60±2.08213.651±12.893217.21±14.21HG31.80±3.14∗171.148±19.596∗295.96±15.32∗NC+GEN24.60±2.15205.364±15.133198.66±17.89HG+GEN25.20±1.98#194.786±14.845#240.51±16.32#
*P<0.05vsNC group;#P<0.05vsHG group.
3 京尼平对高糖诱导下心肌 H9c2细胞内ROS含量的影响
与正常糖对照组比较,高糖组ROS含量明显增加(P<0.05);与高糖组比较,高糖+京尼平组显著减少由高糖诱导损伤产生ROS的含量(P<0.05);而正常糖+京尼平组与正常糖对照组比较差异无统计学显著性,见图2。

Figure 2.The effect of genipin (GEN) on ROS production in H9c2 cardiomyocytes induced by high glucose (HG). Mean±SD.n=3.*P<0.05vsNC group;#P<0.05vsHG group.
图2京尼平对高糖诱导的H9c2心肌细胞ROS含量的影响
4 京尼平对高糖诱导的心肌H9c2细胞凋亡的影响
检测心肌细胞核小体片段聚集值以评价细胞凋亡的变化,结果表明与正常糖对照组相比,高糖组细胞内核小体的聚集程度明显高于正常糖组(P<0.05);而与高糖组相比,高浓度葡萄糖+京尼平组核小体的聚集程度显著降低(P<0.05),见图3。
5 京尼平对高糖诱导下心肌H9c2细胞线粒体膜电位的影响
激光共聚焦显微观察及JC-1 探针染色法检测各组线粒体膜电位变化,结果显示,与正常糖对照组比较,高糖损伤组的JC-1 探针绿色荧光强度明显增强,红色荧光强度明显减弱(P<0.01),表示线粒体膜电位下降;与高糖损伤组比较,高浓度葡萄糖+京尼平组JC-1 探针绿色荧光明显减弱,红色荧光强度增加(P<0.01),表示线粒体膜电位升高,见图4。

Figure 3.The effect of genipin (GEN) on the apoptosis of high glucose (HG)-induced H9c2 cardiomyocytes detected by nucleosome fragmentation enrichment factor assay. Mean±SD.n=9.**P<0.01vsNC group;#P<0.05vsHG group.
图3核小体片段聚集值分析京尼平对高糖诱导的H9c2心肌细胞凋亡的影响
6 京尼平对高糖诱导下心肌H9c2细胞Mn-SOD、p-Akt、Cyt C、Bax和cleaved caspase-3蛋白水平的影响
与正常糖对照组比较,高糖损伤组细胞内Mn-SOD 和p-Akt的蛋白水平显著减少,Cyt C、Bax和cleaved caspase-3的蛋白水平升高(P<0.05); 与高糖损伤组比较,高糖+京尼平组细胞内Mn-SOD的释放量显著升高(P<0.05),Cyt C、Bax和cleaved caspase-3的蛋白水平减少;而正常糖+京尼平组与正常糖对照组比较差异无统计学显著性,见图5。
讨 论
糖尿病心肌病是心肌细胞对高血糖的急性应激反应而表现出来的慢性病理改变,急性应激反应主要是氧化应激反应、信号转导通路改变及细胞凋亡[14]。体外培养大鼠H9c2心肌细胞,模拟高糖环境中的心肌细胞相关病理变化并探讨抗氧化药物京尼平的作用机制。在前期研究结果基础上[13, 15],建立高糖诱导的细胞损伤模型,用CCK-8法检测的抗氧化剂京尼平对高糖损伤H9c2细胞的影响,结果显示京尼平(10 μmol/L)对正常糖培养的细胞存活率没有影响,能提高高糖损伤组的细胞存活率,说明京尼平对高糖损伤的细胞具有一定的保护作用。在调节氧化应激系统平衡和抗氧化应激酶的系统中MDA和SOD占据着重要的地位,MDA反映着脂质过氧化的程度,含量过高说明受氧自由基攻击程度较严重,导致了细胞损伤;SOD活力的大小可以直接反应细胞清除氧自由基的能力。MDA和SOD相互验证细胞氧化应激状态[16-17]。LDH是一种心肌细胞内标志性酶,细胞损伤LDH会大量释放出来,上清液中LDH含量升高提示着心肌细胞损伤程度,京尼平降低高糖损伤细胞的LDH,说明对细胞具有保护作用。研究结果显示,京尼平(10 μmol/L)能有效降低H9c2心肌细胞高糖环境产生的氧化应激的产物MDA和心肌损伤标志物LDH的含量,增高细胞内抗氧化应激酶SOD的活力,降低活性氧簇ROS的产生,均证明京尼平可明显减轻高糖导致的心肌细胞氧化应激损伤。蒋有琴等[18]和Hughes等[19]研究小组的京尼平抗氧化作用与本研究结果相一致。
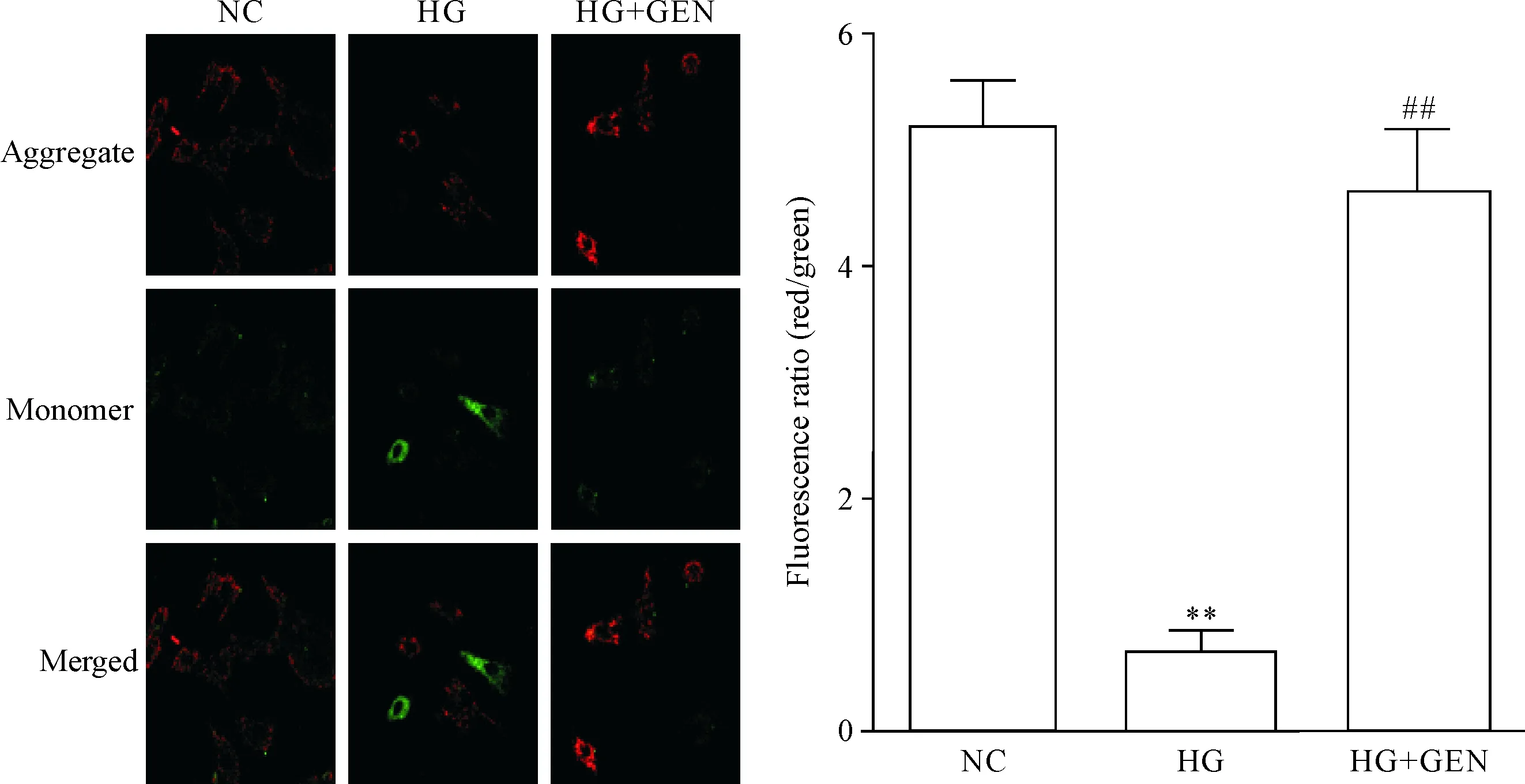
Figure 4.The effect of genipin (GEN) on mitochondrial membrane potential in high glucose (HG)-induced H9c2 cardiomyocytes (×400). Mean±SD.n=6.**P<0.01vsNC group;##P<0.01vsHG group.
图4京尼平对高糖诱导H9c2心肌细胞线粒体膜电位的影响
线粒体是细胞能量代谢的中心,心肌细胞要消耗大量的氧,主要通过线粒体氧化呼吸链,心肌细胞高糖损伤会引起线粒体内产生大量活性氧簇[20],ROS的大量积累就会破坏心肌细胞线粒体内抗氧化应激系统的平衡,线粒体内抗氧化应激的酶系统防御较弱,导致线粒体氧化损伤,加速线粒体通透性转换孔的开放。分布在线粒体基质内的主要抗氧化酶Mn-SOD是一种金属酶,对于线粒体的抗氧化应激系统的平衡具有重要保护作用,成为检测线粒体内抗氧化酶系统的重要标志性酶,能有效清除生物体内多余的氧自由基,对活性氧簇诱导的细胞凋亡具有一定的拮抗作用。本实验给予高糖处理的细胞给予京尼平处理,可显著抑制ROS的产生,减少细胞由高糖氧化损伤引起的线粒体膜电位去极化,升高线粒体内抗氧化应激蛋白酶Mn-SOD的含量,均提示京尼平具有降低细胞内氧化应激产物生成的作用,并能维持线粒体内抗氧化应激系统酶的平衡。线粒体膜电位的下降是细胞凋亡早期的一个标志性事件,通过JC-1荧光探针从红色荧光到绿色荧光的转变可以很容易地检测到细胞膜电位的下降,结果显示,高糖损伤组比正常糖对照组线粒体膜电位下降。京尼平作用于高浓度葡萄糖时与高糖损伤组比较,JC-1 探针绿色荧光明显减弱,红色荧光强度增加,线粒体膜电位升高,说明京尼平能抑制高糖导致的心肌细胞凋亡。ELISA法中双抗体夹心酶法,可以利用钙-镁依赖性核酸酶切割凋亡细胞的核小体,产生180 bp~200 bp或其倍数的核小体片段,应用小鼠抗DNA和抗组蛋白的单克隆抗体,与核小体片段形成夹心结构,特异性检测细胞溶解物中的核小体片段的聚集程度,结果发现京尼平降低了高糖环境下核小体片段的聚集程度,进一步说明京尼平能有效抑制高糖诱导的心肌细胞凋亡。
高糖环境导致心肌细胞氧化应激损伤,线粒体功能发生一系列障碍,是细胞凋亡和坏死的重要标志性事件[21],Bax作为Bcl-2家族重要的促凋亡蛋白,可作为线粒体膜上离子通道的重要组成部分,Bax增强会导致线粒体膜电位去极化,损伤的线粒体中的Cyt C大量释放,激活细胞凋亡过程中发挥关键核心作用的促凋亡蛋白酶 caspase-3[22],引发线粒体凋亡通路活化,降解细胞DNA损伤修复酶,激活核酸内切酶,导致细胞凋亡和坏死[23-24]。本实验检测京尼平使高糖损伤细胞的线粒体通路级联反应中的促凋亡蛋白Cyt C、Bax和cleaved caspase-3的蛋白水平下降,充分证明了一定浓度的京尼平抑制高糖细胞氧化应激损伤与抑制线粒体凋亡途径有关。
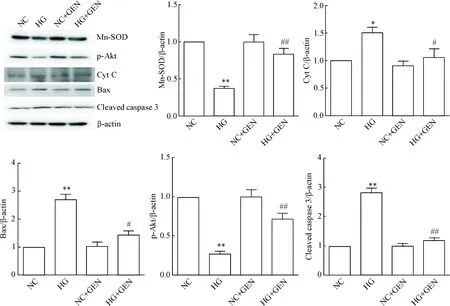
Figure 5.Western blot was used for determining the protein levels of Mn-SOD, p-Akt, Cyt C, Bax and cleaved caspase-3 in the H9c2 cardiomyocytes. Mean±SD.n=3.*P<0.05,**P<0.01vsNC group;#P<0.05,##P<0.01vsHG group.
图5Westernblot检测心肌H9c2细胞中Mn-SOD、p-Akt、CytC、Bax和cleavedcaspase-3的蛋白水平
京尼平是位于线粒体内膜上解偶联蛋白2(uncoupling protein 2,UCP2)的特异性阻断剂[25-27]。UCP2是一种质子载体,在高糖信号的刺激下,可将线粒体内膜外质子转运至线粒体内,使线粒体膜电位去极化[28]。UCP2在线粒体电子传递链的能量代谢中发挥重要作用,必将与抗氧化应激系统密切相关[29-31],我们将进一步研究抗氧化应激系统与能量代谢之间的关系。
综上所述,京尼平对于高糖损伤的心肌细胞具有抗氧化作用,其作用机制与减少氧化应激产物的释放,平衡抗氧化应激酶系统,抑制线粒体凋亡途径有关,将为新型抗氧化剂应用于防治糖尿病心肌病并发症提供理论基础。

