PTSD大鼠海马CA1区和前额叶皮层突触小泡蛋白的表达*
林 玲, 高 丽, 师瑞红
(河南医学高等专科学校生理教研室, 河南 郑州 451191)
创伤后应激障碍(posttraumatic stress disorder,PTSD)是指个体经历、目睹或遭遇到一个或多个涉及自身或他人的实际死亡、受伤,或躯体完整性受到严重威胁,所导致的个体延迟出现并持续存在的一种精神障碍,以认知功能减弱为主要特征[1-2],在临床上主要表现为病理性重视、持续性警觉性增高和回避[3]。PTSD已经成为严重威胁人类健康甚至是生命的重要疾病之一,近年来虽受到广泛关注,但其发病机制目前尚不十分清楚。有研究表明,在精神应激的过程中,多个脑区参与了对机体功能的调节,包括大脑皮质、海马(hippocampus,Hippo)、杏仁核和下丘脑等。以往有关PTSD及机制的研究主要集中在海马,但在前额叶皮层(prefrontal cortex,PFC)上的研究相对较少。本实验选择海马CA1区和PFC为共同靶点,通过行为学检测PTSD大鼠的学习记忆能力,免疫组化、Western blot和免疫荧光检测突触小泡蛋白(synaptophysin)的表达,探讨PTSD大鼠空间记忆损伤的机制。
材 料 和 方 法
1 材料
1.1实验动物 成年雄性Sprague-Dawley(SD)大鼠36只,SPF级,体质量180~220 g,购于湖南斯莱克景达实验动物有限公司,合格证号: SCXK(湘)2011-0003。动物饲养环境:通风,自然光照环境,室温维持在(22±1) ℃。
1.2主要试剂 兔抗突触小泡蛋白多克隆Ⅰ抗购自Abcam;HRP标记的羊抗兔甘油 II 抗、FITC标记的羊抗兔荧光 II 抗、Triton X-100、 BSA和DAB显色试剂盒等均购于碧云天生物技术有限公司。
1.3实验仪器 Morris水迷宫(北京医学科学院药物研究所研制);荧光显微镜和冰冻切片机(OLYMPUS);高速冷冻离心机(BECKMAN);转膜仪和电泳仪(北京六一仪器厂)。
2 方法
2.1实验动物分组 实验动物随机分为正常对照(control)组和模型(model)组,每组18只。常规分笼饲养,每笼6只,采用国家标准啮齿类动物干燥饲料喂养,充足水分供应。
2.2PTSD动物模型的制备 按照文献[4]的方法,模型组大鼠遭遇单次延长应激(single prolonged stress, SPS):禁锢2 h;强迫性游水20 min(水深40 cm、水温25 ℃);休息15 min后乙醚麻醉至意识丧失。2组动物无干扰饲养,常规摄食饮水,饲养温度为18~22 ℃。
2.3行为学测试 造模完成之后24 h行Morris水迷宫实验,分为前5 d的定位航行实验与第6天的空间搜索实验:(1)定位航行实验:历时5 d,每天1次,记录大鼠找到水下平台的时间(即逃避潜伏期),超过120 s找不到平台的,可引导其找到平台,成绩记为120 s。(2)空间搜索实验:实验第6天撤去水下平台,大鼠于固定象限面向池壁入水,记录120 s内平台所在象限的游泳时间和穿越平台的次数。
2.4免疫组化实验 水迷宫实验结束后各组取6只大鼠进行免疫组化实验。大鼠经10%水合氯醛腹腔麻醉(300 mg/kg)后,经4%多聚甲醛心脏灌注,快速取脑后固定,常规石蜡包埋,冠状切片,片厚3 μm,切片常规脱蜡,蒸馏水冲洗,PBS冲洗3次,每次5 min,用枸橼酸盐缓冲液进行微波抗原修复,于新配制的0.3% H2O2溶液中室温下孵育10 min,PBS冲洗3次,每次5 min,滴加兔抗突触小泡蛋白多克隆抗体(1∶500),4 ℃孵育过夜,PBS冲洗, DAB显色,常规脱水,透明,中性树胶封片,光学显微镜下观察,摄片。应用ImageJ图像分析软件测定阳性细胞的平均积分吸光度值。
2.5Western blot实验 各组另取1/3大鼠(6只)在行为学实验完毕之后进行Western blot实验。实验大鼠在腹腔麻醉后快速取出全脑,冰浴分离出海马,RIPA充分裂解提取蛋白,BCA蛋白定量试剂盒(Novagen)测定蛋白浓度。调节各组蛋白浓度统一为0.5 g/L,加2×SDS上样缓冲液,99 ℃变性10 min。每孔中加10 μL样品,Tris-SDS PAGE转印到硝酸纤维素膜上,用5%脱脂奶粉室温封闭1 h,加入抗突触小泡蛋白抗体4 ℃过夜。倾去 I 抗,TBST洗膜3次,每次15 min。分别加入滴加辣根过氧化酶标记的羊抗兔IgG II 抗(1∶2 000),置于摇床上摇动,室温下1 h;弃去II抗,TBST洗膜3次,每次15 min;ECL显色,凝胶成像分析系统成像,检测蛋白质印迹条带,Image J软件分析求得平均吸光度值,以目的条带与β-actin的吸光度比值表示目的蛋白的相对表达量。
2.6免疫荧光实验 各组取最后1/3大鼠进行免疫荧光实验。将各组大鼠灌注后取脑,置于4% 多聚甲醛溶液中过夜,经30%蔗糖溶液脱水后,用恒温(-20 ℃)冰冻切片机作冠状切片,厚度30 μm,隔 4片取 1片脑片,切片经0.3% Ttiton X-100通透2 h,0.01 mol/L PBS漂洗3次,每次5 min,10% BSA封闭1 h,0.01 mol/L PBS漂洗3次,每次5 min。滴加突触小泡蛋白I抗,4 ℃条件下孵育过夜; 复温后0.01 mol/L PBS漂洗3次,每次5 min。暗室加入FITC标记的羊抗兔 II 抗(1∶1 000),室温孵育2 h,0.01 mol/L PBS漂洗3次,每次5 min, DAPI染核,防淬灭的封片剂封片,荧光显微镜下观察拍片,每张切片检测海马CA1区平均阳性细胞数和积分吸光度(integral absorbance,IA; IPP 6.0软件分析)。
3 统计学处理
所有实验数据以均数±标准差(mean±SD)表示,经SPSS 24.0处理,数据分析前经正态性分布检验,两组间均数的比较采用t检验。以P<0.05为差异有统计学意义。
结 果
1 不同组别大鼠定位航行实验和空间搜索实验成绩的比较
Morris水迷宫实验结果显示,在定位航行实验中,从实验第2天开始到第5天,与对照组比较,模型组大鼠逃避潜伏期均明显延长(P<0.01)。在空间搜索实验中,与对照组比较,模型组大鼠在目标象限的停留时间均明显降低(P<0.01),穿越原平台位置的次数也明显减少(P<0.01),见表1、2。

表1 2组大鼠逃避潜伏期的比较
**P<0.01vscontrol group.
表22组大鼠目标象限停留时间和穿越原平台次数的比较
Table 2.Comparison of the target quadrant stay time and the times of crossing the platform in the 2 groups (Mean±SD.n=18)

GroupTarget quadrant stay time (s)Times of crossing the platformControl58.72±6.3512.65±1.74Model42.56±7.43∗∗8.33±1.28∗∗
**P<0.01vscontrol group.
2 免疫组化实验检测2组大鼠海马CA1区和PFC突触小泡蛋白的表达
结果显示,在海马CA1区和PFC,胞浆内呈现棕黄色颗粒为突触小泡蛋白免疫反应阳性细胞;与对照组比较,模型组大鼠海马CA1区和PFC突触小泡蛋白的表达均显著减少,积分吸光度均显著降低(P<0.05或P<0.01),见图1。
3 Western blot实验检测2组大鼠海马和PFC突触小泡蛋白的表达
结果显示,与对照组比较,模型组大鼠海马CA1区和前额叶皮层突触小泡蛋白的表达均显著减少(P<0.05或P<0.01),见图2。
4 免疫荧光实验检测2组大鼠海马和PFC突触小泡蛋白的表达
荧光显微镜下,海马CA1区和PFC的神经元胞浆内可见FITC标记的绿色荧光免疫反应阳性产物为突触小泡蛋白。对照组大鼠突触小泡蛋白阳性细胞荧光染色强,模型组大鼠突触小泡蛋白阳性细胞荧光染色浅,见图3A、B。在海马和PFC,与对照组比较,模型组大鼠突触小泡蛋白阳性细胞数均呈显著减少,积分吸光度呈显著降低(P<0.05或P<0.01),见图3C、D。
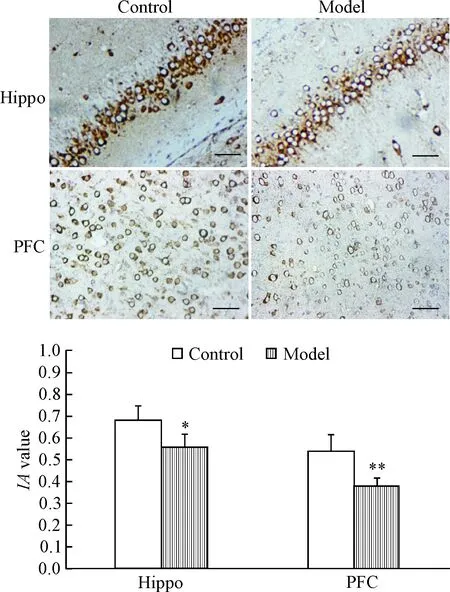
Figure 1.The expression of synaptophysin in the CA1 region of hippocampus and PFC of the rats in the 2 groups was detected by immunohistochemical staining. The scale bar=20 μm. Mean±SD.n=6.*P<0.05,**P<0.01vscontrol group.
图1免疫组化实验检测2组大鼠海马CA1区和PFC突触小泡蛋白的表达
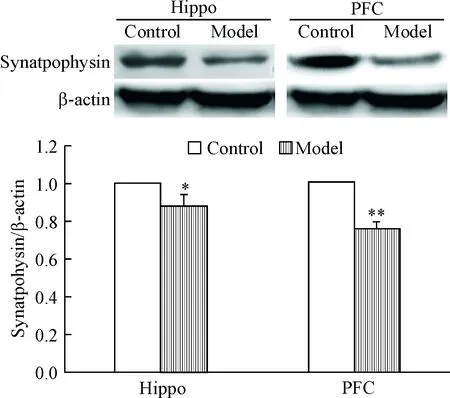
Figure 2.The expression of synaptophysin in the CA1 region of hippocampus and PFC of the rats in the 2 groups was detected by Western blot. Mean±SD.n=6.*P<0.05,**P<0.01vscontrol group.
图2Westernblot实验检测2组大鼠突触小泡蛋白在海马CA1区和前额叶皮层的表达
讨 论
正常机体能够对各种环境因素的复杂变化作出适应性反应,以适应各种应激,如果适应能力下降就会导致各种疾病。PTSD是一种典型的应激障碍性疾病,其临床表现以再度体验创伤为特征,并伴有情绪的易激惹和回避行为,是一种创伤后心理失衡状态[5-6]。
在本研究中,我们利用SPS构建PTSD大鼠模型,在Morris水迷宫实验中,模型组大鼠的逃避潜伏期较对照组明显延长,撤去水下平台之后,模型组大鼠目标象限游泳时间明显减少,穿越原平台位置的次数也明显减少,说明了PTSD大鼠的空间记忆能力明显减退,这些都符合PTSD 的临床特征,说明模型复制成功。
本课题组既往的研究表明,PTSD大鼠学习记忆能力减退与海马5-HT1A受体表达明显增加以及学习记忆相关蛋白PSD-95的表达明显减少密切相关[7]。

Figure 3.The expression of synaptophysin in CA1 region of hippocampus (A) and PFC (B) of the rats in the 2 groups was observed by immunofluorescence, and the number of the synaptophysin positive cells (C) andIAvalues of synaptophysin (D) were determined. The scale bar=20 μm. Mean±SD.n=6.*P<0.05,**P<0.01vscontrol group.
图3免疫荧光实验检测2组大鼠在海马CA1区和PFC突触小泡蛋白的表达、突触小泡蛋白阳性细胞计数和突触小泡蛋白平均积分吸光度的比较
但是有没有其他蛋白质也参与了PTSD大鼠学习记忆能力的减退呢?突触小泡蛋白是突触前膜囊泡上的一种膜蛋白,是突触囊泡中含量最为丰富的蛋白之一,它担负着神经递质的包装、储存、调节及释放。大量研究表明,突触小泡蛋白表达的增加能够增强大鼠的空间辨别性学习记忆能力[8-9]。在本实验中,通过免疫组化、Western blot和免疫荧光实验检测了PTSD大鼠海马和PFC突触小泡蛋白的表达,结果表明,PTSD大鼠均较对照组显著减少,这可能也是导致其学习记忆能力减退的原因之一。
PFC在学习记忆等认知行为中也具有非常重要的作用[10-11],但以往关于PTSD发病机制的研究在额叶皮层上相对较少。在本实验中,PTSD模型大鼠PFC突触小泡蛋白的表达较正常大鼠显著减少,这与Campos等[12]和Carvalho-Netto等[13]的研究结果是一致的。研究表明,急性创伤性应激可导致大鼠脑内凋亡蛋白caspase-3和caspase-9的表达明显增加[14-15]。这可能是创伤性应激障碍导致脑内促凋亡蛋白的表达增加,加速了神经元的凋亡,进而使学习记忆相关蛋白的表达减少,最终导致大鼠的空间认知能力减退。
也有研究表明,在海马CA1区和PFC之间有一个CA1-mPFC网络环路,此环路通过多巴胺递质系统调节应激性抑郁的认知功能障碍[16]。故可作如下推测:在PTSD的大鼠模型中,当大鼠接受创伤性刺激之后,激活脑内的5-HT递质系统,使海马神经元损伤甚至是凋亡及坏死,突触前膜突触小泡蛋白的合成及释放也减少,再通过海马与PFC之间的神经环路,进而导致PFC学习记忆相关蛋白突触小泡蛋白的表达减少,突触可塑性的功能减退,最终导致大鼠的空间记忆能力减退。但是创伤后应激所致认知行为障碍的具体机制,还有待做更加深入的研究。

