胶质瘤致病相关蛋白1对肺癌A549细胞生长及分化的影响
生秀梅,黄新祥, 王正新
1)江苏大学医学院生物化学教研室 江苏镇江 212013 2)克拉克亚特兰大大学生物科学系;克拉克亚特兰大大学癌症研究与治疗发展中心 美国亚特兰大 30314
肺癌是发病率和死亡率增长最快,对人群健康和生命威胁最大的恶性肿瘤之一;目前肺癌的治疗仍以手术为主,但术后预后差,生存期短,因此迫切需要找到新的诊疗方法或研制出新的诊疗试剂[1-2]。胶质瘤致病相关蛋白1(glioma pathogenesis-related protein 1, GLIPR1)基因是从胶质细胞瘤中克隆出来的新基因[3-4],属于富含半胱氨酸分泌蛋白CAP家族[5]。GLIPR1蛋白有一段信号肽和一段跨膜区段,被认为是一种分泌蛋白[5-6]。在前列腺癌和膀胱癌等肿瘤中,GLIPR1具有抑癌作用,受p53调节,其过表达可诱导多种前列腺肿瘤细胞的凋亡[7-9]。有报道[10]指出GLIPR1在正常肺细胞中表达较高,但在肺癌细胞中的表达较低。因此,本研究拟通过慢病毒感染使肺癌A549细胞高表达GLIPR1蛋白或GLIPR1胞外可溶性区段(GLIPR1-S),探索GLIPR1对A549细胞生长和分化的影响,以期为肺癌药物的研制提供线索。
1 材料与方法
1.1材料pCDH-FLAG由本室构建(构建所用pCDH-CMV-MCS-EF1-Puro慢病毒载体系统购自SBI公司);A549细胞、293T细胞及E.coliXL 10-gold感受态细胞由本室保存。人GLIPR1cDNA克隆 (HsCD00441029) 购自DNASU公司,肺表面活性蛋白C(SPC)抗体购自Millipore公司,anti-β-actin抗体购自Sigma公司,二抗山羊抗大鼠Alexa 595抗体购自Invitrogen公司,anti-GLIPR1抗体购自Abnova公司,细胞染色剂SYTOX GREEN购自美国Molecular Probes公司,Histogel凝胶购自Linaris公司。
1.2GLIPR1、GLIPR1-S重组慢病毒载体的构建根据GLIPR1序列(HQ447422)设计并合成上下游引物,分别在上下游引物的5’端加接EcoRⅠ和BamHⅠ酶切位点序列;为了增加蛋白的表达,在上游引物GLIPR1起始密码子AUG前添加ACC碱基[11-13]。GLIPR1、GLIPR1-S共用同一上游引物GLIPR1-F:5’-GGAATTCACCATGCGTGTCACACTT GCTACAATAG-3’ (下划线为EcoRⅠ酶切位点),下游引物GLIPR1-R:5’-CGGGATCCTGAATTGTATT AGTCCAAAAG-3’,GLIPR1-S-R:5’-CGGGATCCTTATCTGTTACGTGGATATATGGGCC -3’(下划线为BamHⅠ酶切位点)。以含有GLIPR1 cDNA克隆的质粒为模板,分别以GLIPR1-F/R及GLIPR1-F/GLIPR1-S-R为引物,通过PCR获取目的基因GLIPR1和GLIPR1-S。胶回收后和pCDH-FLAG分别经EcoRⅠ和BamHⅠ双酶切,用T4 DNA连接酶室温连接过夜,将连接产物转化至E.coliXL 10-gold,次日从含氨苄西林的LB平板上挑取6个菌落,接种于4 μL含氨苄西林的LB培养液中,37 ℃过夜培养,提取质粒。经双酶切验证及DNA测序分析最终确认,分别为pCDH-GLIPR1-FLAG和pCDH-GLIPR1-S-FLAG。
1.3重组慢病毒的包装及浓缩应用LipofectamineTM2000将pCDH-GLIPR1-FLAG和pCDH-GLIPR1-S-FLAG质粒、包装结构质粒psPAX2和包膜质粒pMD2.G按质量比4∶3∶1的比例混合,共转染对数生长期的293T细胞。转染24 h后,更换新鲜培养基10 mL,48 h后,收集细胞上清液(含慢病毒Lenti-GLIPR1、Lenti-GLIPR1-S),用0.45 μm滤膜过滤掉细胞残片,密封后4 ℃保存。分别用1、5、10、30、50、100 μL的病毒液,感染均匀平铺于6孔板的293T细胞,72 h后通过观察细胞的荧光效率测得病毒滴度为6×109PFU/mL。
1.4重组慢病毒感染细胞实验及细胞活力测定将A549细胞接种于24孔板,以含体积分数10%胎牛血清的MEM培养液培养。第2天细胞融合度达到70%~80%时,换含上述2种重组慢病毒颗粒悬液30 μL的新鲜培养基1 mL,加入终浓度为8 mg/L的Polybrene以增加感染效率。同时设立Lenti-pCDH空病毒组。转染16 h后,换含体积分数10%胎牛血清的MEM培养液培养。感染第3天转至100 mm培养皿继续培养3 d,计数细胞。
1.5感染重组慢病毒的A549细胞GLIPR1和GLIPR1-S蛋白表达的检测采用Western blot法。 收集1.4中细胞,用蛋白裂解液裂解后离心取上清,测定浓度后,以各泳道上样量10 μg进行120 g/L SDS-PAGE凝胶电泳,电转至聚偏二氟乙烯膜上,用含30 g/L脱脂奶粉的TBST封闭1 h后,分别用多克隆抗体anti-GLIPR1(1∶1 000稀释)、anti-β-actin(1∶5 000稀释)和对应的二抗进行免疫标记,ECL显色,全自动凝胶成像系统进行曝光。
1.6感染重组慢病毒的A549细胞的分化情况观察采用免疫细胞化学法。 将Lenti-GLIPR1或Lenti-pCDH空病毒感染的A549细胞接种于细胞计数板,以含体积分数10%胎牛血清的MEM培养液培养过夜。第2天,吸去培养液,PBS洗细胞后,用冷甲醛(-20 ℃)固定10 min, 体积分数4%鱼胶(PBS配制)阻断非特异性染色,20 min后移去鱼胶,加SPC抗体(1∶50稀释)、anti-GLIPR1抗体(1∶100稀释,鱼胶配制)孵育过夜,加山羊抗大鼠Alexa 595抗体(1∶500稀释) ,室温孵育1 h, PBS洗细胞后,用SYTOX GREEN室温对比染色10 min,用Histogel封片,荧光共聚焦显微镜下观察。
2 结果
2.1pCDH-GLIPR1及pCDH-GLIPR1-S的鉴定通过PCR扩增分别获得全长813 bp的GLIPR1片段和711 bp的GLIPR1-S片段。将目的片段插入慢病毒载体pCDH构建成pCDH-GLIPR1和pCDH-GLIPR1-S,转化E.coliXL 10-gold,挑取单克隆,提取质粒,用限制性内切酶EcoRⅠ和BamHⅠ双酶切后,电泳可见800 bp和700 bp左右的片段,DNA测序亦完全正确,表明pCDH-GLIPR1和 pCDH-GLIPR1-S构建成功,见图1。

1:GLIPR1-S扩增产物;2:GLIPR1扩增产物;M:Marker;3:pCDH-GLIPR1-S酶切结果;4:pCDH-GLIPR1酶切结果
图1重组慢病毒载体的构建(左)和酶切鉴定(右)
2.2感染重组慢病毒的A549细胞GLIPR1和GLIPR1-S蛋白的表达Western blot结果显示A549细胞经Lenti-GLIPR1和Lenti-GLIPR1-S感染后,均可表达相应蛋白(图2)。
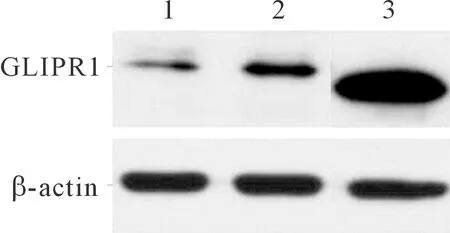
1:空病毒组;2:感染Lenti-GLIPR1组;3:感染Lenti-GLIPR1-S组
图2Westernblot检测结果
2.3感染重组慢病毒的A549细胞的生长分化情况与空病毒组[(63.872±6.376)×105]相比,感染Lenti-GLIPR1、Lenti-GLIPR1-S第6天的A549细胞数分别为(7.167±1.750)×105和(2.167±1.102)×105,说明感染后细胞生长受抑(F=235.500,P<0.001)。与空病毒组相比,感染Lenti-GLIPR1 的A549细胞明显变大(图3A、B)。共聚焦显微镜下可见GLIPR1主要定位于A549细胞的细胞质(绿色为核,红色为GLIPR1, 图3C),细胞中SPC增多(图4,绿色为核,红色为SPC),说明GLIPR1表达可促进A549细胞向肺上皮细胞分化。
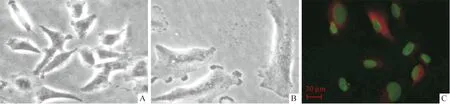
A:空病毒组(×400);B:感染Lenti-GLIPR1组(×400);C:GLIPR1在感染Lenti-GLIPR1的A549细胞中的分布(免疫荧光染色)
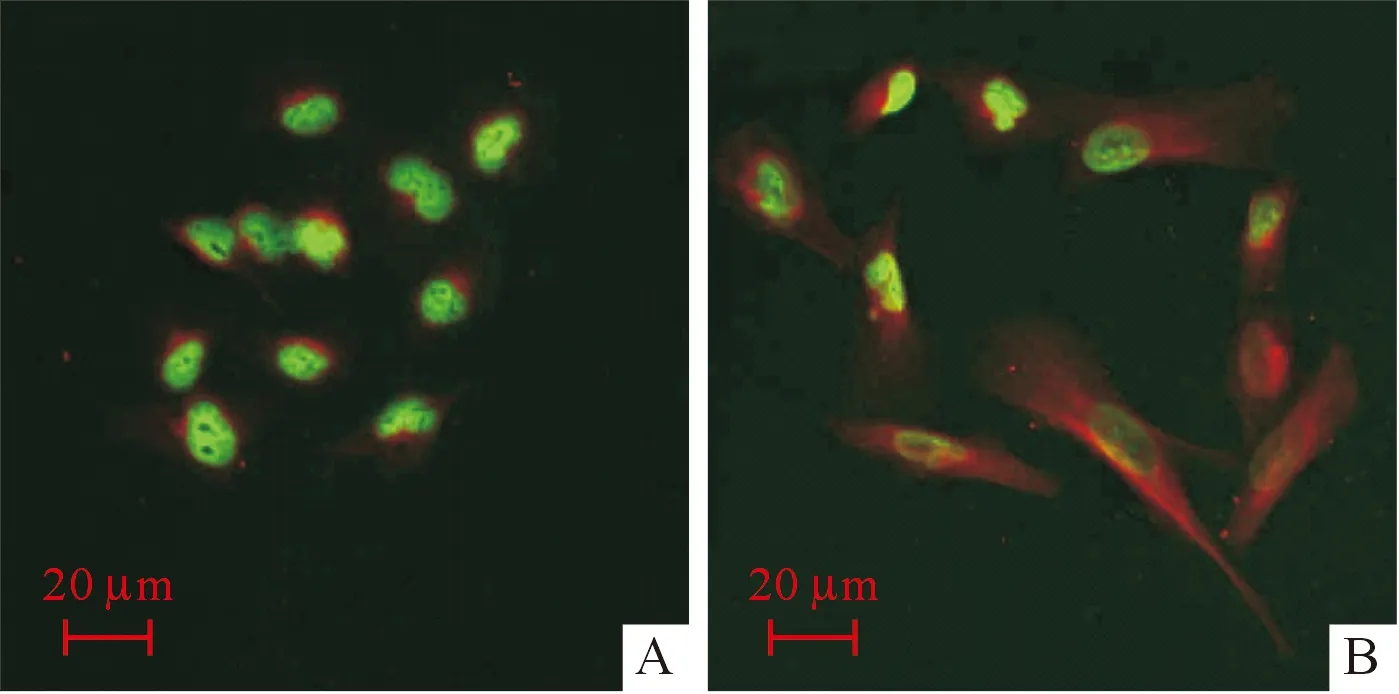
A:空病毒组;B:感染Lenti-GLIPR1组
3 讨论
GLIPR1蛋白又称RTVP-1,是富含半胱氨酸分泌蛋白CAP家族的一员[5]。GLIPR1蛋白包含一段信号肽和一段跨膜区段。氨基末端的前21个氨基酸残基组成了GLIPR1前体蛋白的信号肽,而羧基末端的氨基酸残基则构成了跨膜区段[5,14]。GLIPR1早期作为原癌基因发现于人神经胶质瘤中[3],其高表达可促进神经胶质瘤的增殖、存活、侵袭及转移[15]。但是,在前列腺癌细胞中,GLIPR1表达较低,为p53调节基因,GLIPR1的高表达可产生活性氧,从而导致多种前列腺肿瘤细胞的凋亡[7-9]。将腺病毒载体介导的GLIPR1基因直接注射于鼠前列腺癌组织可抑制肿瘤组织的生长[16]。亦有用腺病毒载体介导的GLIPR1基因疫苗治疗鼠前列腺肿瘤的研究[17]。为了检测可溶性GLIPR1区段是否具备GLIPR1的抑癌活性,本研究同时构建了重组慢病毒Lenti-GLIPR1-S(GLIPR1去除跨膜区段),其蛋白包括GLIPR1蛋白的前1~232个氨基酸残基。结果显示,感染Lenti-GLIPR1和Lenti-GLIPR1-S的A549细胞中GLIPR1蛋白的表达均升高,而A549细胞的生长受抑;进一步研究发现,GLIPR1高表达可使A549细胞变大,促进细胞中SPC的表达,提示A549细胞向肺上皮细胞分化。推测感染Lenti-GLIPR1和Lenti-GLIPR1-S均可促进A549细胞向肺上皮细胞分化,抑制A549细胞的生长。后续研究可着重于使用可溶性GLIPR1蛋白进行临床药物研制。
——一道江苏高考题的奥秘解读和拓展

