二氧化锰包覆的聚乳酸羟基乙酸共聚物载血卟啉单甲醚纳米粒的药动学检测和抑瘤效果
贾 欣,郝永伟,张超锋,侯 琳,高珊珊,杜 娟
郑州大学药学院 郑州 450001
血卟啉单甲醚(hematoporphyrin monomethyl ether,HMME)是我国独立研制的第二代半合成光敏剂,已在临床上试用于治疗鲜红斑痣和视网膜黄斑变性等疾病[1-3]。研究[4]表明,其用于肿瘤的光动力治疗效果显著,但因其水溶性差,临床应用受到限制。有研究[5]报道,将药物包载于纳米载体中,可利用实体瘤的高渗透性和滞留效应(enhanced permeability and retention effect,EPR效应)将药物被动靶向到肿瘤组织中,并延长药物血液循环时间。聚乳酸羟基乙酸共聚物(polylactide-co-glycolide,PLGA)生物相容性好,被美国FDA批准作为药用辅料,也被用于药物或者光敏剂递送,以期实现靶向、缓释等目的[6-7]。本研究将HMME负载于PLGA纳米粒中,并在其表面覆盖二氧化锰(MnO2)层,制备PLGA/HMME@MnO2系统,然后采用高效液相色谱法考察该制剂在大鼠体内的药动学参数;并以荷S180腹水瘤小鼠为模型,研究其对肿瘤的抑制效果。
1 材料与方法
1.1主要试剂和仪器PLGA(济南岱罡生物科技有限公司),HMME(上海先辉医药科技有限公司),聚乙烯醇(PVA,聚合度1 788±50,成都市科龙化工试剂厂),2-(N-吗啡啉) 乙磺酸(MES,国药集团化学试剂有限公司),高锰酸钾(洛阳市化学试剂厂),PLGA/HMME和PLGA/HMME@MnO2为自制。S180腹水瘤细胞(中科院上海生命科学研究院细胞资源中心),雌性SPF级昆明小鼠和SD大鼠(河南省实验动物中心)。Agilent1200 series HPLC色谱系统(美国Agilent公司)。
1.2血浆中药物浓度的测定方法
1.2.1 色谱条件 色谱柱: Inertex C18 柱, 250 mm×4.6 mm, 5 μm;流动相:0.2 g/L 醋酸钠(用冰醋酸调pH至5.0)∶四氢呋喃=60∶40(体积比);流速:1.0 mL/min;检测器:荧光检测器;激发波长:395 nm;发射波长:613 nm;柱温:40 ℃;进样量:20 μL。
1.2.2 血浆样品处理 取100 μL大鼠血浆样品, 加入3 mL乙腈-甲醇(V乙腈∶V甲醇=3∶1)混合液,涡旋振荡3 min, 12 000 r/min离心10 min,将上清液转移至5 mL EP管中,室温条件下通氮气挥干;将EP管底部的残渣用100 μL乙腈复溶,超声30 min,12 000 r/min离心15 min;取上清液,采用 “1.2.1”的条件,应用HPLC法测定血浆中的药物浓度。
1.2.3 HMME含量测定方法的专属性考察及标准曲线的建立 将空白血浆、生物样品和模拟生物样品分别按照“1.2.1”和“1.2.2”方法进行分析检测,考察HMME含量测定方法的专属性。其中,生物样品为注射HMME的SD大鼠血浆,而模拟生物样品为加入适量HMME的空白SD大鼠血浆。称取适量的HMME原料药,用适量乙腈溶解后转移至容量瓶中进行定容,配制成1 000 mg/L的HMME 贮备液。再把该贮备液依次稀释配制成100.0、75.0、50.0、25.0、12.5、5.0、1.0和0.5 mg/L的系列溶液。取血浆样品100 μL,分别加入上述系列溶液,按照 “1.2.1”、“1.2.2” 方法进行检测。以HMME质量浓度为横坐标,峰面积为纵坐标,建立血浆模拟生物样品的标准曲线。
1.3大鼠体内药物动力学研究方法将体重约200 g的SD大鼠随机分为HMME组、PLGA/HMME组和PLGA/HMME@MnO2组(每组3只),给药前的12 h内禁食,充足饮水。采取经尾静脉注射给药的方式,各组中HMME的给药剂量为5.0 mg/kg。分别在给药10、30 min,1、2、4、6和8 h后从眼底静脉丛取血,血样置于1.5 mL经肝素钠溶液润洗的离心管中,5 000 r/min 离心10 min,取上清液,按照1.2.2的方法应用HPLC检测HMME质量浓度,建立血药浓度-时间曲线。鉴于非房室模型解决了不能用相同房室模型拟合全部实验数据的问题,利用PK solver V 2.0软件的 “药动学非房室模型分析-静注给药”模块计算各制剂的药物动力学参数。
1.4体内抗肿瘤作用研究
1.4.1 肿瘤模型的建立 复苏冻存的S180腹水瘤细胞,腹腔注射到SPF级昆明小鼠体内,饲养约一周后,小鼠腹部可触及明显的积水样肿大,即为S180腹水瘤小鼠。从S180腹水瘤小鼠腹部抽取腹水,用生理盐水稀释,每只小鼠腋窝接种S180细胞约1×107个。
1.4.2 实验方案及治疗效果检测 SPF级昆明小鼠肿瘤接种成功后,挑选肿瘤体积为100~150 mm3的小鼠分组(每组6只),开展药效学实验。动物分组如下:生理盐水(A组)、生理盐水+激光组(B组)、HMME+激光组(C组)、 PLGA/HMME+激光组(D组)、 PLGA@MnO2(E组)、 PLGA/HMME@MnO2+激光组 (F组),其中HMME给药剂量为3.0 mg/kg。给药方式为尾静脉注射给药,在第1、3、5、7和9天各给药一次。给药前测定实验动物体重并记录,使用电子游标卡尺测量肿瘤的长径(a)和短径(b),按照0.5×a×b2计算肿瘤体积。相对肿瘤体积为V/V0(V为实验点测量的肿瘤体积,V0为开始给药时的肿瘤初始体积)。给药4 h后在肿瘤部位施加532 nm激光进行均匀照射(1.5 W/cm2,1.5 min)。通过相对肿瘤体积变化及体重变化分析治疗效果及制剂生物相容性。
1.4.3 肿瘤组织病理变化 药效学实验结束后,按照国际规程处死小鼠,解剖取出肿瘤组织,使用体积分数10%中性福尔马林固定,进行石蜡包埋、切片、脱蜡、HE染色等操作。在显微镜下观察肿瘤样本的病理学变化并拍照。
1.5统计学处理采用GraphPad Prism 5.0进行分析,应用单因素方差分析比较非房室模型药物动力学参数的差异,应用重复测量数据的方差分析比较各组小鼠相对肿瘤体积和小鼠体重的差异,检验水准α=0.05。
2 结果
2.1HMME含量测定方法专属性考察见图1。采用HPLC法测定血浆中HMME的质量浓度,HMME的保留时间约6.1 min。如图1所示,所建立的分析方法专属性符合要求,血浆内源性物质出峰时间较短,不影响HMME含量的测定。
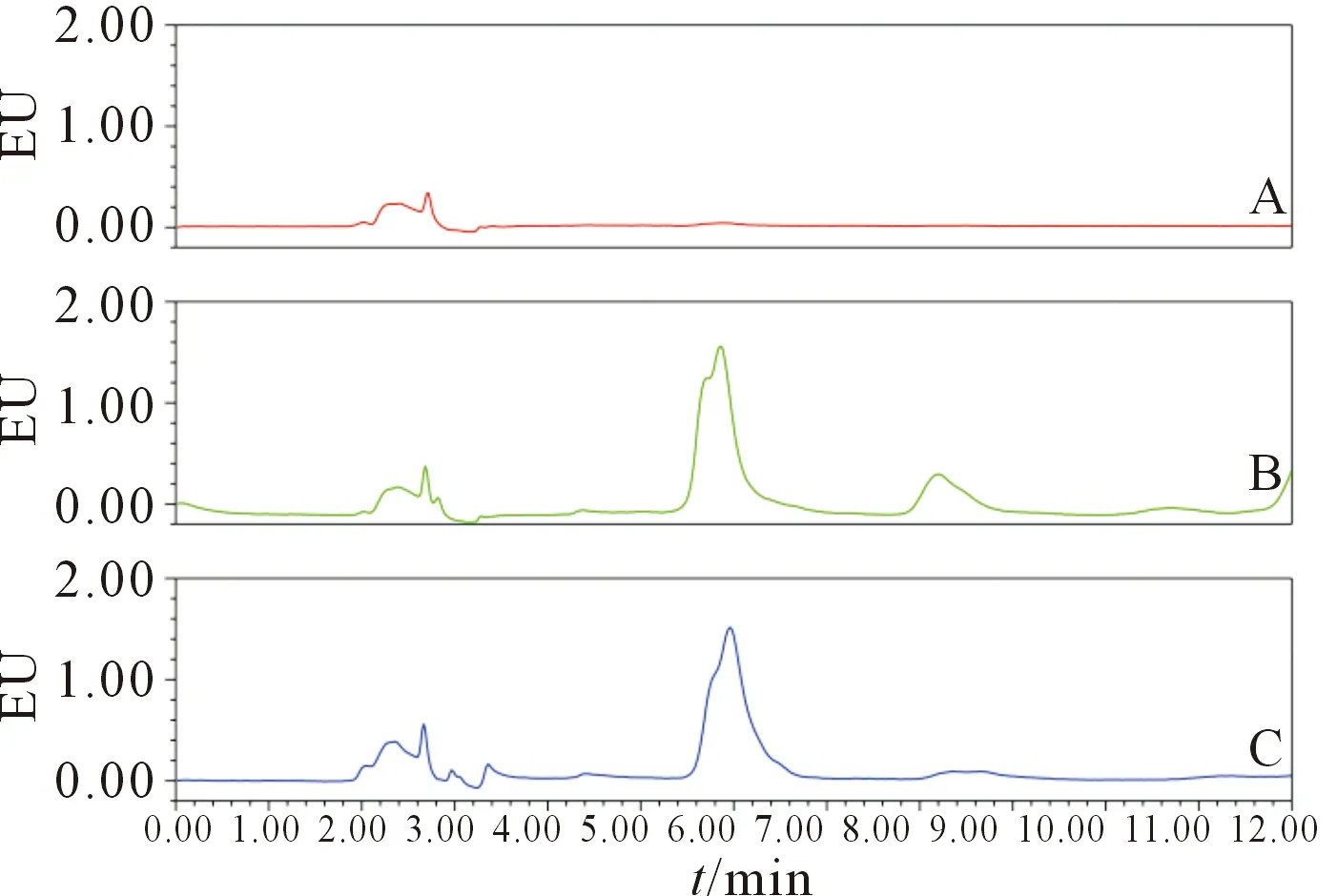
A:空白血浆样品;B :生物样品;C :模拟生物样品
HMME质量浓度(x)和其相应的峰面积(y)之间呈线性相关,所建立的标准曲线线性关系良好,y=7.812×106x+746 417,R2=0.999,定量范围为0.065~25.0 mg/L。在标准曲线范围内,方法的批内、批间精密度RSD均小于3%,方法回收率为96.42%~102.44%,提取回收率为85.17%~94.80%,符合生物样品分析要求。
2.2药时曲线及药动学参数见表1。由表1可知,与HMME相比,PLGA/HMME和PLGA/HMME@MnO2均延长了药物在血液中的循环时间,半衰期(t1/2)分别为HMME的2.71和9.32倍;AUC显著增加。说明PLGA/HMME@MnO2具有明显的长循环特性,有利于HMME在肿瘤部位蓄积。
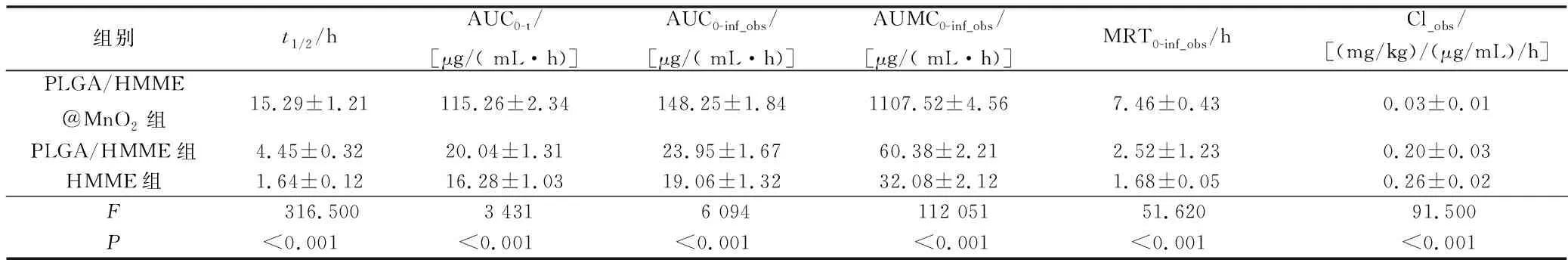
表1 非房室模型药物动力学参数(n=3)
AUC:药时曲线下面积;AUMC:统计矩药时曲线下面积;MRT:平均滞留时间;Cl:清除率;Vss:表观分布容积
2.3体内药效学实验
2.3.1 实验动物体重和肿瘤体积变化 见表2、3。由表2可知,随着时间的延长,A组、B组和E组小鼠的肿瘤体积均不断增加。相比之下,治疗结束时,C组、D组 和F组小鼠的相对肿瘤体积明显下降。其中,F组相对肿瘤体积最小。由表3可知,各组小鼠体重随着饲养时间延长,体重稳步增长。相比之下,各组动物体重有一定差异,说明各个治疗组小鼠的体重受治疗的影响,进而证明了不同治疗方式的作用有所不同。
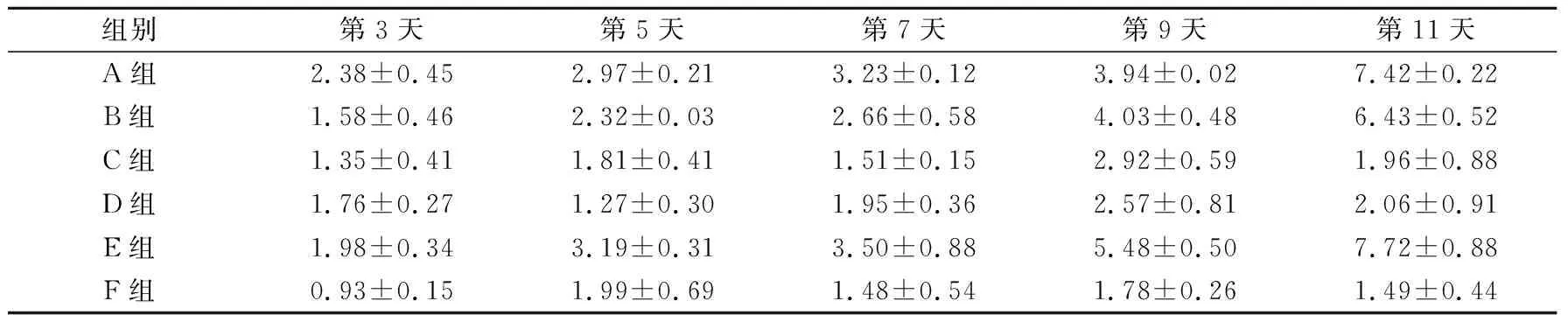
表2 各组小鼠相对肿瘤体积变化(n=6)
F组间=89.690,P<0.001;F时间=86.740,P<0.001;F交互=13.670,P<0.001

表3 各组小鼠体重变化(n=6)
F组间=5.523,P=0.002;F时间=26.840,P<0.001;F交互=0.205,P>0.999
2.3.2 肿瘤组织HE染色 见图2。与生理盐水组相比,生理盐水+激光组和PLGA@MnO2组肿瘤组织无明显变化,呈现细胞生长旺盛、排列紧密等恶性肿瘤特点。HMME+激光组、PLGA/HMME+激光组和PLGA/HMME@MnO2+激光组肿瘤组织呈现明显的肿瘤细胞坏死、细胞核裂解和细胞间隙增大等特征。

A~F:分别为A、B、C、D、E、F组;标尺长度:50 μm
3 讨论
该研究中,作者用具有缓释作用的PLGA材料包载HMME,并在表面包覆MnO2纳米层,以期延长药物在体内的循环时间,进而实现减少给药次数、提高疗效的目的。首先,作者建立了HMME的体内分析方法,结果表明,该方法特异性好、灵敏度高,是体内检测HMME质量浓度的合适方法。t1/2、AUC等药物动力学参数表明,与HMME相比,PLGA/HMME@MnO2显著延缓了药物的消除速度,延长了药物循环时间,这些体内过程的改善一方面与所使用的缓释材料PLGA有关,另外一个方面可能与MnO2的包覆以及载体系统在体内滞留时间长有关。相比于传统的PLGA纳米粒,MnO2纳米层的引入不但有助于提高药物稳定性,而且也有助于改变纳米粒表面粗糙度。
相对肿瘤体积、肿瘤HE染色表明,PLGA/HMME@MnO2具有较好的抗肿瘤效果,这是由于该纳米材料可通过EPR效应被动靶向渗透进入肿瘤组织。更多的HMME被递送进入肿瘤,为532 nm激光照射肿瘤产生活性氧奠定基础。在532 nm激光照射下,HMME产生活性氧损伤肿瘤细胞,是其抗肿瘤作用的主要机制。还原型谷胱甘肽是细胞内的一种内源性抗氧化剂,可以和细胞内的活性氧等自由基反应以保护细胞生物膜以及重要的细胞器。研究[8]表明,相对于正常组织,肿瘤组织内谷胱甘肽浓度偏高,高达2~10 mmol/L。MnO2包覆的纳米粒进入肿瘤细胞后,在高水平还原型谷胱甘肽和H2O2刺激下,MnO2不但和还原型谷胱甘肽反应,降低还原性谷胱甘肽浓度,使得活性氧的耗竭减少;还可以催化H2O2生成氧气,使得氧气供给增加,施加532 nm激光后,可使激发态的HMME能有效地把能量传递给氧气分子,生成更多活性氧,进而对肿瘤细胞生长产生强有力的抑制作用[9-10]。
综上所述,PLGA/HMME@MnO2作为一种有潜力的肿瘤靶向药物传递系统,能够实现体内长循环,可高效靶向于肿瘤,为肿瘤的增强光动力治疗开拓了新的途径。

