选择性胆管造影在诊治复杂肝内胆管结石中的临床应用*
史力军,刘飞,杨玉龙,马跃峰,李婧伊,林美举,张洪威,张诚,祁春春
(大连大学附属中山医院 胆道微创外科,辽宁 大连 116001)
肝内胆管结石是一种难治性疾病,具有病情复杂、病变范围广、术后结石残留率高、并发症发生率高以及复发率高等特点,是肝胆外科治疗的难点之一[1]。随着内镜治疗技术的发展,胆道术后结石及肝内胆管结石的治疗方式,已逐渐由一次性肝脏切除等转变为分阶段的微创内镜下取石治疗。目前,肝胆管结石经T管窦道纤维胆道镜取石已广泛开展。胆管造影是胆道术后的常规检查方法,当结石合并胆管狭窄时,狭窄及变形的胆管使得术后行胆道镜很难发现结石[2]。此时,T管造影结果阴性,而超声仅能确定结石存在,无法有效定位。李立祥等[3]指出,行胆总管切开取石和T管引流术后的肝内外胆管残余结石患者,高达33.33%(40/120)行常规T管造影肝内胆管未发现肝内胆管结石,经肝胆B超或CT检查证实肝内胆管存在残余结石。基于上述情况,我中心采用纤维胆道镜引导下对可疑胆管造影,证实结石存在后再行狭窄胆管扩张,最后完成取石治疗。此方法既提高诊断率又改善了肝内结石的治疗效果,在复杂肝内胆管结石及合并狭窄患者的治疗中意义重大。现报道如下:
1 资料与方法
1.1 一般资料
2010年8月-2017年7月我中心收治的复杂肝内结石术后T管造影及胆道镜未发现结石的患者96例。其中,男52例,女44例,年龄35~56岁,平均(47.5±5.2)岁。根据术中胆道造影结果,将88例肝内胆管狭窄伴结石者分为A组;8列肝内胆管狭窄不伴结石者分为B组。以上临床资料均通过电子病历及相关纸质报告和记录获得。所有患者术前均签署选择性胆管造影知情同意书。
1.2 纳入及排除标准
纳入标准:肝内胆管结石术后并常规行T管引流;经T管造影检查阴性;入院行肝胆胰脾CT发现肝内胆管结石或狭窄;术前均完善腹部彩超及CT检查。排除标准:肝内胆管结石未行手术治疗;常规T管造影检查阳性;失访者。
1.3 器械设备
日本Olympus公司CHFP20/XP20纤维胆道镜和CYF-AV2电子胆道镜;美国Cook公司取石网篮;美国Boston公司斑马导丝(Boston Scientific,0.035inch);德国ERBE公司VIO200S高频发生器(凝切混合电流,切40 W,凝40 W);SIEMENS MULTISTAR数字多功能X线机;造影导管(Boston Scientific,5Fr);德国OptiMed公司球囊扩张导管(球囊直径6~12 mm,长度4 cm,压力8~18 atm);德国Endo-Flex公司针状括约肌切开刀等。
1.4 治疗方法
1.4.1 胆道镜检查及造影 根据术前影像学检查所确定的结石部位,胆道镜头端装上吸附器,经T管瘘道进入肝内胆管,对于“彗星征”和狭窄胆管,使用斑马导丝超选入该支胆管后,注入造影剂行胆道造影,了解胆管狭窄程度及狭窄远端胆管结石分布等情况。胆道镜下导丝超选胆管见图1,内镜逆行胰胆管造影(endoscopic retrograde cholangio pancreatography,ERCP)下导丝超选胆管见图2。

图1 胆道镜下导丝超选胆管Fig.1 Guided wire selection of bile duct under choledochoscope

图2 ERCP下导丝超选胆管Fig.2 Guided wire selection of bile duct under endoscopic retrograde cholangiopancreatography
1.4.2 胆道镜下球囊扩张术 造影发现远端胆管扩张或者呈角畸形并可见结石伪影时,黄斑马导丝进入肝内胆管,根据狭窄胆管及远端正常胆管的直径,选择合适的扩张球囊,确定狭窄位置后在导丝引导下,植入胆道扩张球囊并逐级加压至最大压力,维持5 min。见图3。
1.4.3 胆道镜取石 Cook网篮进入胆管内套取结石,较小结石通过吸附器吸出,过大结石使用等离子击碎后再取出(图4)。对于仅发现狭窄胆管无结石病例不进行任何诊治。对于巨大结石、嵌顿结石或者铸型结石病例停止治疗,术后行等离子碎石等二期治疗。
1.5 随访
每隔3~6个月复查腹部超声和肝功能,当患者出现胆管炎症状或超声显示复发结石时,进行磁共振胰胆管造影(magnetic resonance cholangiopancreatography,MRCP)及CT检查。明确肝内胆管结石或狭窄复发者,采取经皮经肝胆管穿刺术及经皮经肝胆道镜取出结石并解除狭窄。

图3 胆道镜下球囊扩张术Fig.3 Balloon dilatation under choledochoscope

图4 胆道镜下胆管扩张取石Fig.4 Biliary dilatation and stone removal under choledochoscope
1.6 统计学方法
采用SPSS 21.0统计软件处理数据,计量资料以均数±标准差(±s)表示。肝内胆管狭窄位置分布和并发症相关数据采用χ2检验进行分析,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结果
2.1 两组胆管狭窄位置分布比较
96例胆道镜下均发现不同程度的胆管狭窄,其中左外支发生率最高为30.2%(29/96),其余依次为左内支28.1%(27/96)、右后支24.0%(23/96)和右前支17.7%(17/96)。A组和B组肝内狭窄胆管位置分布比较,差异无统计学意义(χ2=0.49,P=0.921)。见表1。
2.2 两组并发症发生率比较
A组患者中,86例直接采用胆管球囊扩张、Cook网篮取石和等离子碎石取石等方法,结石全部取净,操作时间为(58.4±11.5)min,2例由于结石巨大并嵌顿无法取出,术后行等离子碎石等二期治疗。B组患者均直接行胆道镜下高频电切术,电切操作时间(5.8±1.5)min。A组操作过程中,出血发生率6.8%(6/88),术后胆管炎发生率8.0%(7/88),术后迟发性胆道出血发生率3.4%(3/88)。B组操作过程中,出血发生率25.0%(2/8),术后胆管炎发生率25.0%(2/8),术后迟发性胆道出血发生率12.5%(1/8)。上述并发症均给予针状刀高频电凝等对症支持治疗,无胆瘘及死亡病例。A组和B组术中出血、术后胆管炎和术后迟发性出血的发生率比较,差异均无统计学意义(P>0.05)。见表 2。
2.3 术后随访和后续治疗
术后随访6~24个月,肝内胆管结石复发15例,采取经皮经肝胆管穿刺引流及经皮经肝胆道镜治疗,术中发现17处胆管狭窄。
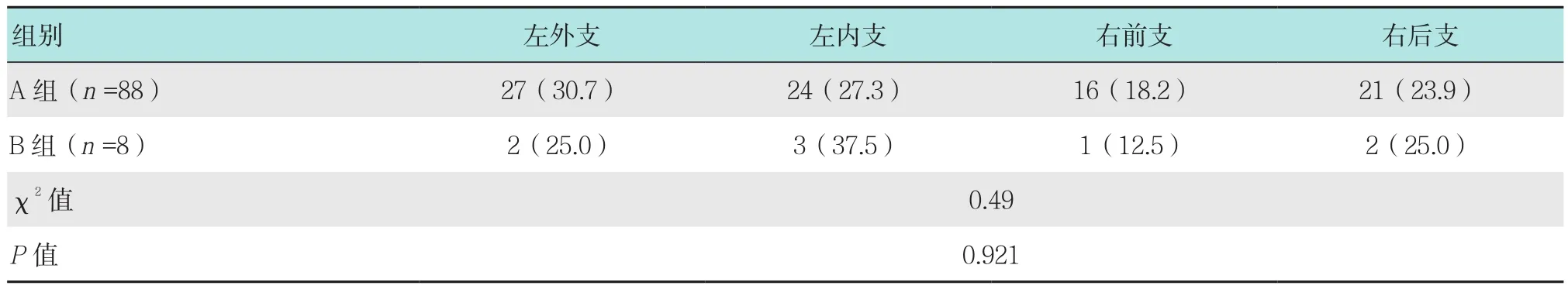
表1 两组肝内狭窄胆管的位置分布比较 例(%)Table 1 Comparison of distribution of intrahepatic stricture bile duct between the two groups n(%)

表2 两组术中和术后并发症发生率比较 例(%)Table 2 Comparison of the incidence of intraoperative and postoperative complications between the two groups n(%)
3 讨论
肝内胆管结石是我国一种多发病和常见病,虽然报道指出,此病发生率有所下降[4-5],但由于我国人口基数大,患者数量仍然众多。目前,该疾病的发病机制仍不明确。相关研究认为,该病与寄生虫感染、细菌感染以及胆汁滞留等因素有关[6]。因肝内胆管结石和狭窄处理困难,胆肠吻合术和肝叶、肝段的切除成为肝内胆管结石合并狭窄的理想治疗方法[7]。总体上治疗相对复杂且术后结石复发率较高,约为60.0%~70.0%,影响着无数患者的生命和健康[8]。随着纤维胆道镜技术的发展,上述疾病的治疗方式逐渐转变为微创和分阶段经T管瘘道纤维胆道镜取石治疗。应用纤维胆道镜不仅能直视肝内胆管,发现结石和胆管狭窄,还能结合球囊扩张、液电碎石和网篮取石等治疗措施,为处理术后肝内胆管结石和狭窄提供了有效手段[9]。胆管造影和胆道镜可准确显示病变位置和程度,超细胆道直径为3 mm,可直接进入Ⅳ级以上的肝内胆管,具有更高的操作空间及手术的准确性,诊治更为精确[10]。
由于单纯运用胆道镜取石,术中存在一些“看不见的角落”,导致部分患者发生取石不净。临床中形成取石盲区的原因主要有以下3种[11]:一是T管放置不恰当,造成瘘道与胆管角度过小或者瘘道屈曲,胆道镜进入胆管困难,甚至无法进入胆管,即医源性取石盲区;二是因目标胆管较细,胆道镜无法进入,此情况称之为器械性取石盲区;三是胆管与主胆管成角、解剖变异致胆道镜无法进入,既所谓的生理性取石盲区。笔者在取石过程中发现,肝内胆管结石多合并胆管狭窄,此类情况可造成胆道镜无法进入远端胆管,造成取石困难甚至无法发现结石,部分患者甚至不能发现胆管开口,这种情况亦属于生理性取石盲区。笔者曾遇到1例,在取石收尾阶段时,行4次胆道镜仍未发现其肝右后叶胆管口及结石。笔者认为,通过胆道镜结合CT、超声和胆道造影等技术进行3D定位,可明确胆道、结石与胆道镜三者的关系,解开“胆道镜取石盲区”。郭跃华等[12]的回顾性研究中,应用胆道镜经T管窦道造影治疗术后肝内胆管结石并狭窄697例,肝内胆管结石取净率为96.4%(672/697),本组研究结石取净率为97.7%(86/88),以上数据表明胆道镜下选择性胆管造影技术能确实、高效地取净肝内胆管结石。
选择性胆管造影过程中,压力较低时肝内胆管树无法充分显影,加压后,由于胆道下段通畅致肝外胆道显影,而造影剂仍未进入肝内胆管。若结石嵌顿于某一支胆管时,给予加压造影亦无法使胆管显影。因此,借助斑马导丝,镜下直接将导丝插入可疑胆管,辅助造影更为便利,在狭窄胆管的“门口”直接进行造影亦可避免盲目造影,同时可直接反映该胆管远端是否扩张或者存在结石,造影时将胆道镜逐渐退至肝门部,使肝内胆管树显影更加完整、全面。选择性胆管造影能够发现常规T管造影所未发现之结石,笔者认为,这很大程度上与常规T管造影时造影剂无法进入狭窄胆管有关。为提高取石率,笔者认为,应注意以下几点:①术前仔细分析T管造影、腹部CT及MRCP等影像学检查结果,将肝内结石初步定位,T管造影缺失的胆管应提高警惕;②胆道镜应在重点部位仔细检查每一处可疑胆管,本组资料显示,狭窄胆管口径多为1或2 mm,经验不足者极易遗漏,对于有些胆管,取石网篮可直接进入见碎石渣或者套住结石者,即可确定结石部位,对于不能通过取石网篮的胆管,若发现“彗星征”多为结石所在[13];③临床中有些狭窄胆管十分隐蔽,如尾状叶和右后叶肝内胆管等。对此,可在该胆管“门口”将导丝插入,辅以ERCP造影管进行造影,此时若发现远端胆管扩张、胆管口狭窄并出现结石伪影,应将胆道扩张球囊植入狭窄胆管行扩张,随后行胆道镜直视下取石治疗。总之,为避免盲目造影,术前应对比腹部影像学检查。对于术中仍无法成功超选者,可将胆道镜由某支胆管逐渐退至肝门部胆管,并持续加压造影观察,可防止胆管的遗漏。
对于如何提高超选成功率,笔者总结临床工作经验并文献学习认为主要有以下几点:①超选的前提是胆道镜能够寻找到狭窄的胆管,这要求术者全面掌握肝内胆管的解剖结构,并拥有娴熟的胆道镜技术和立体定位思维,导丝超选胆管时勿暴力进行,以防止导丝穿破肝脏导致医源性胆瘘或者胆道出血;②正确辨认狭窄开口:“彗星征”是胆管狭窄的特殊性标志,其特征为狭窄胆管开口处见黄白色絮状飘带,肝内胆管狭窄有“彗星征”者必伴有结石,根据此定律检查肝内胆管则可避免遗漏结石[13];③对各种狭窄的特点,如:膜状狭窄、管状狭窄、绝对狭窄和相对狭窄等,要有清醒地判断,同时要重视腹部影像学检查结果,特别是腹部CT,对超选胆管纤维胆道镜寻找结石位置具有重要的指导意义[14];④正确判断残留结石的部位及胆管狭窄分支:胆道的解剖十分复杂,变异很大,且结石所在的胆管开口往往伴有狭窄,有的仅1或2 mm,选择性胆管造影时,因压力和体位等多种因素,未完全显影,尤其是尾状叶胆管开口狭小,结石不易被发现,易导致结石残留[15];⑤助手的配合亦十分重要,尤其在球囊扩张胆管过程中,在球囊内注水时,速度要缓慢,避免压力突然升高造成胆管撕裂或者球囊破裂,部分医师为了在透视下动态观察球囊扩张程度,会将造影剂直接注入球囊,在球囊扩张后,球囊压力需缓慢释放,若发现活动性出血,需立即恢复压力进行压迫止血,因为胆道压力的改变可激活凝血系统,此时,切记不可将胆道镜退出该胆管,同时注入止血药物,因为一旦将胆道镜撤出,由于出血导致术野消失,再次寻找出血胆管十分困难,应用上述方法,胆道出血多可控制;⑥根据狭窄及远端扩张的胆管选择适合的球囊,球囊过大可导致胆管撕裂、出血,过小则起不到扩张作用。
综上所述,复杂肝内胆管结石的发现和治疗是选择性胆管造影技术的优势,对于复杂肝内胆管结石,规范的选择性胆管造影技术不失为一种准确、有效的诊治方法。随着现代科学技术不断发展和胆道镜引导下选择性胆管造影技术的提高,胆道镜引导下选择性胆管造影可能成为治疗复杂肝内胆管结石的经典手术方式,值得广大胆道外科医师学习和推广。

