小动物内镜在在体成像中的应用研究*
张娜,杨西斌,屈亚威,高健翎,贾馥华,刘海峰
(1.安徽医科大学武警总医院临床学院,安徽 合肥 230032;2.中国科学院苏州生物医学工程技术研究所,江苏 苏州 215163;3.武警总医院 消化内科,北京100039)
在医学和免疫学等相关基础研究中,肠道相关疾病的动物模型作为肠道黏膜免疫系统、结肠炎和癌症发展的关键研究工具,其重要性不言而喻。临床医生可通过内镜系统对人的肠道病变(如肠道炎症或肿瘤)进行观察和监测,但由于动物体积较小,目前缺乏相关微型设备对动物肠道进行准确的在体评估。溃疡性结肠炎(ulcerative colitis,UC)是一种局限于大肠黏膜和黏膜下层的慢性复发性非特异性肠道炎症性疾病。目前,对UC模型的有效评估依赖于疾病活动指数(disease activity index,DAI)和体外组织病理学检测。DAI评分指标包括小鼠的生活状态、体重、大便的性状和便隐血情况,具有一定的主观性;病理学检测则需要处死小鼠后分离肠道组织进行离体分析。以上方法存在以下缺陷:①无法对肠道病变进行在体评估和动态观察,缺乏可重复性;②主观个体差异及鼠间差异影响结果准确性;③离体组织分析需要更多的实验小鼠数量,使研究的成本升高。此外,化学诱导结肠癌模型,如偶氮氧甲烷(azoxymethane,AOM)和1,2-二甲肼(1,2-dimethylhydrazine DMH),在结直肠癌发病机制及治疗方法的研究中得到广泛应用[1],但模型构建周期长达30周。采用致癌药物联用(如AOM/DSS,AOM/DMH),虽然缩短了诱导时间,但至少也需要10周[2]。长时间的诱导及小鼠间个体差异,很难确定每只小鼠肠道内肿瘤生长情况。目前,虽然已经有微型无创成像设备,如正电子发射断层扫描(positron emission tomography,PET)和磁共振成像(magnetic resonance imaging,MRI)[3],可以对实验动物进行在体观察,但是这些方法成本高且耗时,而且对肠道病变不能进行清晰和精确的成像。
为了寻找一种安全、经济和有效的方法,对小鼠肠道病变进行清晰成像和动态监测,本课题组自行组装小动物内镜成像系统,并且对此设备的应用进行了探索研究。
1 材料和方法
1.1 材料
Balb-c nu/nu小鼠(6~8周,体重约18~20 g),购于维通利华实验动物中心;葡聚糖硫酸钠(dextran sulfate sodiuln,DSS)(分子量 36 000 ~ 50 000),购自华美试剂公司,配置为3%水溶液;麻醉剂(5%氯胺酮+1%甲苯噻嗪)。
1.2 设备构建
依据电子内镜成像原理,利用光源、信息处理器、视频显示系统和内镜4个部分搭建小动物内镜成像系统。系统主要依赖于镜身前端装备的成像设备进行图像采集,经图像传感器将光学信号转换为电子信号,后经图像处理器对信息进行处理,再显示在监视器的屏幕上。本系统采用CMOS传感器,与CCD传感器相比,具有成本小、集成度高、耗电量较小和硬件开发成本较低等优点。光源采用LED冷光源,具有发光性能稳定、体积小、产热少和节能等优点。利用高清显示屏进行成像,以提高图像的清晰度。内镜外直径1.9 cm,镜身长度60.0 cm。以上系统均与中国科学院苏州生物医学工程技术研究所合作研发。
1.3 实验方法
1.3.1 UC模型构建 取6只小鼠,进行编号后,采用随机数字表法将其随机分为对照组和实验组。实验组自由饮用3% DSS水溶液,对照组给予蒸馏水饮用,连续饮用15 d。
1.3.2 内镜下监测 内镜操作前对成像探头进行水润滑,小鼠进行麻醉,麻醉剂使用方法为氯胺酮100 mg/kg+甲苯噻嗪10 mg/kg腹腔注射。待小鼠麻醉后,进镜操作,平均进镜深度约3 cm。根据UC内镜下严重性评分(ulcerativecolitis endoscopic index of severity,UCEIS)标准[4]进行内镜下评分,包括:血管模式(血管分布正常1分;血管结构模糊2分;血管闭塞或消失3分)、出血情况(无出血1分;可见陈旧性出血,用水冲洗后无血迹2分;可见血迹,用水冲洗后可见渗血3分;活动性出血4分)、糜烂和溃疡(黏膜正常1分;黏膜粗糙、糜烂2分;可见浅表性溃疡,表面覆白苔3分;可见溃疡,且深度较深4分)。当实验需要时,处死小鼠,取远端结肠组织,根据DIELEMAN评分标准[5]从炎症、隐窝损伤、黏膜再生情况、病变程度和范围5个方面对结肠组织进行病理学评分,并与内镜下评分进行对比。
2 结果
2.1 设备示意图
小动物内镜成像设备实物图见图1A。成像前端可见光源、相机及辅助操作通道(图1B),调节范围可达90°(图1C)。
2.2 内镜及病理学评估
内镜下动态观察小鼠肠壁黏膜变化,对照组未发现明显变化,实验组肠道黏膜动态成像结果见图2。实验开始第1天,肠道黏膜正常,内镜下可以清晰地看到血管走行和分布(图2A);饮用DSS第7天,肠道黏膜血管走行紊乱,黏膜发红,粗糙呈颗粒状,肛门处病变最明显(图2B);饮用第10天,肠壁黏膜血管走行模糊、紊乱,局部黏膜坏死,多处可见血迹(图2C);饮用至第15天,内镜下可见肠壁黏膜脱落,部分肠壁附着有脓性分泌物(图2D)。分别于第1天、第7天、第10天和第15天,从每组中随机各处死一只小鼠,分离远端结肠组织,进行病理学评分,并与内镜下评分进行对比。饮用15 d后两组组织对比图见图3,肉眼可见对照组小鼠饮用蒸馏水15 d后,离体肠管组织黏膜呈淡粉色(图3A),实验组小鼠饮用DSS 15 d后,肠管组织黏膜明显充血发红(图3B)。病理学检查结果显示:正常结肠组织黏膜上皮完整,结构清晰,上皮细胞排列整齐,腺体完整(图3C),实验组小鼠肠管组织黏膜表层糜烂,有溃疡形成,腺体多数不完整,隐窝急性炎细胞浸润,呈典型炎症改变(图3D)。依据UCEIS和DIELEMAN评分标准,分别对肠道病变进行内镜和病理学评分,结果显示:随着DSS自由饮用时间的延长,实验组小鼠肠道病变的内镜与组织病理学评分一致呈增高趋势。见图4。

图1 小动物内镜成像设备实拍图Fig.1 Small animal endoscopic imaging equipment actual diagram
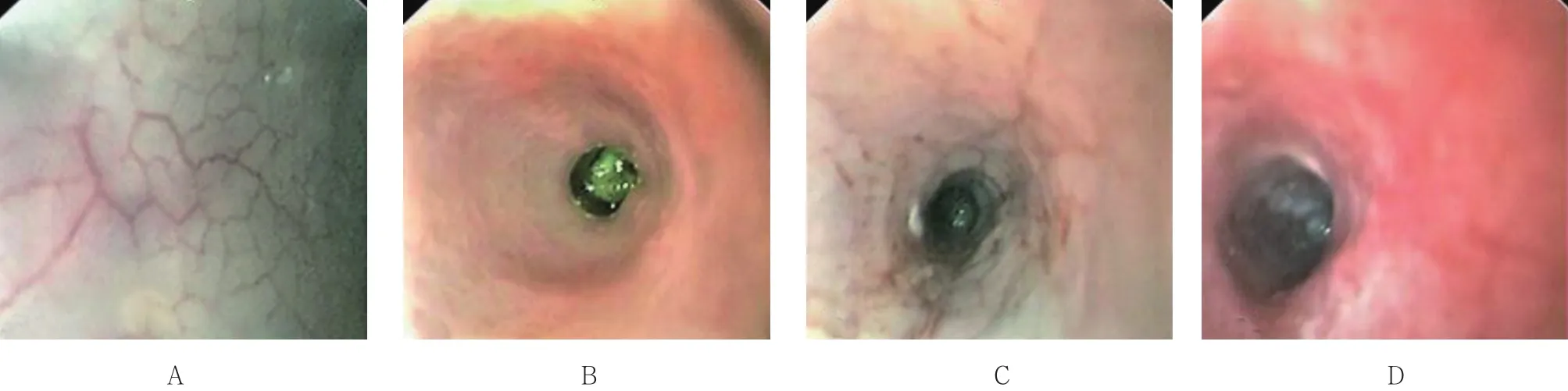
图2 实验组小鼠肠道内镜下成像Fig.2 Endoscopic imaging of mice in experimental group

图3 离体肠组织肉眼观及病理学典型图片Fig.3 Macroscopic view of isolated intestinal tissue and pathological picture
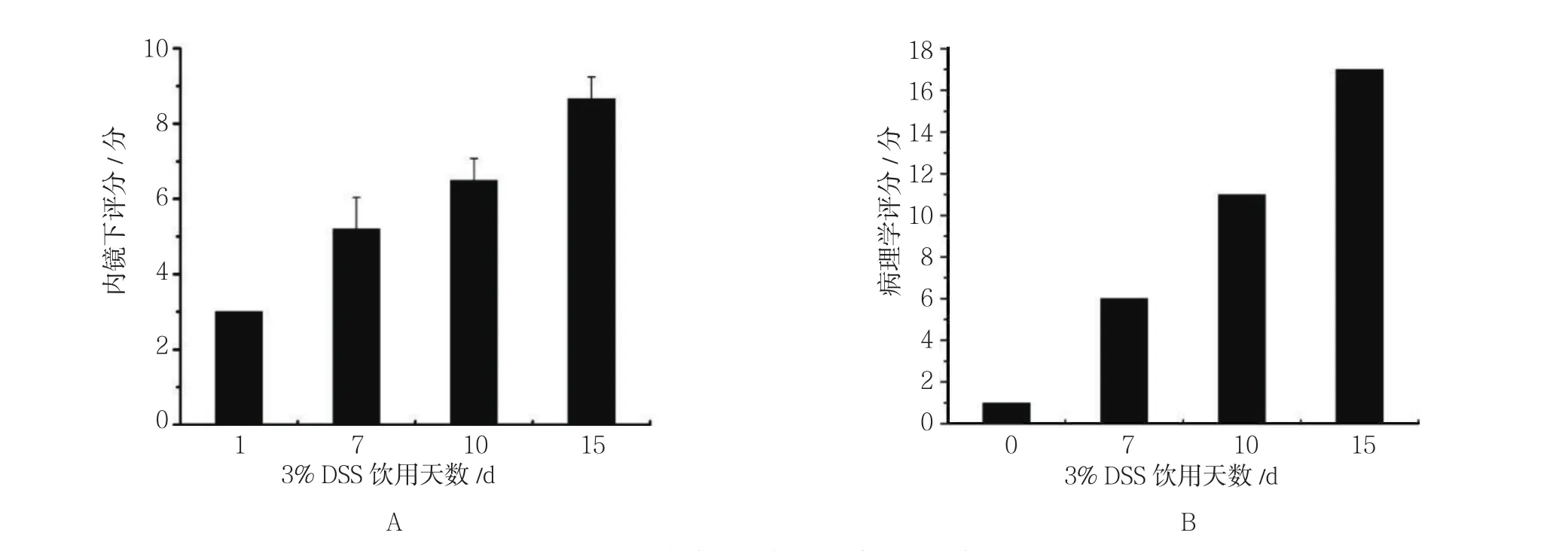
图4 实验组小鼠肠道病变内镜及组织病理学评分Fig.4 Endoscopic and histopathological score of mice in experimental group
3 讨论
在临床应用中,内镜联合病理学检查可以对患者肠道进行在体评估。然而,在动物研究中,对肠道病变进行有效评估的唯一方法为:处死小鼠取病变组织进行分析。因此,微型内镜系统的研发对动物水平的研究具有重要意义。国外已有相关研究实现了动物肠道内成像,但是国内仍缺少相关领域的研究。故本课题组根据内镜成像原理,自行搭建小动物成像平台,并对其应用进行了探索。
UC的发病率在我国有明显增加趋势[6-8],而且该病具有癌变倾向。因为发病机制不明确,成为研究热点之一。目前,有多种肠道病变模型构建方法,包括化学药物诱导型、基因型、细胞移植型和自发性动物模型[9-11]。本研究采用自由饮用3% DSS的方式构建模型,并利用内镜系统对小鼠进行肠道内成像,结果显示:此内镜系统不仅可以实现肠道黏膜的清晰成像,而且可以通过重复性的操作,对肠道病变进行动态监测。与传统评价方式(如小鼠状态、体重、粪便分析或处死后离体组织学分析)相比,内镜下成像具有以下优势:首先,动态观察是一个连续的过程,可以观察病变发展情况;其次,与自身形成对照,减少了鼠间个体差异,同时也有利于选择最佳个体进行动物实验研究,提高研究结果的一致性和可靠性;此外,操作的重复性可以减少实验动物数量,有效降低研究成本;最重要的是,可依据成像结果对肠道病变进行直观地评价。
目前,多数研究[12-13]使用的均为硬式内镜,存在进镜距离受限及操作难度高等缺陷,本系统采用软式成像探头,与现有的硬式内镜相比,能有效调节进镜角度、增加进镜深度和降低操作并发症的发生率;此外,此成像探头直径小,对小鼠造成的创伤较小。在未来的研究中,若与相关配件设备配合使用,可实现肠道黏膜下注射和在体活检等多种操作。但是此成像系统与其他相关设备相比,仍存在成像模式单一的缺点。例如,MITSUNAGA等[14]应用的设备,可结合荧光探针进行荧光成像。SHAO等[15]的研究中,将高分辨显微内镜(high-resolution fiber-optic microendoscopy,HRME)成像技术与基于光纤的光声内镜(fiber-based,real-time C-scan optical-resolution photoacoustic microscopy,F-OR-PAM)相结合,构建新型内镜成像系统,可以实现荧光和光声双模态成像,多种成像模式的结合,具有提高成像效果的作用。因此,本设备在未来还有待进一步的优化。

