酶解褐藻寡糖的分离制备及其脂蛋白调节作用
陈岩君,窦文芳,李恒,史劲松,许正宏
1(江南大学 药学院,糖化学与生物技术教育部重点实验室,江苏 无锡,214122) 2(江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡,214122) 3(江南大学 生物工程学院,江苏 无锡,214122)
在正常情况下,人体主要通过肝脏对胆固醇进行摄取,使血液中的胆固醇含量维持在正常范围之内。在肝脏摄取胆固醇的过程中,低密度脂蛋白受体(low-density-lipoproteinreceptor,LDLR)起主要作用。低密度脂蛋白(low-density-lipoprotein,LDL)是一种运载胆固醇进入组织细胞的脂蛋白颗粒。LDLR是一种膜镶嵌式蛋白质,能够摄取血浆中的LDL-胆固醇从而降低其在血浆中的含量,在脂蛋白代谢中起关键作用[1-2]。
近年来,蛋白转化酶枯草溶菌素9(proproteinconvertasesubtilisin/kexintype9,PCSK9)被发现是血浆LDL-胆固醇水平的关键调节剂[3]。PCSK9是哺乳动物前蛋白转化酶家族的可溶性丝氨酸蛋白酶[4],主要由肝脏合成、分泌,在其他组织如肾脏、小肠、中枢神经系统、胰腺、结肠上皮和血管平滑肌细胞有较少的分泌[5-7]。PCSK9分泌到血液中,通过细胞内和细胞外2个独立的方式与LDLR的表皮生长因子样重复A(EGF-A)结构域结合,诱导LDLR进入溶酶体降解。当血浆PCSK9水平升高时,肝细胞表面LDLR降解,影响血液中LDL-胆固醇的清除而导致LDL-胆固醇水平升高;当PCSK9含量降低时,LDLR的水平升高,可以转化更多的LDL-胆固醇[8-9]。因此,PCSK9被认为是预防和治疗高胆固醇血症和心血管疾病的重要靶标。
褐藻胶是一种由海洋褐藻生成的阴离子多糖,是由(1→4)连接的D-甘露糖醛酸(mannuronicacid,M)和其C5异构体L-古洛糖醛酸(guluronicacid,G)组成的线性聚合物,以均聚(MM或GG)或异聚(MG或GM)方式排列组成。主要存在3种结构片段:β-D- (1,4)连接的聚甘露糖醛酸片段(Polymannuronate,PM),α-L-(1,4)连接的聚古洛糖醛酸片段(polyguluronate,PG),G与M交替共聚的片段PMG[10-13]。褐藻寡糖可以通过酶解法或物理化学法降解褐藻胶制备。与化学和物理方法相比,酶解法具有高产量、污染小、可生成特定寡糖的优点。研究显示,褐藻寡糖能够增加低密度脂蛋白的摄取,可开发成新一代降胆固醇药物。但生物降解获得的褐藻寡糖是聚合度不一的寡糖混合物,糖基组成和寡糖活性存在较大差异,严重影响了批次稳定性及产品品质,限制了其推广应用。该文采用IsoptericolahalotoleransCGMCC5336褐藻胶裂解酶制备褐藻寡糖,经分离、纯化后得到聚合度均一的寡糖,并研究了不同聚合度寡糖对HepG2细胞LDLR和PCSK9蛋白水平的影响,以期为后续应用奠定基础。
1 材料与方法
1.1 材料与试剂
嗜盐白蚁菌(Isoptericolahalotolerans) CGMCC 5336,本实验室筛选并保藏的菌株。人肝癌细胞(HepG2),购自中科院上海细胞库。
1.2 主要仪器
Bio Gel P2(fine,45-90μm),美国Bio-Rad公司;机械搅拌玻璃发酵罐Biotech-5JG(5 L),上海保兴生物设备工程有限公司;荧光定量PCR仪,美国Bio-Rad公司;蛋白电泳装置,美国Bio-Rad公司;多功能酶标仪,美国Molecular Devices公司。
1.3 实验方法
1.3.1 不饱和褐藻寡糖的制备
将嗜盐白蚁菌CGMCC 5336接种于种子培养基,25 ℃、120 r/min培养24 h。按1%接种量(40 mL)接入罐上发酵培养基中培养48 h,8 000 r/min离心10 min去除菌体,用超滤法浓缩酶液,通过3,5-二硝基水杨酸(DNS)比色法测定酶的活性。1个酶活力单位(U)被定义为:1 min产生1 μg还原糖所需的褐藻胶裂解酶的量。将海藻酸钠(12 g)溶解于1 L的50 mmol/L磷酸盐缓冲液(pH 7.0)中,加入52 200 U褐藻胶裂解酶,40 ℃反应4 h,加水煮沸15 min停止酶反应。8 000 r/min离心5 min除酶。根据大分子多糖和蛋白质不溶于乙醇的特点,通过在酶解液中加入乙醇使其沉淀。将酶解液浓缩至约100 mL,加入无水乙醇至乙醇终浓度为60%,4 ℃沉淀过夜。收集上清液,浓缩并冻干,得到褐藻粗寡糖。
1.3.2 液相条件
色谱仪:WATERS ACQUITY UPLC;分析柱:BEH C18(2.1 mm×150 mm,1.7 μm);流动相:A乙腈,B 0.1% 甲酸(A 2%,B 98%,0 min;A 10%,B 90%,8 min);流速:0.3 mL/min;柱温:45 ℃;进样量:5 μL。
1.3.3 质谱条件
离子方式: ESI;毛细管电压: 3.0 k;锥孔电压: 20 V;离子源温度: 100 ℃;脱溶剂气温度: 400 ℃;碰撞能量:6/20 Volts;质量范围(m/z): 20~1 000;Detector电压: 1 800 V。使用MassLynx 4.1对样品数据进行分析和处理。
1.3.4 Bio-Gel P-2凝胶层析法分离寡糖
称取褐藻粗寡糖150 mg,溶于1 mL 1 mol/L NaCl溶液中,用0.22 μm水膜过滤样品,使用150 cm×1.0 cm Bio-Gel P-2凝胶柱进行分离,流动相为2.5 mmol/L Tris-1 mol/L NaCl溶液,流速为0.1 mL/min。于室温下进行分离,使用半自动收集器收集样品,每15 min收集1管。在230 nm测量吸光度值。将收集到的相同组分进行合并。
1.3.5 MTT测定


(1)
1.3.6 荧光定量PCR
根据制造商的说明书使用Trizol提取总RNA。将RNA稀释至40 ng/mL后,加入引物、模板对其进行反转录,PCR条件为:25 ℃,10 min;48 ℃,40 min;95 ℃,5 min;12 ℃,∞。反转录总RNA以获得cDNA。使用SYBR green premix进行qRT-PCR,条件为50 ℃,2 min;95 ℃,10 min;95 ℃,15 s;60 ℃,1 min,45个循环扩增。使用下列引物序列:人LDLR,5′-TTGGCTGCGTTAATGTGA-3′(有义)和5′-TGATGGGTTCATCTGACCAGT-3′(反义);人SREBP-2,5′-CAGTGGGACCATTCTGAC-3′(正义)和5′-TTCCTCAGAACGCCAGACTT-3′(反义);人PCSK9,5′-GCTGAGCTGCTCCAGTTTCT-3′(有义)和5′-AATGGCGTAGACACCCTCAC-3′(反义):以GAPDH为内参基因,采用2-ΔΔCt对基因的表达水平进行相对定量。
1.3.7 蛋白免疫印迹分析
在6孔板中加入含蛋白酶抑制剂的细胞裂解液,冰上静置30 min后收集蛋白,4 ℃、12 000 r/min离心10 min,取上清液,采用BCA蛋白定量试剂盒检测蛋白浓度。配制10%分离胶和浓缩胶,每孔蛋白含量为30 μg,80 V条件下使蛋白样品电泳至分离胶与浓缩胶之间时,调节电压至100 V,样品中的溴纷蓝跑至电泳槽底时即可停止电泳。
将胶取出,与聚偏氟乙烯膜(PVDF)、滤纸、海绵组成三明治结构,放入转膜缓冲液中转膜,然后将转膜仪置于冰水浴中,100 V恒流转膜100 min。用含5%脱脂奶粉的TBST溶液封闭1 h后,用TBST洗涤3遍,与一抗4 ℃孵育过夜,用TBST洗涤3遍,再与辣根过氧化物酶(HRP)-二抗孵育1 h后,用TBST溶液洗涤3遍,加入ECL化学底物发光试剂,凝胶成像仪检测目的蛋白条带,利用Image J软件计算条带灰度,以GAPDH作为对照。
2 结果与分析
2.1 褐藻寡糖的制备
采用褐藻胶裂解酶对海藻酸钠进行酶解,得到褐藻粗寡糖命名为FrA。
2.2 LC-MS分析
通过LC-MS对FrA进行分析。其液相分析图如图1所示,主要观察到5个峰,其出峰时间分别为0.65、3.14、3.73、4.46、5.46 min。分别对5个峰进行质谱分析,峰1结果如图2-a所示,确定该峰为杂质峰。峰2的质谱分析如图2-b所示,其中质荷比数351、703均可与寡糖的分子量相对应,故可能为二糖或四糖。峰3的质谱分析如图2-c所示,其中质荷比数527、1055均可与寡糖的分子量相对应,故可能为三糖或六糖。峰4的质谱分析如图2-d所示,其中质荷比数只有703与寡糖分子量相对应,确定其为四糖。峰5的质谱分析如图2-e所示,确定其为四糖。则峰2为二糖,峰3为三糖,其所对应的质谱图分别为二、三糖的质谱图。二糖质谱图中的703和三糖质谱图中的1055可能是两个糖分子连在一起,即[2M-1]。

图1 褐藻粗寡糖的液相图谱Fig.1 The LC analysis of alginate oligosaccharides

图2 褐藻粗寡糖的质谱图Fig.2 The MS analysis of alginate oligosaccharides
2.3 凝胶色谱分离
通过Bio-Gel P2凝胶柱对制备得到的褐藻粗寡糖进行分离。使用0.25 mol/L Tris-1 mol/L NaCl缓冲液进行洗脱,上样量为1 mL,样品质量浓度为150 mg/mL,流速为0.1 mL/min,通过使用半自动部分收集器对洗脱液进行收集,每管1.5 mL。使用230 nm处的吸收值绘制分离曲线。结果如图3所示,共得到4个组分,分别标记为Fr1,Fr2,Fr3和Fr4,Fr1中可能含有不同聚合度的寡糖。Fr2-4这3个组分分离度较好,可能为聚合度均一的寡糖。此外Fr1-Fr4分子量依次减小,Fr4的分子量最小。
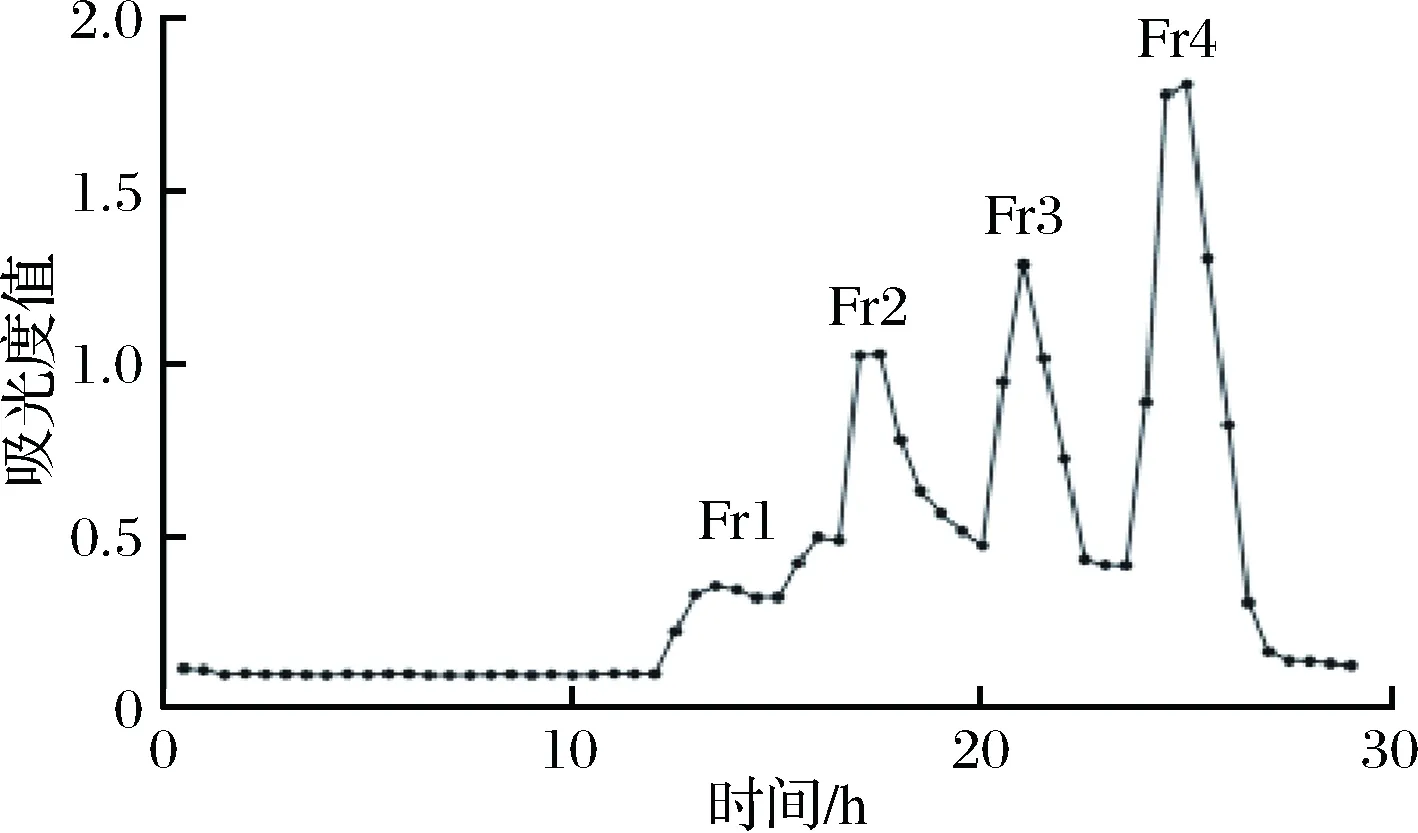
图3 Bio-Gel P2洗脱曲线Fig.3 The isolation eluted of Bio-Gel P2
2.4 LC-MS分析
Fr1的液相图如图4所示,共含有2个峰,分别为峰1和峰2。在峰1的质谱图中,如图5-a,质荷比879可以与聚合度为5的褐藻寡糖的分子量相对应,因此Fr1液相图中峰1是五糖;峰2质谱图,如图5-b,质荷比1065、879、527分别对应于聚合度为6、5、4的褐藻寡糖,由于峰2的分子量较峰1大,故确定Fr1中峰2为六糖。
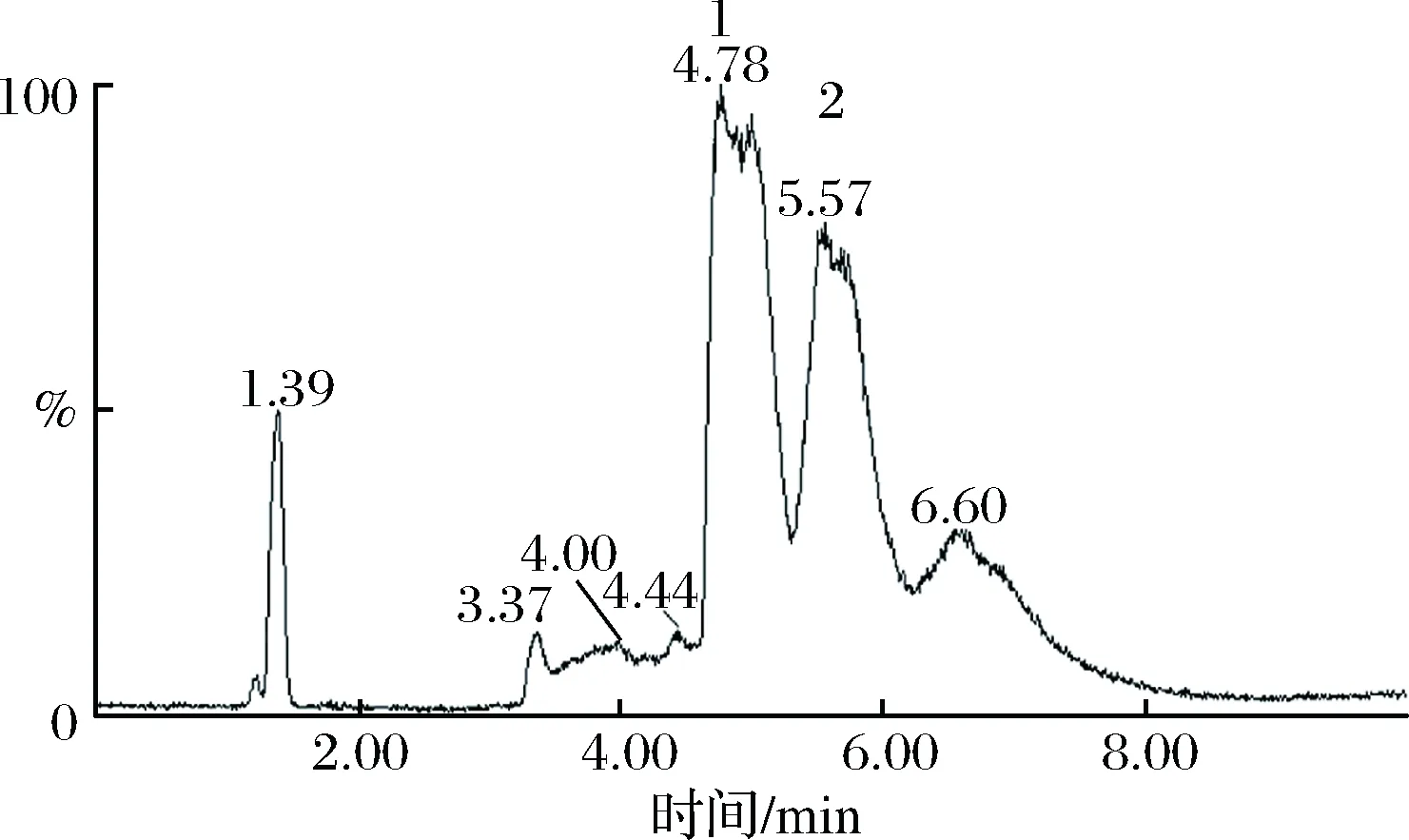
图4 Fr1的液相图谱Fig.4 The LC analysis of Fr1
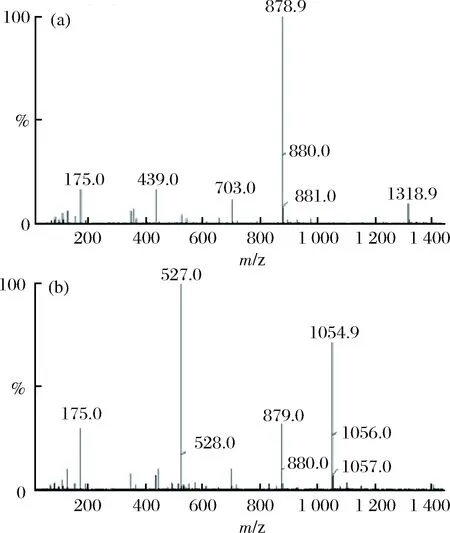
图5 Fr1的质谱图Fig.5 The MS analysis of Fr1
在Fr2-Fr4的液相图中,如图6所示,均只含有1个液相峰。与FrA的液相图谱相比较,Fr2的液相图如图6-a,其液相峰保留时间为4.37 min,确定为四糖;Fr3的液相图如图6-b 所示,其液相峰保留时间为3.61 min,确定为三糖;Fr4的液相图如图6-c所示,其液相峰保留时间为3.12 min,确定为二糖。

图6 Fr1的质谱图Fig.6 The MS analysis of Fr1
2.5 不同质量浓度的4种组分对HepG2细胞活性的影响
通过MTT实验测定不同质量浓度的Fr1-Fr4(0.062 5-1 mg/mL)对HepG2细胞活性的影响。结果如图7所示。

图7 Fr1-Fr4对HepG2细胞存活率的影响Fig.7 Cell viability of HepG2 cells exposed with Fr1-Fr4
当用不同质量浓度的4种组分刺激HepG2细胞12 h后,细胞存活率均在80%以上,表明Fr1-Fr4在1 mg/mL以下,对HepG2细胞的毒性较低。
2.6 四种组分对HepG2细胞LDLR基因及蛋白表达的影响
用1 mg/mL的Fr1-Fr4及FrA刺激细胞12 h,通过qRT-PCR检测4种组分对HepG2细胞LDLR基因表达的影响。结果如图8所示,Fr4能够显著上调LDLR的转录水平。
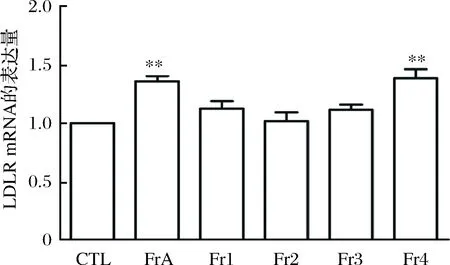
图8 Fr1-Fr4对HepG2 LDLR基因表达的影响Fig.8 Effects of Fr1-Fr4 on the gene expression of LDLR 注:*:p<0.05,**:p<0.01,p<0.001
通过Western Blot检测4种组分对HepG2细胞LDLR蛋白表达的影响。实验结果如图9所示,Fr1、Fr3和Fr4均能显著上调LDLR的蛋白表达水平,其中Fr4的调节作用最为显著。LDLR的增加有利于肝细胞对血浆中LDL-胆固醇的摄取,从而降低血浆胆固醇水平。其中Fr4对LDLR蛋白表达水平的上调作用可能与其对LDLR转录水平的上调作用有关。而其他组分对LDLR的调节作用主要受其他因素的影响。

图9 Fr1-Fr4对HepG2细胞LDLR蛋白表达的影响Fig.9 Effect of Fr1-Fr4 on the protein expression of LDLR 注:*:p<0.05,**:p<0.01,p<0.001
2.7 四种组分对HepG2细胞PCSK9蛋白表达的影响
通过Western Blot检测4种组分对HepG2细胞PCSK9蛋白表达的影响,用1 mg/mL的Fr1-Fr4及FrA刺激细胞12 h。结果如图10 所示,Fr3对PCSK9蛋白表达水平有明显下调作用,Fr1和Fr2具有上调作用。Fr4对其调节作用不明显。PCSK9增多,会造成LDLR的降解。当PCSK9被抑制时,LDLR蛋白含量增加。所以,Fr3对LDLR蛋白水平的上调作用可能与其对PCSK9的抑制作用有关。
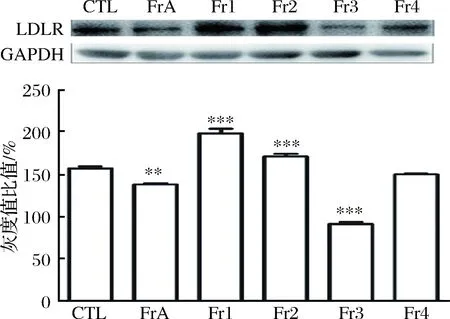
图10 Fr1-Fr4对HepG2细胞PCSK9蛋白表达的影响Fig.10 Effect of Fr1-Fr4 on the protein expression of PCSK9 注:*:p<0.05,**:p<0.01,p<0.001
2.8 Fr4对HepG2细胞SREBP-2基因表达的影响
LDLR基因表达主要受固醇反应原件结合蛋白-2(SREBP-2)的调控,而Fr4对LDLR转录水平有明显的上调作用。通过qRT-PCR考察Fr4对SREBP-2转录水平的调控作用。结果如图11 所示,Fr4能够显著上调SREBP-2转录水平。这表明,Fr4对LDLR转录水平的上调作用可能与其对SREBP-2的激活作用有关。

图11 Fr4对SREBP-2基因表达的影响Fig.11 Effects of Fr4 on the gene expression of SREBP-2 注:*:p<0.05,**:p<0.01,p<0.001
3 结论
通过Bio-Gel P2凝胶柱对酶解产生的褐藻粗寡糖进行分离纯化,得到聚合度均一的寡糖。在分离得到的4个组分中Fr1,Fr3,Fr4均能上调LDLR蛋白水平,其中Fr3和Fr4的活性更显著。Fr4能够上调LDLR转录水平,Fr3能下调PCSK9的蛋白水平,这表明Fr4对LDLR蛋白水平的调节作用受LDLR转录水平的影响;Fr3对LDLR蛋白水平的上调作用与PCSK9的下调有关。而Fr4对LDLR转录水平的上调作用可能与SREBP-2的激活有关。

