基于高通量测序技术解析高温大曲和中高温大曲的真菌群落结构
李静心,王艳丽,何宏魁,刘国英,李晓欢,陈斌,吴翠芳,王录
(安徽古井贡酒股份有限公司,安徽 亳州,236820)
中国白酒是世界六大蒸馏酒之一,具有悠久的生产历史,并通过独特的发酵工艺生产,其中浓香型白酒具有“绵柔甘洌、芳香浓郁、香味协调、尾净余长、入口甜、落口绵”的酒体风格,在我国白酒行业中占据主导地位[1]。大曲作为酿酒过程中的糖化剂和发酵剂在浓香型白酒的酿造过程中起着糖化、生香、发酵、提供菌源的作用,被人们评价“曲为酒之骨”。大曲中含有丰富的微生物种群,其中霉菌可以产生淀粉酶、糖化酶、蛋白酶等丰富的酶系,酵母则具有酒精发酵能力及产酯能力,对白酒中酒精及香味物质的产生起着十分重要的作用[2]。
对大曲中真菌微生物的研究最早是通过传统的分离培养方法,罗惠波等[3]对泸州老窖大曲中的真菌进行分离培养发现,大曲内存在大量的曲霉属、根毛霉属、横梗霉属等霉菌类群以及酿酒酵母、德巴利氏酵母属、异常威克汉姆酵母、锁掷酵母属等酵母菌类群。刘婷婷等[4]从白云边大曲及小麦原料中分离得到壮观拟青霉(Paecilomycesspectabilis),伞枝犁头霉(Absidiacorymbifera)和微小根毛霉(Rhizomucorpusillus)。然而,传统的分离培养方法受到培养基的选择性、微生物的生长特性等因素影响[5],很难直接展现大曲中微生物的真实群落结构。随着分子生物学技术的发展,针对真菌内转录间隔区(internaltranscribedspacer,ITS)研究技术的出现,大大提升了大曲微生物的研究效率。WANG等[6]借助PCR-DGGE技术分析了不同大曲中微生物组成的差异,结果表明Saccharomycopsisfibuligera和Pichiaanomal是大曲中主要的酵母类群,Aspergillusoryzae和Absidiablakesleeana是大曲中主要的霉菌类群。乔晓梅等[7]利用高通量测序技术对清香型大曲真菌群落结构进行分析,结果表明伞枝梨头霉(Lichtheimiacorymbifera)、米根霉(Rhizopusoryzae)、库德毕赤酵母(Pichiakudriavzevii)和扣囊复膜酵母(Saccharomycopsisfibuligera)是清香型大曲中的优势菌。胡佳音等[8]对清香、酱香、浓香3种大曲真菌进行多样性分析,结果表明扣囊复膜酵母(Saccharomycopsisfibuligera)和伞枝横梗霉(Lichtheimiacorymbifera)是清香型大曲的主要真菌,谢瓦散囊菌(Eurotiumchevalieri)、米曲霉(Aspergillusoryzae)、毕赤酵母(Pichiakudriavzevii)、嗜热子囊菌(Thermomyceslanugin)是浓香型大曲主要真菌,谢瓦散囊菌(Eurotiumchevalieri)和嗜热子囊菌(Thermomyceslanuginosus)是酱香型大曲的主要真菌。
该研究拟通过高通量测序技术,对白酒酿造所需高温大曲和中高温大曲进行研究,分析大曲中的主要真菌微生物构成,为优化浓香型白酒大曲生产工艺和提升原酒品质提供理论指导。
1 材料与方法
1.1 样品采集
大曲样品均采集自安徽省北部某知名白酒生产企业,样品为出房高温大曲和中高温大曲,每种大曲采集5个样品,置于-80℃保存。样品编号及分组如下:CZ1、CZ2、CZ3、CZ4、CZ5(中高温大曲);CG1、CG2、CG3、CG4、CG5(高温大曲)。
1.2 试剂与仪器
高级化学发光成像工作站,美国UVP;G-26C高速冷冻离心机,德国Sartorius;DYY-4C电泳仪,北京六一生物科技有限公司;MaestroNano微量分光光度计,美国MaestroGen。
DNeasy PowerSoil Kit土壤DNA提取试剂盒,美国QIAGEN;50×TAE溶液,生工生物工程(上海)股份有限公司;Agarose M,生工生物工程(上海)股份有限公司。
1.3 样品处理方法
1.3.1 DNA提取
分别称取0.25 g高温大曲和中高温大曲样品置于2.0 mL离心管中,参照DNeasy PowerSoil Kit提取大曲微生物的基因组DNA。琼脂糖凝胶电泳检测所提DNA的完整性,MaestroNano微量分光光度计测定DNA浓度及纯度。将符合测序要求的DNA -80℃保存。
1.3.2 高通量测序
利用深圳华大基因科技有限公司Illumina HiSeq 2500 2×250 bp测序平台对真菌ITS1进行高通量测序。
1.3.3 数据分析
根据华大基因提供的高通量测序下机数据(raw data),利用mothur软件进行拼接、过滤、嵌合体去除、OTU划分和物种注释[9],注释采用UNITE ITS数据库(Version No. 7.2, https://unite.ut.ee),置信度阈值设置为0.8。同时使用mothur软件对各样品的α多样性指数等指标进行计算。
2 结果与分析
2.1 高通量测序结果及真菌多样性分析
大曲样品提取基因组DNA后,对ITS1区进行高通量测序,10个样品共得到1 665 390条原始序列,质控后得到了1 549 585条优质序列,平均长度304 bp。将所有的序列按97% 的一致性将序列聚类成OTU,共得到200个OTU。使用UNITE真菌ITS数据库对每个OTU的代表序列进行物种注释,共注释得到3个门、16个纲、31个目、51个科、73个属和96个种水平的真核微生物。
对测序序列进行随机二次抽样,预测每个样品预期的OTU总数和相对丰度绘制稀释曲线[10](图1)。结果表明,随着测序序列的增加,10个样品的稀释曲线均趋于平滑,观测到的OTU数量趋于饱和,说明本试验的测序深度覆盖了绝大多数真菌微生物,本次测序结果能够真实反映中高温大曲和高温大曲真菌的群落结构和多样性。
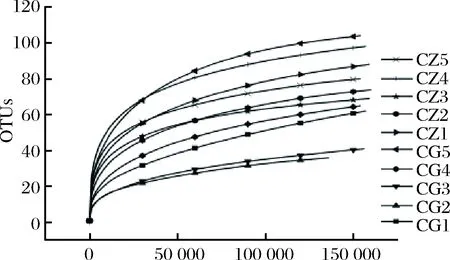
图1 大曲真菌OTU数稀释曲线Fig.1 Rarefaction curve of OTUs in Daqu
利用mothur软件计算各样品的α多样性指数(表1)。

表1 大曲的真菌多样性指数Table 1 Fungus diversity index of Daqu
注:Coverage-样品的序列覆盖度;OTU-样品的OTU数目;Chao指数和Ace指数-反映样品的群落丰富度;Shannon指数和Simpson指数-反映样品的群落多样性。
结果表明,所有样品的序列覆盖度(coverage)均大于0.999,再次证明本次测序的结果能够真实的反映所有样本真菌微生物的菌群结构。经分析,中高温大曲的OTU数量(81.80±5.14)多于高温大曲的OTU数量(61.60±12.02),但差异不显著(p≥0.05);中高温大曲的Chao指数(91.21±5.70)高于高温大曲的Chao指数(78.50±12.64),但差异不显著(p≥0.05),说明中高温大曲和高温大曲都具有较多的真菌种类,中高温大曲中的真菌种类稍多于高温大曲;中高温大曲的Shannon指数(1.537±0.151)高于高温大曲的Shannon指数(0.693±0.178),且差异极显著(p≤0.01),说明中高温大曲的真菌群落多样性高于高温大曲。综上所述,中高温大曲和高温大曲在真菌群落丰富度上差异较小,但中高温大曲的真菌群落多样性远高于高温大曲。
2.2 大曲真菌群落组成分析
2.2.1 属水平分析
使用mothur软件按照97%的相似度对测序结果进行OTU划分,采用UNITE ITS数据库(Version No. 7.2)对每个OTU进行classify,中高温大曲和高温大曲共得到73个属的真菌,其中核心真菌微生物(含量>1%)共有9个属(表2),分别是Aspergillus(曲霉属)、Thermomyces(嗜热真菌属)、Wickerhamomyces(威克汉姆酵母属)、Issatchenkia(伊萨酵母属)、Candida(假丝酵母属)、Saccharomycopsis(复膜孢酵母属)、Trichosporon(毛孢子菌属)、Wallemia属和Rhizomucor(根毛霉属),根据其在每个样品所占比例绘制柱状分布图(图2)。

表2 大曲真菌属水平百分比组成 单位:%
结果表明,高温大曲的优势真菌为Aspergillus((12.70±3.65)%)和Thermomyces((80.50±6.89)%),约占高温大曲真菌的78.78%~98.80%;中高温大曲的优势真菌为Aspergillus((24.85±3.76)%)、Issatchenkia((38.22±8.88)%)、Saccharomycopsis((25.66±5.06)%),约占中高温大曲真菌的80.67%~94.65%。

图2 大曲真菌属水平微生物菌群Fig.2 Microbial community at genus levels in Daqu
2.2.2 种水平分析
在种水平对大曲真菌进行分类分析,共得到了96个种,其中优势真菌(>1%)有10个种(表3),分别是Aspergillusoryzae(米曲霉)、Aspergillusintermedius、Thermomyceslanuginosus(疏绵状嗜热丝孢菌)、Wickerhamomycesanomalus(异常威克汉姆酵母)、Issatchenkiaorientalis(东方伊萨酵母)、Candidatropicalis(热带假丝酵母)、Saccharomycopsisfibuligera(扣囊复膜酵母)、Trichosporonasahii(阿氏丝孢酵母)、Wallemiasp.和Rhizomucorpusillus(微小根毛霉),根据其在每个样品所占比例绘制柱状分布图(图3)。
结果表明,高温大曲的优势真菌为2种霉菌Thermomyceslanuginosus((80.49±6.90)%)和Aspergillusintermedius((10.95±3.53)%),约占高温大曲真菌的74.46%~98.58%;中高温大曲的优势真菌为2种酵母菌Issatchenkiaorientalis((38.22±8.88)%)和Saccharomycopsisfibuligera((25.66±5.06)%),以及1种霉菌Aspergillusoryzae((21.40±3.59)%),约占大曲真菌的70.39%~93.95%。
对高温大曲和中高温大曲优势真菌中霉菌与酵母菌的相对丰度进行分析,并绘制相对丰度柱形图(图4)。结果表明,高温大曲的霉菌含量较高,约占真菌的78.65%~98.73%,酵母菌含量较低,仅有0.29%~3.84%;中高温大曲的酵母菌所占比例约为66.21%~86.02%,霉菌所占比例稍低,约为12.46%~33.04%(表4)。霉菌是构成高温大曲的主要真菌,而酵母菌是构成中高温大曲的主要真菌。

表3 大曲真菌种水平百分比组成 单位:%
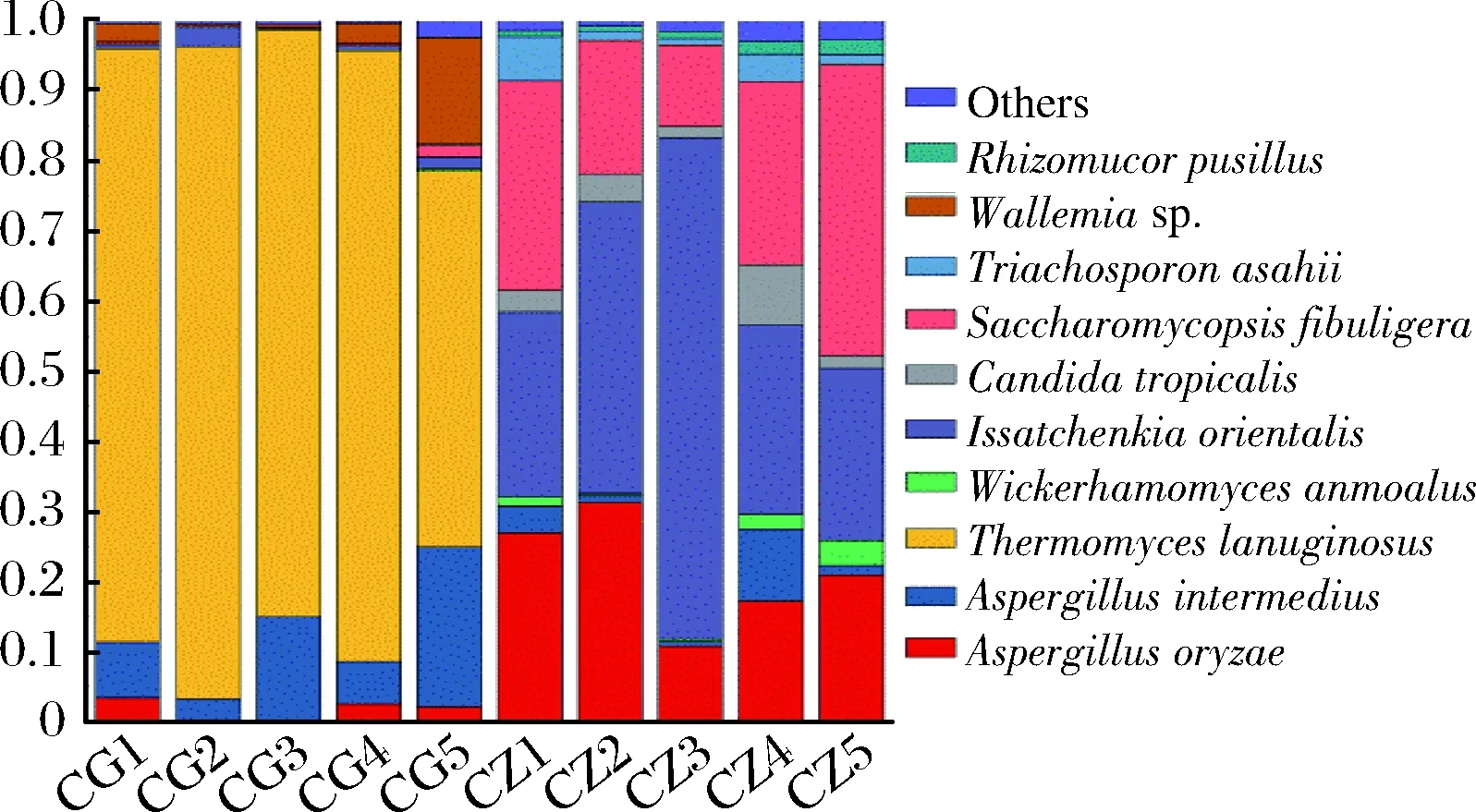
图3 大曲真菌种水平微生物菌群Fig.3 Microbial community at species levels in Daqu

图4 霉菌与酵母菌含量柱形图Fig.4 Contents of moulds and yeasts in Daqu
表4 大曲霉菌与酵母菌百分比组成单位:%

2.3 物种差异分析
根据样品中不同种水平真菌含量的相对丰度,采用Bray-Curtis算法计算样本间距离矩阵,通过PCoA(principal coordinates analysis)分析高温大曲和中高温大曲群体间的差异。两组大曲真菌群落结构PCoA分析结果如图5所示,第一主成分PC1的贡献率为79.55%,权重最大,第二主成分PC2的贡献率为7.25%,累计贡献率为86.80%,说明两组间差异具有统计学意义。高温大曲和中高温大曲可明显的划分为两组,中高温大曲样品CZ2和CZ3虽然偏离较远,但根据主成分一(79.55%)可与其余样品聚为一类,说明高温大曲和中高温大曲真菌群落结构具有明显的不同。

图5 大曲PCoA分析图Fig.5 PCoA analysis of Daqu
为了找出不同大曲中呈现显著性差异的物种,对大曲中的优势真菌进行LEfSe(LDA effect size)分析,通过LDA(linear discriminative analysis)值来估算每个物种的丰度对组间差异效果影响的大小[11-12],进一步明确高温大曲和中高温大曲独特的微生物类群(图6)。

图6 大曲微生物组LEfSe分析柱状图Fig.6 Histogram based on LEfSe analyses of microbiome in Daqu
LEfSe分析柱状图展现了高温大曲和中高温大曲中具有显著性差异的真菌微生物,柱的长度代表差异物种的影响值大小。结果表明,高温大曲的Thermomyceslanuginosus和Wallemiasp.与中高温大曲具有显著性差异,中高温大曲的Issatchenkiaorientalis、Saccharomycopsisfibuligera、Aspergillusoryzae、Candidatropicalis、Trichosporonasahii、Wickerhamomycesanomalus、Rhizomucorpusillus与高温大曲具有显著性差异。
疏绵状嗜热丝孢菌(Thermomyceslanuginosus)是一种分布广泛的、能够在高温条件下生存的特殊真菌,其最低生长温度高于20 ℃,在低于19 ℃的环境中无法生长,而最高生长温度可达50 ℃以上[13-14]。它能产生具有高热稳定性和活力的纤维素酶、蛋白酶、几丁质酶、β-葡聚糖酶等,有利于酿造过程中产酒生香[15-19]。
Wallemia属是一种广泛分布的耐高渗透压真菌,包含耐旱、嗜热和嗜盐的物种,在各种环境中均有发现,如干燥、腌渍或高糖食物、干饲料、晒盐场、盐晶体、室内外空气中[20]。目前该属共有8个物种,国内最早于2006年报道从土壤中分离出1株Wallemiasebi,其在马铃薯葡萄糖琼脂培养基上对植物病原菌尖孢镰刀菌(Fusariumoxysporum)以及大丽花轮枝菌(Verticilliumdahliae)具有很强的抑制作用[21]。在高温大曲中发现的Wallemiasp.属于未知的Wallemia物种,且含量不高((4.25±2.78)%),推测其是1种嗜热的Wallemia真菌,其在大曲中的作用需要进一步研究。
东方伊萨酵母(Issatchenkiaorientalis)在汾酒[22]、白云边酒[23-24]和葡萄酒[25-26]的酿造过程中均有发现,是一种广泛存在于酿酒生产中的能够产生乙醇的酵母菌[27]。刘婷婷[23-24]在白云边酒醅中分离得到了1株耐高温、耐高酒精度且产乙酸乙酯能力强的东方伊萨酵母菌株,具有较强的产乙醇能力,是白云边酒酿造过程中的优势酵母菌株。LI等[22]对汾酒发酵生产过程中真菌多样性进行分析发现,东方伊萨酵母是汾酒发酵过程中含量最高的酵母。该研究发现,中高温大曲中东方伊萨酵母的含量最高(38.22%),表明中高温大曲可能是发酵过程中东方伊萨酵母的主要来源。
扣囊复膜酵母菌(Saccharomycopsisfibuligera)广泛分布于自然界中,能够分泌α-淀粉酶[28-29]、蛋白酶[30]在内的多种水解酶,在发酵行业中具有广泛的应用[31]。目前已从清香型大曲[32]、浓香型大曲[33]、酱香型大曲[34]、糯米酒曲[35]和黄酒曲[36]中分离得到该种酵母菌,本研究也在中高温大曲中发现了扣囊复膜酵母且含量较高(25.66%)。扣囊复膜酵母不但能够在窖池中发酵产生乙醇[29],还可以提高大曲酒中多种醇和酯的含量[37-38],使原酒品质有所提高。除东方伊萨酵母和扣囊复膜酵母菌外,中高温大曲中的热带假丝酵母(Candidatropicalis)、异常威克汉姆酵母(Wickerhamomycesanomalus)和阿氏丝孢酵母(Trichosporonasahii)也具有提高乙酸乙酯产量[39-40]、分泌β-葡萄糖苷酶[41]的能力,从而使得原酒的风味更加协调、丰满。
米曲霉(Aspergillusoryzae)是食品酿造中的常用菌株,尤其在酱油的酿造过程中的应用最为广泛[42-43],其安全性能已得到了广泛认可[44-46]。米曲霉具有酶系丰富,酶活高,适应能力强,不产毒素等特点[47],产淀粉酶[48-49]、蛋白酶[50-51]、脂肪酶[52]、纤维素酶[53]和果胶酶[54]的能力非常强。本研究发现米曲霉在中高温大曲中的含量较高(21.40%),是中高温大曲的主要霉菌,其较强的产淀粉酶能力有助于提高大曲的糖化力和液化力,而产生的脂肪酶则对酿造过程中乙酸乙酯、丁酸乙酯和己酸乙酯等骨架风味物质的形成有一定的促进作用。此外,虽然微小根毛霉(Rhizomucorpusillus)在中高温大曲中的含量较低,仅有(1.29±0.28)%,但其产生的α-淀粉酶则具有较好的热稳定性和pH耐受性[55]。
3 结论与讨论
高温大曲和中高温大曲是以制曲过程中能达到的最高温度来区分的,高温大曲主要用于酱香型白酒的生产,其生产过程中最高温度约为60~70 ℃,中高温大曲主要用于浓香型白酒的生产,其生产过程中最高温度约为50~60 ℃,此外生产过程中最高温度低于50℃的低温大曲则主要用于清香型白酒的生产[56]。由于大曲生产过程中原料、环境和生产工艺的差异,不同大曲拥有不同的微生物菌系和酶系,使得糖化力、液化力和酯化力等理化指标有所差异。张春林[57]对泸州老窖生产的中、高温大曲进行研究发现,中高温大曲液化酶、糖化酶、蛋白酶和纤维素酶的活性以及酯化力、产酒能力均高于高温大曲。邢钢等[58]对3种不同温度大曲制曲过程的理化指标进行分析发现,高温大曲的水分、淀粉、酸度和中温大曲相差不大,但糖化力、液化力、酯化力和发酵力均低于中温大曲。邢爽等[59]针对3种大曲的酯化力进行分析,结果表明低温大曲合成乙酸乙酯和丁酸乙酯的酶活最高,中高温大曲合成乳酸乙酯和己酸乙酯的酶活最高,而高温大曲的酯化酶活力最小。
为了进一步分析高温大曲和中高温大曲菌系与酶系的不同,本研究借助高通量测序技术对2种大曲进行分析,找出了两者真菌微生物群落结构的差异。结果表明高温大曲和中高温大曲所含OTU数量接近,差异不显著,但中高温大曲真菌的群落多样性显著高于高温大曲;霉菌是构成高温大曲的主要真菌,其中疏绵状嗜热丝孢菌(Thermomyceslanuginosus)和Wallemiasp.为高温大曲所特有,Aspergillusintermedius也是高温大曲中的优势菌,含量在10.95%左右;酵母菌则是构成中高温大曲的主要真菌,霉菌仅占真菌含量的1/4左右,东方伊萨酵母(Issatchenkiaorientalis)、扣囊复膜酵母(Saccharomycopsisfibuligera)、米曲霉(Aspergillusoryzae)、热带假丝酵母(Candidatropicalis)、阿氏丝孢酵母(Trichosporonasahii)、异常威克汉姆酵母(Wickerhamomycesanomalus)、微小根毛霉(Rhizomucorpusillus)为中高温大曲所特有。大量的酵母菌保证了中高温大曲具有较高的发酵力、液化力、酯化力及产酒能力,而米曲霉则保证了中高温大曲液化酶、糖化酶、蛋白酶和纤维素酶的活性;高温大曲在生产过程中最高温度超过60 ℃,酵母菌、米曲霉等不耐高温的微生物难以生长,使得高温大曲发酵力、液化力、酯化力及产酒能力较低,而耐高温疏绵状嗜热丝孢菌分泌的高热稳定性酶使得高温大曲具有独特的生香作用。
胡佳音等[8]采用高通量测序对清浓酱3种大曲真菌多样性进行分析发现,谢瓦散囊菌(Eurotiumchevalieri)和疏绵状嗜热丝孢菌(Thermomyceslanuginosus)为高温大曲中的主要真菌,分别占43%和34.8%;谢瓦散囊菌(Eurotiumchevalieri)、米曲霉(Aspergillusoryzae)、毕赤酵母(Pichiakudriavzevii)和嗜热子囊菌(Thermomyceslanugin)为中高温大曲的主要真菌,分别占52%、11.7%、8.9%和6.2%。徐占成等[60]对川派浓香型白酒中高温大曲进行高通量测序,结果表明Rhizopus、Saccharomycopsis、Aspergillus和Thermoascus等属为剑南春大曲的优势真菌。李申奥[61]对湖北白云边高温大曲真菌群落结构进行解析发现,Thermomyces属、Candida属和Aspergillus属为出房高温大曲的优势真菌,其占比分别为77.89%、12.60%和8.53%。本文所分析的大曲均采集于皖北某知名酒企,该企业是皖派白酒的代表企业,对其生产的高温大曲和中高温大曲进行分析能够反映皖派白酒大曲的真菌群落结构。与其他产区相比,该地区高温大曲的真菌群落结构与白云边高温大曲类似,嗜热真菌属(Thermomyces)均占据主要地位,与胡佳音[8]的研究结果相比并未发现谢瓦散囊菌(Eurotiumchevalieri)。中高温大曲中曲霉属(Aspergillus)和伊萨酵母属(Issatchenkia)含量远高于剑南春中高温大曲,而根霉属(Rhizopus)含量远低于剑南春中高温大曲,也未发现胡佳音[8]研究结果中占主要地位的谢瓦散囊菌(Eurotiumchevalieri)。
大曲中含有丰富的菌系和酶系,通过高通量测序技术对真菌群落结构进行分析明确了大曲中的微生物种类和相对丰度,了解大曲中主要优势菌的演变规律,更有效地帮助白酒企业认知大曲在酿酒过程中的作用。

