ERK信号通路在DPA诱导神经干细胞分化中的作用
王光辉, 杨慧敏, 张一兵, 钟 鸣, 张敏娜
神经干细胞在帕金森病(Parkinson disease,PD)等神经系统的退行性疾病的临床治疗方面潜力巨大,通过诱导分化神经元参与功能重建具有重要意义,神经突起(neurite),包括树突和轴突两种,通过神经突起建立有效突触连接是神经功能恢复的结构基础,探索促进神经突起形成机制的研究为神经干细胞走向临床治疗具有重要意义[1]。移植的NSCs在宿主微环境中,神经生长因子NGF等信号刺激物作用下,启动细胞内微丝、微管和中间丝结构蛋白的表达与重组,参与神经突起的发生,对形成突触和神经递质运输、神经冲动传导等功能具有重要意义,新突起的发生最终有望恢复因神经元缺失导致的躯体运动和感觉障碍以及认知、功能缺失等症状和体征[2,3]。二十二碳五烯酸DPA富含于海洋动植物细胞[4],相关研究证实DPA对神经系统的主要作用包括提高大脑记忆力、营养和保护神经细胞、延缓脑萎缩、改善中老年性痴呆症状等作用[5,6]。目前关于DPA对神经系统细胞发育过程中发挥的作用国内外研究较少,本课题组前期研究发现DPA诱导未分化型PC12细胞株向神经元方向分化,在此研究基础上,本实验通过DPA进行体外诱导分化神经干细胞,对神经突触形成检测和突起长度的测量、细胞骨架蛋白含量检测、ERK信号通道磷酸化水平的检测等,探寻DPA促进神经突起以及神经元网络形成的机制,为NSCs临床治疗提供科学合理的实验依据。
1 材料与方法
1.1 仪器、试剂与实验动物 多通道移液器、BioClean LTS和通用移液器吸头来自美国瑞宁公司;解剖显微镜、倒置相差显微镜和免疫荧光显微镜来自日本奥林巴斯公司;胎牛血清FBS、马血清HS、表皮生长因子EGF、神经营养因子NGF来自于Sigma公司NSE抗体(rabbit anti-NSE),抗β微管蛋白Ⅲ抗体,GFAP抗体(mouse anti-GFAP)、anti-phospho-ERK1/ERK2抗体、抗Akt磷酸化抗体购自Santa Cruz Biotechnology公司; SPF级SD新生鼠来自济宁医学院日照校区药学院实验动物中心,许可证SCXR(鲁)20180002。
1.2 神经干细胞培养、免疫学检测与干预后各项指标检测
1.2.1 神经干细胞培养与免疫学鉴定 处死幼鼠无菌操作取脑组织,剪碎后用胰蛋白酶分解,缓慢轻柔吹打使细胞充分分离形成单细胞悬液,筛网滤过后收集滤液,显微镜下计数并且以5×104/ml密度接种到培养基孵育。原代克隆形成后加入胰蛋白酶分解制备单细胞悬液,稀释到5×104/ml,继续培养。每7日为一个传代周期。取传代中细胞克隆分解形成单细胞悬液,种植于96孔培养板, 10%的FBS、DMEM/F12孵育4 d,行细胞免疫学检测:GFAP、NSE和Nestin 3项指标,稀释抗体浓度分别为1∶400、1∶100、1∶300。
1.2.2 DPA诱导与干预神经干细胞分化及其长度测定 培养细胞稀释后参照4×103个/孔添加到48孔培养板, RPMI1640培养基中(含5%FBS,2 mmol谷氨酰胺,10%HS,200 U/ml青霉素G),置37 ℃, CO2培养箱进行培养。每24 h更换培养基一次,加入不同浓度DPA和NGF(对照组)下继续培养48 h,实验组浓度为A组10 μg/ml、B组20 μg/ml、C组30 μg/ml和D组40 μg/ml,血清培养为对照组。经1%戊二醛固定和姬姆萨染色,用奥林巴斯倒置显微镜在400倍高倍镜视野下任意区域评价400个细胞突起形成率,记录数据。用Image-pro Plus 2.0图像分析软件采集相应图像对突起长度进行分析和记录数据。
1.2.3 Western blotting法检测 诱导分化开始后,按照时间顺序对诱导后分化细胞进行裂解,提取总蛋白质,取10 g加载到10%的SDS-PAGE凝胶进行电泳,电泳分离后电转至硝酸纤维素膜。蛋白质印迹分析应用抗体包括:anti-phospho-ERK1/ERK2抗体(工作抗体浓度1∶20000)、anti-βⅢ-tubulin抗体(工作抗体浓度1∶20000)。Fusion 软件分析。

2 结 果
2.1 原代培养24 h显微镜下观察形成细胞群落 免疫荧光染色显示Nestin(神经干细胞特异性标志物)表达,培养液加入血清分化后检测细胞NSE(神经元特异性烯醇化酶)表达和神经胶质细胞标志物GFAP表达(见图1A~D)。
2.2 诱导干预后观察结果 NSCs呈现球形,容易聚集成桑葚状球团,胰蛋白酶消化分离打散稀释后,细胞形成单体,种植于48孔培养板,分别经 DPA(浓度分别为A组10 μg/ml、B组20 μg/ml、C组30 μg/ml和D组40 μg/ml)和血清诱导48 h后,相差显微镜下观察到神经突起及突触的数量明显增加。神经突起长度和突触形成率DPA与对照组相比,差异有统计学意义(P<0.01,P<0.05);NSE阳性率DPA空白对照组相比差异有统计学意义(P<0.01,P<0.05)。DPA 明显诱导NSCs分化为神经细胞,神经突起延伸以及突触形成呈浓度依赖性(见图1E、F、表1)。
2.3 βⅢ-tubulin表达的检测结果 DPA诱导72 h后,βⅢ-tubulin的表达明显上升,与空白对照组比较差异有统计学意义(P<0.05);NGF组与空白对照组比较差异有统计学意义(P<0.05)(见图2)。
2.4 DPA干预后ERK信号通道的变化情况 DPA诱导作用下,NSCs分化细胞ERK磷酸化水平明显升高,诱导后与空白对照相比,DPA诱导30 min,磷酸化水平差异不明显(P>0.05);DPA诱导30 min与空白对照组比较p-ERK表达显著升高,差异有统计学意义(P<0.01);DPA诱导90 min与空白对照组比较p-ERK表达显著升高,差异有统计学意义(P<0.01);DPA诱导210 min与空白对照组比较p-ERK表达显著升高,差异有统计学意义(P<0.05)(见图3)。

表1 神经干细胞的诱导分化结果
与对照组比较*P<0.05,**P<0.01

A:24 h细胞增殖群落形成(×100);B:免疫组织化学染色显示Nestin表达;C:NSE阳性细胞(SABC×400);D:GFAP阳性细胞(SABC×400);E:对照组神经突起形成(相差显微镜×200);F:DPA 30 μg/ml诱导神经突起形成(相差显微镜×200)
图1 神经干细胞及其分化细胞
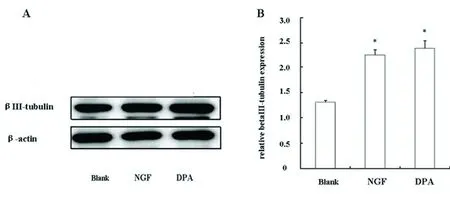
与空白对照组比较,DPA诱导组βⅢ-tubulin表达升高(*P<0.05);NGF组与空白对照组相比,βⅢ-tubulin表达升高
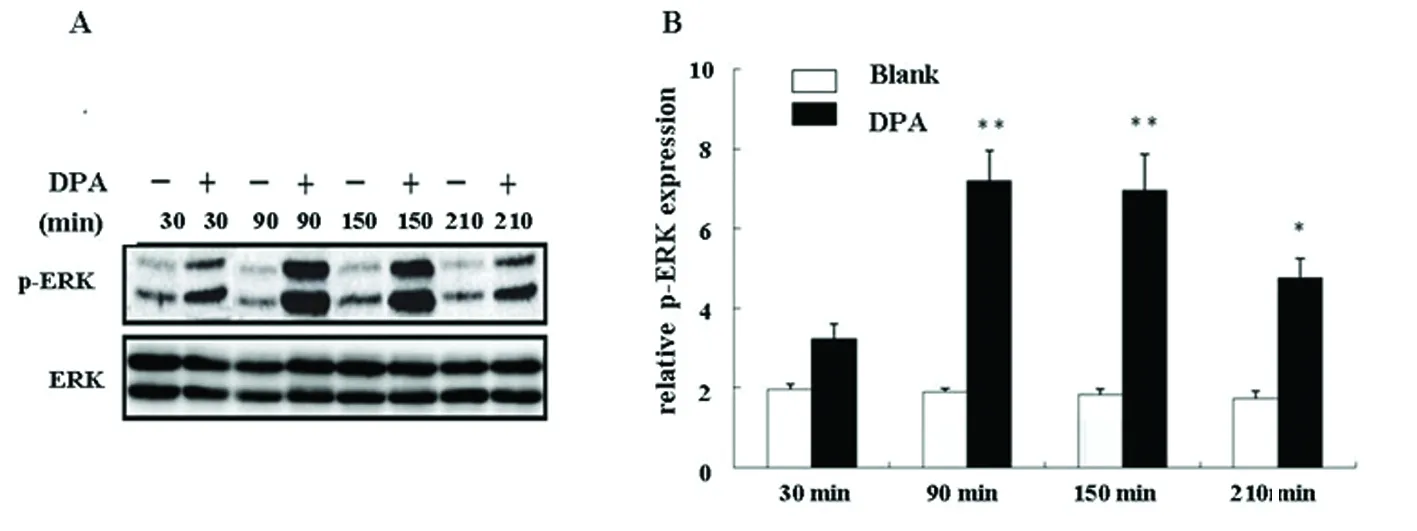
与空白对照组比较,DPA诱导组(诱导90 min)p-ERK表达显著升高(**P<0.01);与空白对照组比较,DPA诱导组(诱导150 min)p-ERK表达显著升高(**P<0.01);与空白对照组比较,DPA诱导组(诱导210 min)p-ERK表达升高(*P<0.05)
图3 实验各组ERK磷酸化水平情况
3 讨 论
神经干细胞分化进程中涉及到多种信号机制,探索其信号机制对于神经退行性疾病的干细胞治疗具有重要研究价值,在神经突起及突触形成过程以及与周围神经细胞或者神经胶质细胞建立信号联系过程,蛋白激酶B/Akt信号系统发挥了重要的引导作用[7]。除细胞因子外,一些外源性活性化合物也可以通过相应的信号途径达到形成神经突起、构筑突触联系的目的[8]。近年来,源于海洋动植物的DPA对神经系统的作用越来越值得重视和研究,DPA活化脑组织血管增加脑细胞营养、抑制炎症因子的损伤作用,明显改善神经退行性疾病临床症状[4~6,9]。
相关研究显示PC12细胞株源于肾上腺髓质嗜铬细胞瘤,具备向神经元分化的潜质[10~13],可以解决神经元移植的来源问题,为各类神经退行性疾病的治疗带来了希望。经DPA诱导后发现向神经元分化增加,且细胞骨架蛋白βⅢ微管蛋白表达与DAP浓度之间呈现浓度依赖性[14~16],进一步检测发现ERK磷酸化水平升高,推测MAPK/ERK信号系统可能参与了分化过程的调节[17~20]。本课题组前期研究证实DPA可以诱导P12分化细胞形成神经元突起,可能与活化的ERK信号通路有关[12],在胚胎时期的神经系统发育过程中,嗜铬细胞与神经元有一定的同源性(均来源于神经外胚层),在以上研究基础上本课题组采用大鼠来源的神经干细胞,通过原代培养和鉴定确定干细胞生物学属性,DPA和神经生长因子NGF进行的神经突触生长诱导。实验结果显示分化细胞神经突起以及突触形成率随着DPA浓度增加明显增加,呈现一定的剂量依赖性;经 DPA 诱导后βⅢ微管蛋白(神经元标志物)表达相应增加;分化细胞ERK信号通路磷酸化水平在DPA干预过程明显上升。
综上所述,本实验结果证实ERK信号途径通过磷酸化修饰过程参与了神经干细胞分化中神经突起(轴突和树突)的形成的调节,为进一步研究神经干细胞分化信号通路研究奠定基础,本研究对探索神经元信息网络的建立和退行性疾病的干细胞修复过程具有重要的意义。

