橄榄苦苷与Aβ1-42的亲和效应及对Aβ1-42诱导的Neuro-2a细胞凋亡的保护作用
胡光强, 余 录, 杜 曦, 高小青, 秦大莲, 余崇林
阿尔茨海默病(Alzheimer’s disease,AD)是一种以记忆认知功能障碍为主的渐进性神经退行性疾病。流行病学调查研究显示,到2050年,用于AD预防和治疗的年消费将高达1.89万亿美元,给社会带来巨大的经济负担[1]。AD有两大病理特征,一是细胞外Aβ的异常聚集形成具有神经毒性的老年斑;另一个是细胞内tau蛋白的过度磷酸化形成神经纤维缠结,加速AD进程。其中,Aβ病理级联假说是AD形成和发展的主轴,因此,寻找特异性与Aβ结合的药物并探索其机制是治疗AD的良好策略。
油橄榄是一种木犀科、齐墩果属常绿乔木,广泛种植于我国甘肃和四川。油橄榄果的食用和药用价值极高,并已被熟知和应用。然而,橄榄叶的开发价值却长期被忽视。橄榄叶中有一种主要的酚类化合物,即橄榄苦苷(Oleuropein,OE),其含量丰富且易于分离和纯化[2]。橄榄苦苷有多种药理作用,包括抗癌、抗氧化、增强免疫等[3~5],并且在神经系统的作用也逐渐被关注。我们的前期研究也证明,橄榄苦苷能保护脑缺血再灌注损伤[6]。为证实橄榄苦苷在AD作用的可能效应,我们首先检测了橄榄苦苷对Aβ1-42纤维的抑制能力和亲和效应,并进一步探讨了其对Aβ1-42诱导的Neuro-2a细胞凋亡的保护作用。
1 材料和方法
1.1 材料 Neuro-2a细胞系(CCL-131,American cell type culture collection),橄榄苦苷(HPLC 98%),购自成都曼思特生物科技有限公司(批号:MUST-14092511)。噻唑蓝(MTT)、十二烷基硫酸钠(SDS)、硫生物素代磺色素(Th-T),购自美国Sigma公司。Aβ1-42多肽购自苏州强耀生物科技有限公司。 生物素(Thermo Scientific,美国),SPR生物传感器(Pall Fortebio,美国)。 细胞凋亡检测试剂盒(北京四正柏生物科技有限公司)。酶标仪(美国biotek公司),流式细胞仪(美国BD FACS verse公司)生物分子相互作用仪(Pall Fortebio,美国),奥林巴斯倒置显微镜(Olympus,日本)。
1.2 方 法
1.2.1 Aβ1-42纤维的制备 取1 mg Aβ1-42多肽粉末,用400 μl的六氟异丙醇(HFIP)将其溶解,超声至溶液澄清,再均匀分装至4个1.5 ml离心管,用氮气温和吹干,然后得到无色透明的Aβ肽膜,附着于管壁内侧,置于-80 ℃冰箱保存备用,需要时溶解。
1.2.2 Th-T荧光检测 Th-T是一种荧光染料,能与淀粉样纤维的β片层结构特异性结合,因此成为测定Aβ纤维的经典方法。Th-T用PBS溶解为20 μmol/L避光备用。Aβ1-42肽膜用含2%DMSO的PBS溶解,加入适量的橄榄苦苷,Aβ1-42终浓度为20 μmol/L,橄榄苦苷的终浓度分别为12.5 μmol/L、25 μmol/L、50 μmol/L,总体积为100 μl,置于37 ℃培养箱中连续孵育5 d。不加Aβ1-42和橄榄苦苷的溶液作为空白对照组,模型组不加入橄榄苦苷。在孵育的第5天,取10 μl该溶液,加入Th-T溶液190 μl,在波长440 nm~490 nm处检测其荧光值。
1.2.3 Aβ1-42的生物素化及固化 用DMSO将生物素溶解至10 mmol/L,取孵育后的200 μl的Aβ1-42 (100 μg),按1∶0.5的摩尔比混合,室温静置反应30 min,使其实现生物素化。将200 μl生物素化的Aβ1-42转移至黑色不透明的96孔板,然后把预湿的生物传感器插入溶液中,生物素化的蛋白固化于传感片,通过生物分子相互作用仪检测Aβ1-42生物素化的成功与否,标记成功的Aβ1-42传感器用于后续药物亲和力的检测。
1.2.4 橄榄苦苷与Aβ1-42的亲和力测定 将橄榄苦苷用PBS溶解成400 μmol/L,加入200 μl至96孔黑板,等比梯度稀释成200 μmol/L、100 μmol/L至25 μmol/L 6个浓度,对照组加入等量的PBS。将建立成功的Aβ1-42传感器插入另一含PBS的96孔板,预湿10 min。将两板放入生物分子相互作用仪,设置洗脱、基线、亲合、解离分别为120 s,6个浓度梯度循环。利用Forte Bio Da-ta Acquisition软件实时收集分子相互作用的动力学数据,计算橄榄苦苷与Aβ1-42的亲和力(KD)值。
1.2.5 Neuro-2a细胞的培养 Neuro-2a细胞是一种小鼠来源神经瘤母细胞,广泛用于神经疾病的体外研究。将冻存的Neuro-2a细胞从液氮中取出,并于37 ℃水浴复苏,然后转移至6 cm的细胞培养皿,培养液为含10%的胎牛血清(FBS)和1%的亲链霉素双抗(PSG)的DMEM。将其吹打均匀,放置于5% CO2恒温(37 ℃)细胞培养箱,培养至对数生长期,用于后续实验。
1.2.6 MTT检测 用MTT检测橄榄苦苷对Neuro-2a的细胞毒性以及其对Aβ1-42诱导的Neuro-2a细胞的幸存率的影响。取对数生长期细胞,用PBS清洗,0.25%的胰酶消化1 min后,吸掉胰酶,加入培养基,吹打均匀,收集细胞,镜下数细胞个数,然后按4000个/孔(100 μl)种植于96孔板,4 w只加入空白的培养基。24 h后,按浓度梯度加入药物,48 h加入MTT,继续孵育6 h,加SDS过夜,次日于590~650 nm波长处检测吸光度,观察橄榄苦苷对Neuro-2a的细胞毒性。另外,观察橄榄苦苷对Aβ1-42诱导的Neuro-2a细胞的幸存率的影响,按10000个细胞/孔(100 μl)种96孔板,24 h后加入孵育的20 μmol/L的Aβ1-42,同时给予或不给于橄榄苦苷处理(分别为12.5 μmol/L、25 μmol/L以及50 μmol/L),24 h后,加入MTT,同上检测。
1.2.7 流式细胞分析细胞的凋亡 取对数生长期细胞,种植于6孔板,20万个细胞/孔,实验分组如上,24 h后,在倒置显微镜下观察细胞形态并在200倍光镜下采图。然后用PBS洗涤3次,胰酶消化,收集细胞,离心1500 rpm 3 min,吸去培养基,每个样品用含2 μl的碘化丙锭和1 μl膜联蛋白V的PBS 200 μl重悬,在室温避光反应15~20 min后,用流式细胞仪检测细胞凋亡。
2 结 果
2.1 橄榄苦苷抑制Aβ1-42纤维 20 μmol/L的Aβ1-42与Th-T混合反应后的荧光值比单独的Th-T溶液对照组高近一倍,而当Aβ1-42与橄榄苦苷孵育后,其Th-T荧光值呈剂量依耐性地降低,与单独的Aβ1-42相比较***P<0.001。结果表明12.5 μmol/L、25 μmol/L和50 μmol/L的橄榄苦苷显著抑制Aβ1-42纤维(见图1)。
2.2 橄榄苦苷与Aβ1-42的亲和力 运用生物分子相互作用仪检测目标蛋白与小分子药物的亲和力是目前直接而先进的药物筛选手段。曲线图所示(见图2A),橄榄苦苷从12.5 μmol/L到400 μmol/L与Aβ1-42结合呈现浓度梯度趋势。为曲线拟合状态(见图2B)。稳态分析结果显示其平衡离解速率常数(KD)值为249 μmol/L,结合速率常数(Kon)为90.5,解离速率常数(Koff)为3.03,说明橄榄苦苷与Aβ1-42有较好的结合效果,具有较强的亲和力。
2.3 橄榄苦苷的细胞毒性及对Aβ1-42诱导的Neuro-2a细胞的幸存率的影响 MTT结果显示,橄榄苦苷从3.125 μmol/L到400 μmol/L对Neuro-2a有极小的毒性,并且在高剂量显示具有促进细胞增殖作用。选取12.5 μmol/L、25 μmol/L和50 μmol/L的橄榄苦苷对Aβ1-42诱导的Neuro-2a细胞进行干预,镜下观察结果显示,Aβ1-42导致Neuro-2a细胞形态发生变化,不规则,并且细胞间隙稀疏,表明有细胞死亡。橄榄苦苷对损伤的细胞形态有显著的改善作用,并且提高Aβ1-42诱导的Neuro-2a细胞的幸存率,与Aβ1-42相比较***P<0.001(见图3A~C)。
2.4 橄榄苦苷对Aβ1-42诱导的Neuro-2a细胞的凋亡的影响 流式结果分析表明,空白对照组仅有极少的细胞出现凋亡,凋亡率为(1.74±0.521)%;而Aβ1-42诱导的Neuro-2a细胞有大量的细胞凋亡(36.13±4.14)%;橄榄苦苷低、中、高剂量处理的细胞,其凋亡率分别为(28.5±2.44)%、(14.24±2.30)%及(8.21±2.01)%。与单独的Aβ1-42相比较*P<0.05或***P<0.001(见图4A、B)。
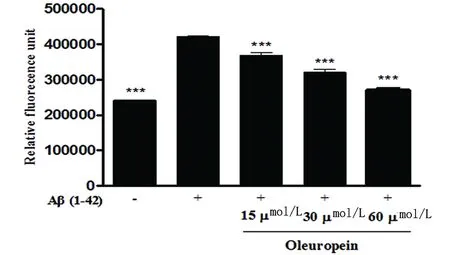
图1 橄榄苦苷对Aβ1-42纤维的抑制效应
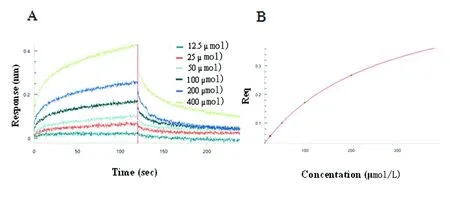
A:不同浓度的橄榄苦苷与Aβ1-42动态结合和解离图;B:橄榄苦苷与Aβ1-42结合的稳态分析曲线拟合
图2 橄榄苦苷与Aβ1-42的亲和力
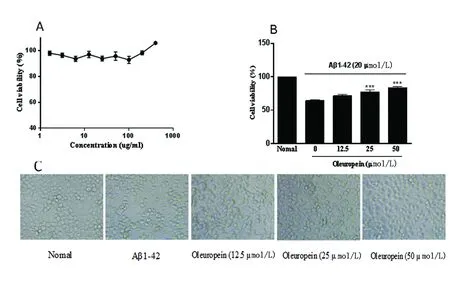
A:橄榄苦苷的细胞毒性;B:橄榄苦苷对Aβ1-42诱导的Neuro-2a细胞的幸存率的影响;C:各组细胞形态变化
图3 橄榄苦苷的细胞毒性及对Aβ1-42诱导的Neuro-2a细胞的幸存率的影响

A:各组流式细胞图;B:橄榄苦苷降低Aβ1-42诱导的Neuro-2a细胞的凋亡率
图4 橄榄苦苷对Aβ1-42诱导的Neuro-2a细胞凋亡的影响
3 讨 论
在阿尔茨海默病的发生发展过程中,β淀粉样蛋白一直是发病机制的主流学说。新近的研究显示,在AD患者出现症状的二十几年前,患者的大脑中已开始出现Aβ的聚集[7],这也是诸多针对Aβ靶点的药物在临床试验失败的一大因素,但也同时更加说明Aβ在AD的预防和治疗中的重要性。Aβ的聚集激活小胶质细胞和星型胶质细胞,影响轴突重塑;引起氧化应激反应,氧自由基释放,促使线粒体损伤,继而引起细胞凋亡的发生;促进tau蛋白的磷酸化,使神经纤维缠结形成,导致神经元的丢失。诸多损伤因素形成复杂的瀑布式级联反应,使患者最终出现记忆功能损伤[8,9]。
Aβ是淀粉样前体蛋白(amyloid precursor protein,APP)依次经β-分解酶和γ-分解酶水解而形成的一个多肽家族。APP另一非Aβ途径为sAPPα,由α分解酶作用产生。研究表明,橄榄苦苷能够抑制tau纤维的形成[10],并且促进APP的α分解酶途径从而可能减少Aβ的产生[11]。这为我们的实验提供了理论和实践基础。Aβ多肽家族中,Aβ1-42最易聚集且最具毒性,在AD患者脑中含量较高[12],因此被作为AD模型的首选。Aβ聚合有多种形式,包括单聚体、多聚体、纤维等,Th-T作为测定Aβ纤维的经典方法,已被广发运用于针对Aβ靶点的药物筛选[13,14]。因此,本实验以Aβ1-42为靶点,通过传统的Th-T荧光测定证明橄榄苦苷具有降解Aβ纤维的能力。生物膜层干涉(biolayer interferometry,BLI) 技术是一种基于光干涉原理的非标记技术,通过该技术计算出分子间的亲和力,从而确认分子间的相互作用。该技术操作简单、所需样品量少、具有实时提供被分析物的相互作用等优势[15],因此被广泛用于蛋白与小分子亲和力的测定以及抗体筛选等。本实验通过该技术进一步确认了橄榄苦苷与Aβ1-42有良好的亲和力,明确橄榄苦苷作为抗Aβ药物的可能性。在此基础上,我们发现橄榄苦苷能够降低Aβ1-42诱导的Neuro-2a的细胞毒性,提高细胞幸存率,并保护Aβ1-42诱导的细胞凋亡,进一步验证了橄榄苦苷在AD治疗的潜在可能性。
总之,我们目前的研究支持橄榄苦苷作为治疗阿尔茨海默病的潜在药物。这是对橄榄叶天然成分的新的探索,并将有助于废物的循环利用。然而橄榄苦苷在AD治疗的机制有待进一步探索。

