消旋-3-正丁基苯酞对溴化乙锭诱导脱髓鞘模型作用及其机制研究
董 乐, 吴月娟, 黄 琪, 廖宇晗, 韦 雷, 吴 原
髓鞘由蛋白质层和磷脂层构成,髓鞘碱性蛋白(MBP)是中枢神经系统(CNS)髓鞘的主要蛋白质,位于髓鞘浆膜面,维持CNS髓鞘结构和功能的稳定,具有神经组织特异性[1]。研究表明少突胶质细胞(oligodendrocytes,OLs)缺失是脱髓鞘疾病的核心机制[2,3]。OLs起源于胚胎发育的早期阶段,主要位于侧脑室(LV)、第四脑室的室下区(SVz)和脊髓神经管腹侧[4,5]。人们认为线粒体功能障碍和细胞凋亡可能在脱髓鞘过程中发挥更大的作用[6],消旋-3-正丁基苯酞(dl-3-n-Butylphthalide,NBP)可改善脱髓鞘的症状[7]。可能的机制是通过抗细胞凋亡作用保护髓鞘[8]。本研究通过注射溴化乙锭(ethidium bromide,EB)至SD大鼠侧脑室中制作脱髓鞘模型,给予NBP干预,观察大鼠的脱髓鞘程度和病理学改变,探讨NBP在脱髓鞘病变中的作用机制,为临床治疗提供依据。
1 材料与方法
1.1 材 料
1.1.1 实验动物及分组 正常成年健康雄性Sprague-Dawley大鼠36只(9~10周龄,体重200~250 g,SPF级),由广西医科大学实验动物中心提供。所有大鼠在室温22 ℃~25 ℃的自然光照下进行湿度控制的室内饲养,并自由进食和饮水。并随机分为3组:EB组(n=12)、NBP组(n=12)和假手术组(n=12)。
1.1.2 主要试剂 兔抗鼠MBP多克隆抗体、兔抗鼠cytochrome C多克隆抗体、兔抗鼠caspase-9多克隆抗体购于美国Abcam公司;辣根过氧化物酶标记山羊抗兔二抗购于碧云天公司;胞浆蛋白抽提试剂盒、ECL化学发光试剂盒、免疫组织化学试剂盒、LFB髓鞘染色试剂盒、DAB显色试剂盒购于索莱宝公司。
1.2 方 法
1.2.1 EB诱导脱髓鞘模型的建立 所有大鼠腹腔注射10%水合氯醛(3 ml/kg)麻醉,固定于立体定位仪。EB组和NBP组:用微量注射器以3 μl/min的速度把5 μl 浓度为0.05%的溴化乙锭溶液通过直接单次注射的方式注射至右侧侧脑室,并留针5 min以保证药物充分弥散。具体坐标为(AP=-0.6;ML=+1.3;DV=-3.8)。假手术组:通过相同的方法注射5 μl生理盐水。缝合头皮,复温苏醒后回笼饲养。NBP组中的大鼠以腹腔注射的方式给予NBP干预,剂量为20 mg/(kg·d),EB组和假手术组以相同的方式注射相同量的生理盐水。
1.2.2 动物取材和石蜡切片的制备 各组大鼠在14 d后用10%水合氯醛麻醉,打开胸腔暴露心脏,经左心室快速灌注生理盐水,后改用4%多聚甲醛灌注进行前固定,然后断头取脑放于4%多聚甲醛进行后固定。常规石蜡包埋,进行3 μm连续冠状位切片。
1.2.3 牢固蓝(LFB)染色 常规脱蜡至水,95%酒精稍洗;Luxol Fast Blue染液室温过夜,95%酒精清洗,蒸馏水冲洗,分化液分色15 s,蒸馏水冲洗,伊红复染,蒸馏水冲洗,酒精脱水,二甲苯透明,中性树胶封片,光学显微镜下观察照相。通过脱髓鞘评分标准对各组大鼠进行脱髓鞘评分:正常髓鞘结构无脱髓鞘1分;轻度或轻度脱髓鞘(保留>50%髓磷脂染色)2分;重度脱髓鞘改变(髓鞘染色<50%保存)3分。记录各组分值。
1.2.4 HE染色 切片常规脱蜡至水;苏木素染色5 min,水洗10 min;1%盐酸酒精30 s,水洗30 s;0.5%伊红液染色3 min,蒸馏水洗30 s;酒精脱水、二甲苯透明、中性树胶封片,光学显微镜下观察照相。
1.2.5 Tunel法 常规脱蜡至水,PBS洗;蛋白酶K工作液37 ℃孵育,PBS洗;Tunel 反应混合液孵育,PBS洗;POD工作液孵育,PBS洗。DAB显色,酒精脱水,二甲苯透明,中性树胶封片,光学显微镜下观察照相。选择5个具有代表性的视野,计数阳性细胞数和阴性细胞数,并计算阳性表达百分率[阳性表达百分率=阳性细胞数/(阳性细胞数+阴性细胞数)×100%]。
1.2.6 免疫组织化学染色 常规脱蜡至水,PBS洗;0.3%H2O25 min,PBS冲洗后,放入柠檬酸缓冲液中进行高压抗原修复20 min,取出,室温下自然冷却至35 ℃以下,PBS洗;正常羊血清室温10 min;兔抗鼠MBP多克隆抗体(1∶200)、兔抗鼠Cyt C多克隆抗体(1∶5000)、兔抗鼠caspase-9多克隆抗体(1∶500)室温30 min、4 ℃冰箱过夜、室温复温30 min, PBS洗;二抗37 ℃孵育60 min, PBS洗;DAB显色;酒精脱水,二甲苯透明,中性树胶封片,光学显微镜下观察照相。免疫组织化学染色结果用Image Pro plus图像分析软件测定积分光密度(integral optical density,IOD)值和阳性面积(area)。计算出各组平均光密度(IOD/area)并记录。
1.2.7 Western blot 取脑白质组织200 mg,依据胞浆蛋白抽提试剂盒说明书提取胞浆蛋白,煮沸变性,取50 μg蛋白,变性后行聚丙酰胺凝胶电泳,转至硝酸纤维膜,TBST液洗3次,5%脱脂奶粉室温封闭1 h,TBST液洗3次,入兔抗鼠MBP(1∶500)或Cyt C抗体(1∶250),4 ℃过夜,TBST液洗3次,加入辣根过氧化酶结合的抗兔IgG(1∶4000),TBST液洗3次,ECL化学发光试剂检测,X线片显影。采用条带图像分析系统测定各条带灰度值。并以Image J软件进行半定量分析,结果以相对光密度值×面积表示。蛋白的相对含量=目的蛋白条带/β-tubulin条带。记录各组结果。

2 结 果
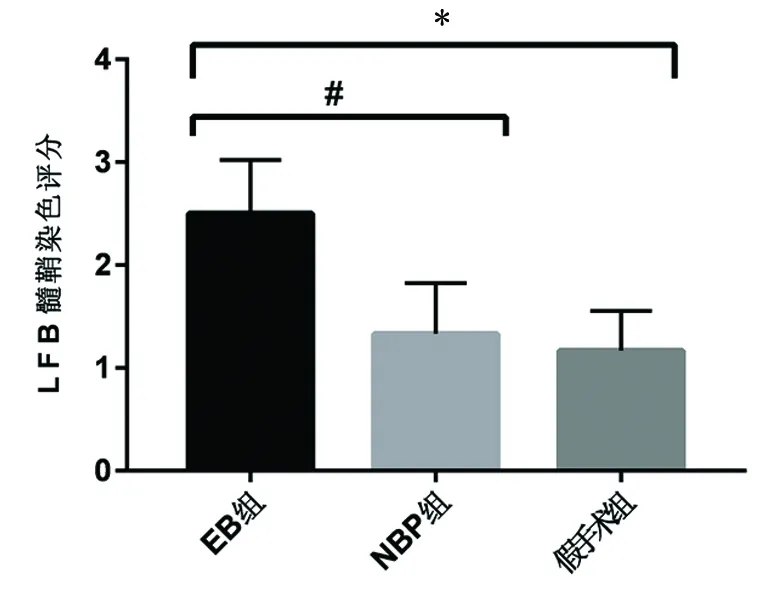
2.1 髓鞘LFB染色结果 假手术组灰质、白质界限明显,染色深且均匀,髓鞘结构清晰、无脱失。与假手术组相比,EB组可见大小不等片状髓鞘脱失,甚至出现大片的空泡变性脱失区域,NBP组蓝色髓鞘区域相对完整,空泡变性区域相对减少(见图1);与假手术组相比,EB组的LFB脱髓鞘评分明显高于假手术组(P<0.05);与EB组相比, LFB脱髓鞘评分明显低于EB组P<0.05) (见图2)。
2.2 HE染色结果 假手术组细胞排列整齐有序,组织排列致密,形态结构正常,染色清晰;与假手术组相比,EB组组织排列紊乱,炎性细胞浸润,白质结构松散、破坏;NBP组的无明显的结构破坏,但结构较假手术组松散,存在少量空泡(见图1)。
2.3 Tunel 法染色结果 EB组可见大量凋亡细胞,凋亡细胞数明显高于假手术组,NBP组凋亡细胞较EB组减少(见图1)。与假手术组相比,EB组凋亡细胞阳性表达百分率高于假手术组(P<0.05);与EB组相比,NBP组凋亡细胞阳性表达百分率明显少于EB组(P<0.05)(见图3)。
2.4 免疫组织化学染色结果 与假手术组相比,EB组MBP表达量明显低于假手术组(P<0.05);与EB组相比,NBP组MBP表达量明显高于EB组(P<0.05);与假手术组相比,EB组caspase-9表达量明显高于假手术组(P<0.05);与EB组相比,NBP组caspase-9表达量明显低于EB组(P<0.05)(见图4)。
2.5 Western blot结果 与假手术组相比,EB组MBP表达水平显著低于假手术组(P<0.05);与EB组相比,NBP组MBP表达高于EB组(P<0.05);与假手术组相比,EB组Cyt C表达水平显著高于假手术组(P<0.05);与EB组相比,NBP组Cyt C表达水平低于EB组(P<0.05) (见图5)。

图1 各组大鼠脑白质区HE染色、LFB染色、TUNEL染色(10×40)
与假手术组相比*P<0.05;与EB组相比#P<0.05
图2 LFB染色检测各组大鼠脑白质脱髓鞘程度

与假手术组相比*P<0.05;与EB组相比#P<0.05
图3 TUNEL染色法检测各组大鼠脑白质阳性表达百分率

与假手术组相比*P<0.05;与EB组相比#P<0.05
图4 免疫组织化学法检测各组大鼠脑白质MBP、Cyt C的表达(10×40)

与假手术组相比*P<0.05;与EB组相比#P<0.05
图5 Western blot 法检测各组大鼠脑白质MBP、Cyt C的表达
3 讨 论
EB诱导脱髓鞘模型是由Yajima和Suzuki在1979年研发出来,主要用于研究局灶性脱髓鞘疾病。既往研究发现,在2~4 w内该模型可以在目的区域产生明显脱髓鞘病变,并且可见OLs死亡。OLs和星形胶质细胞丢失都是EB诱导脱髓鞘病变中心的标志[9]。建立EB诱导脱髓鞘模型后72 h内出现OLs死亡[10]。Mahdi Goudarzvand等指出EB具有诱导细胞凋亡的作用[11]。证明这个模型的稳定性。
MBP是特异性表达于髓鞘具有抗原性的蛋白质,是髓鞘蛋白的主要成分[12]。主要分布在胼胝体、海马、以及小脑和皮质下区域。因此,MBP也被认为是成熟髓鞘的标志性蛋白[12]。只有成熟的OLs大量表达MBP,才有对轴突髓鞘化的能力[13],脱髓鞘病变时,病变区髓鞘崩解脱失,组织结构松散,炎性细胞浸润, MBP表达减少。本实验在EB侧脑室注射后14 d, EB组出现髓鞘淡染,髓鞘崩解,髓鞘脱失;组织结构松散,神经纤维紊乱,炎性细胞浸润,MBP表达减少。与EB组相比,NBP组髓鞘染色深染,髓鞘相对完整,髓鞘脱失减轻。组织结构完整,纤维排列整齐,炎症细胞减少。NBP组MBP表达增高,表明EB诱导CNS脱髓鞘模型建立成功,而且NBP能够减轻组织脱髓鞘和炎症反应,保护髓鞘完整。
在CNS内,正常的轴突运输过程和神经元存活依赖于适当的髓鞘形成[14]。有髓神经纤维的髓鞘由OLs的突起形成。在脱髓鞘过程中存在大量OLs凋亡[15],对12例因急性复发而死亡的MS患者早期病变形成的研究显示,在没有外周免疫细胞浸润的情况下,病变包含广泛的OLs凋亡[16],因此,抑制OLs凋亡过程能够有效减轻脱髓鞘程度。Cyt C是12.3 kDa,核DNA编码的蛋白质。在细胞质中游离核糖体合成[17]。Cyt C正常时位于线粒体内外膜之间,不能通过线粒体外膜进入胞浆,脱髓鞘病变时,OLs线粒体功能障碍,线粒体通透性转换孔(PTP)开放[18]。持续的病理性PTP开放诱导胞质流入线粒体基质,导致线粒体膜电位的丧失和离子梯度的失衡,膜电位去极化促进线粒体基质扩张,线粒体肿胀和膜破裂,导致Cyt C释放[19]。Cyt C从线粒体释放到胞质,此为线粒体介导凋亡途径的关键步骤,与Apaf 1、ATP/dATP结合形成凋亡体,Apaf 1通过分子中的胱天蛋白募集域(CARD)与caspase-9前体原域中的CARD相互作用而募集caspase-9前体,caspase-9前体自我激活后活化下游的caspase-3,引起OLs细胞凋亡[20]。EB组CNS存在大量细胞凋亡,而且Cyt C、caspase-9细胞质表达明显上调,这些都表明在EB诱导的CNS脱髓鞘模型中,存在OLs线粒体介导的细胞凋亡。与EB组相比,NBP组Cyt C、caspase-9表达减少,凋亡细胞明显减少,表明NBP可以有效减少EB模型中Cyt C释放,抑制caspase-9的表达,抑制OLs内线粒体途径凋亡途径,维持OLs生理功能和髓鞘的完整。本实验证实NBP对EB诱导的CNS脱髓鞘有保护作用。可能与抑制OLs内线粒体介导的内源性凋亡有关。

