新疆塔城牧区原料乳中酵母菌的分离鉴定
芦文娟, 李宝坤, 卢士玲, 李开雄, 王晓雯, 杜紫萱
(石河子大学 食品学院,新疆 石河子832000)
原料乳营养丰富,适宜人类食用,但其较高的水分含量和接近中性的pH值也非常适合细菌、酵母菌、霉菌等各种微生物的生长和繁殖[1]。这些菌群有的可以使乳及乳制品产生理想风味,有的则会引起乳及乳制品的腐败变质,甚至使人类产生疾病[2]。其中当属乳源酵母菌最为典型。
原料乳中的酵母菌是乳制品中酵母菌的主要来源之一,很多乳制品均以原料乳为原料加工而成,其中的酵母菌赋予了产品特殊风味和提高了产品的营养价值[3]。20世纪初,研究学者认为酵母菌仅作为一种腐败菌存在于原料乳中,使乳制品品质下降如出现产气、酵母味或其他异味、变色和引起质构变化等[4-6],故对原料乳中的酵母菌研究较少。近年来,全球乳业迅速发展,科研人员把重点集中在酵母菌在乳制品中的有益作用方面,不断发现酵母菌作为附属发酵剂对乳制品风味的影响、抑制有害菌及对人体的益生作用[7-8],如:预防和治疗急性痢疾、降低胆固醇、抗辐射和抗氧化等[9]。因此,从原料乳中筛选出有益酵母菌,并应用于乳制品中具有重要意义。
然而各种自然环境的差异使得微生物资源存在差异,作者将首次对塔城周边游牧地区原料乳中的酵母菌进行研究,运用传统培养方法分离筛选酵母菌,并进行生理生化鉴定和5.8S rDNA-ITS分子生物学鉴定,对原料乳中酵母菌的分布和种类的多样性进行分析,为后人研究本地区原料乳中微生物菌群提供基础资料,并对后续筛选具有潜在益生功能的酵母菌株奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 样品来源 新疆塔城地区原料乳:采自新疆塔城喀拉也木勒、乌宗布拉克、二道桥牧场等地。
1.1.2 培养基 菌种的分离使用马铃薯葡萄糖琼脂培养基(PDA),纯化和保存使用酵母膏胨葡萄糖琼脂(YEPD)平板和斜面培养基。
鉴定使用Gorodkowa琼脂培养基、氮源基础培养基、碳源基础培养基、糖发酵基础培养基、产酸基础培养基、产酯培养基、产类淀粉培养基。
1.1.3 主要试剂和仪器 酵母菌基因组DNA提取试剂盒(离心柱型),2xTaq PCR MasterMix:均由天根生化科技有限公司提供;GoldView核酸染色剂;引物ITS1和ITS4:由上海生工生物技术有限公司合成。
主要仪器:超净工作台、电热恒温培养箱(DNP-9272)、高速冷冻离心机(5417R)、立式电热压力蒸汽灭菌锅 (LD2X-30KA)、普通光学显微镜(OLYMPUS COVER-015)、PCR 扩增仪(TC-512)。
1.2 实验方法
1.2.1 酵母菌的分离与纯化 取1 g样品,溶于9 mL无菌水中,充分振荡使其混匀后置于25℃培养箱,培养1 h后吸取1 mL接种于酵母浸出粉胨葡萄糖培养基(YPD)中进行活化,25℃培养36 h。活化后菌株采取稀释法涂于PDA培养基进行分离,平板置于25℃培养箱中培养,观察并记录菌落特征并挑取不同形态单菌落,进行简单染色,观察细胞形态,将类似酵母菌菌株接种于PDA培养基中培养,重复几次纯化酵母菌,直至镜检结果为同一细胞形态后,将其接种于YEPD斜面培养基上,25℃培养36 h后,4℃保存备用。
1.2.2 酵母菌的形态结构观察 将上述纯培养菌株接种于PDA培养基,25℃培养36 h后,挑选单个菌落观察其形状、色泽、光滑度、透明度、边缘整齐度和隆起程度等特征;并选择具有代表性的菌株,置于显微镜下观察其菌体形态。
1.2.3 酵母菌的理化性质鉴定 酵母菌分离株的生理生化特征主要是对其繁殖方式、子囊孢子、掷孢子、菌丝等进行观察、并通过糖发酵实验、碳源同化实验、氮源同化实验、类淀粉化合物生成实验、产酯实验、产酸实验等生理生化实验进行鉴定[10-11]。
1.2.4 酵母菌的5.8S rDNA分析
1)酵母菌基因组DNA的提取:将上述纯化的酵母菌接种于YPD液体培养基中25℃培养36 h,取1 mL活化菌悬液,按照酵母菌基因组DNA提取试剂盒(离心柱型)说明书上方法进行操作,将所提取的DNA于-20℃保存。
2)PCR 扩增(5.8S rDNA-ITS 片段扩增):将上述制备的基因组DNA作为PCR扩增的模板,使用引物 ITS 1(5’-TCCGTAGGTGAACCTGCG G-3’)和ITS 4 (5’-TCCTCCGCTTATTGATATGC-3’)[12]对5.8S-ITS区域酵母菌DNA进行扩增;采用50 μL反应体系:DNA 模板 2 μL,ITS 1(10 μmol/L) 2 μL,ITS 4 (10 μmol/L)2 μL,2xTaq PCR MasterMix 25 μL,加ddH2O 补至 50 μL。
PCR反应循环条件:95℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min,循环次数35次;72℃延伸10 min。
PCR产物经1%的琼脂糖凝胶检测。电泳后,用GoldView染色20 min,紫外灯下观察,拍照。
3)扩增产物测序及系统发育分析:PCR产物经电泳检测合格后,送往上海生工生物工程技术有限公司进行测序,测得的序列在NCBI数据库中进行同源序列搜索,从数据库获得相关种属的5.8S rDNA基因序列,采用软件Mega5.0中的Neighbor-Joining方法与标准菌株基因序列进行比对,进行1 000次Bootstrap检验后构建系统发育树。
2 结果与分析
2.1 酵母菌的分离结果
采用传统分离培养的方法,从采集的7份原料乳样品中,共得到33株酵母菌,结果见表1。
2.2 酵母菌的形态鉴定结果
酵母菌在经YEPD培养基活化后,观察菌落形态和在普通光学显微镜下观察细胞形态。酵母菌菌落形态呈圆形或椭圆形,乳白色或淡黄色,表面光滑或干燥,边缘整齐,表面凸起,呈现半透明状或不透明。细胞形态为圆、椭圆、卵圆等,繁殖方式多为无性繁殖,且无菌丝或有假菌丝,细胞形态符合酵母菌特征。酵母菌的菌落形态结果见表2,细胞形态和繁殖方式见表3。
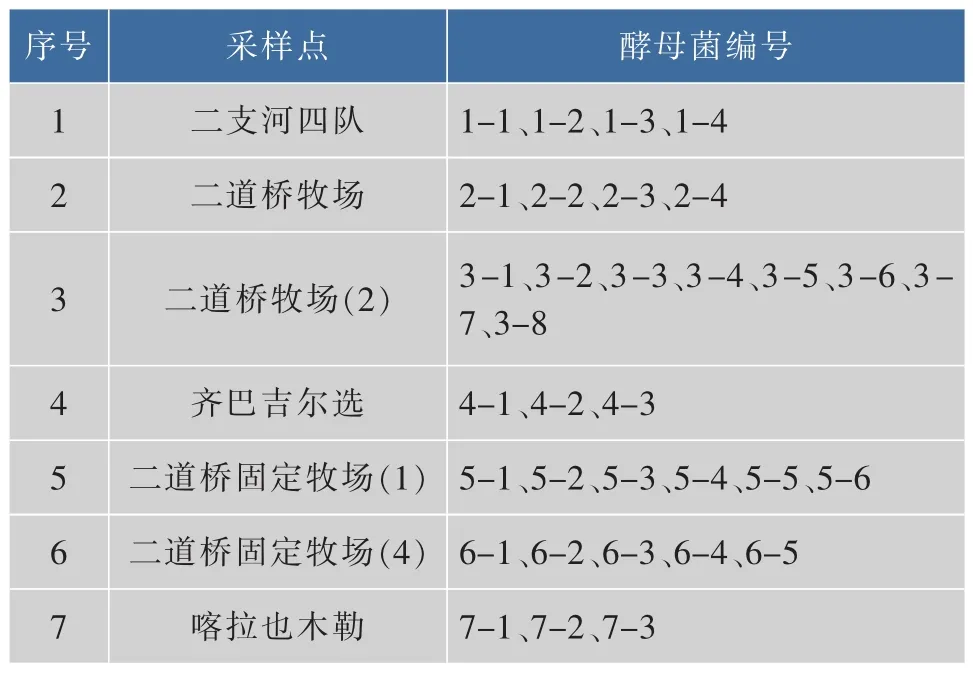
表1 采样点及分离酵母菌株编号Table 1 Sample and Isolation of yeasts number
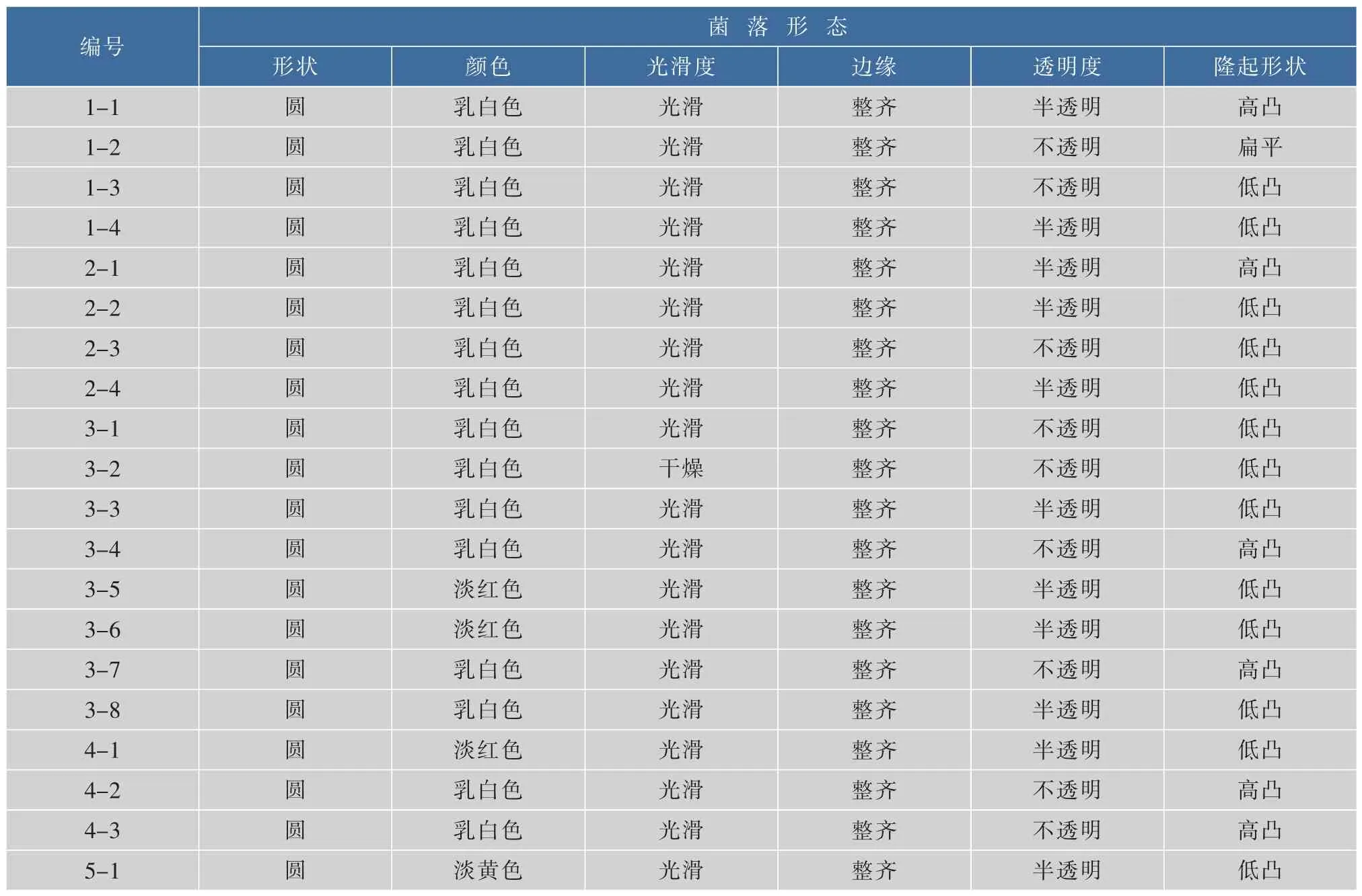
表2 酵母菌的菌落形态结果Table 2 Yeast colony morphology results
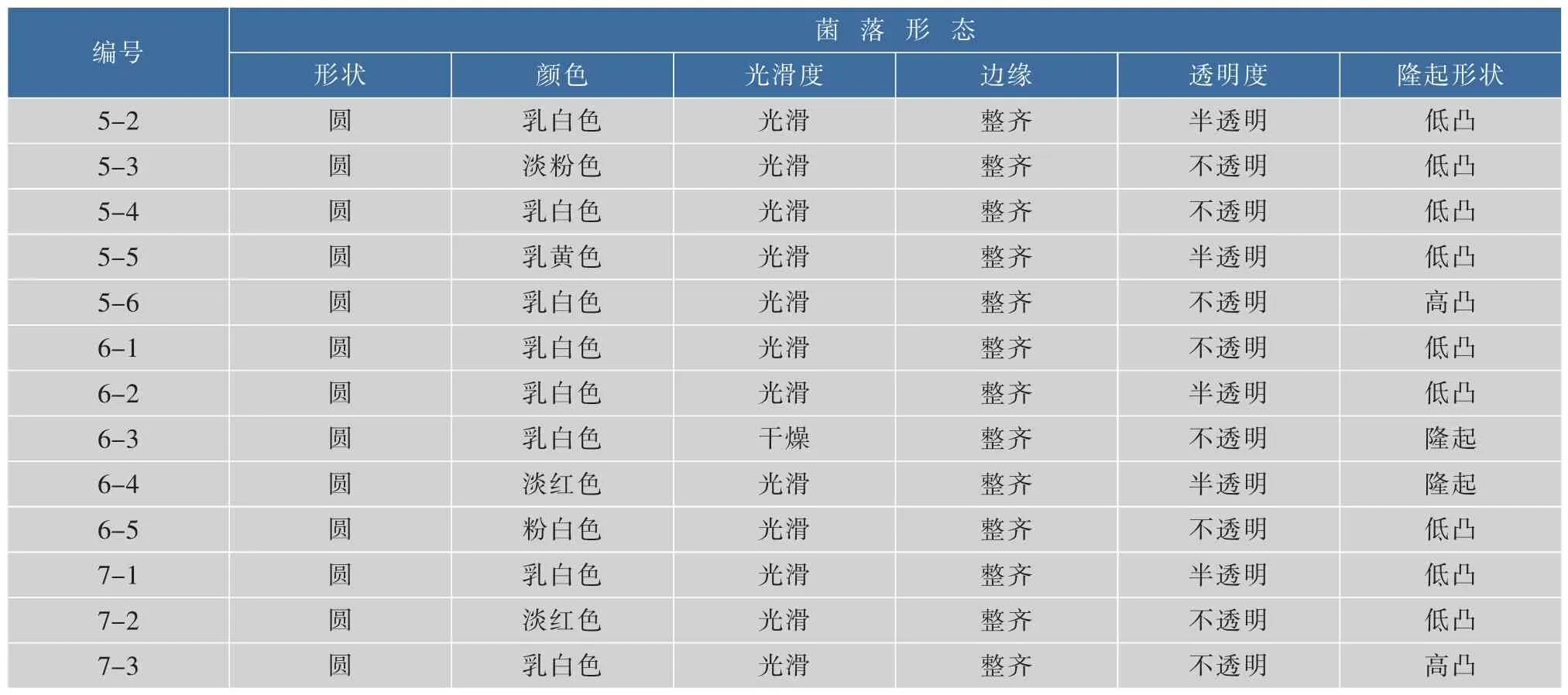
续表2
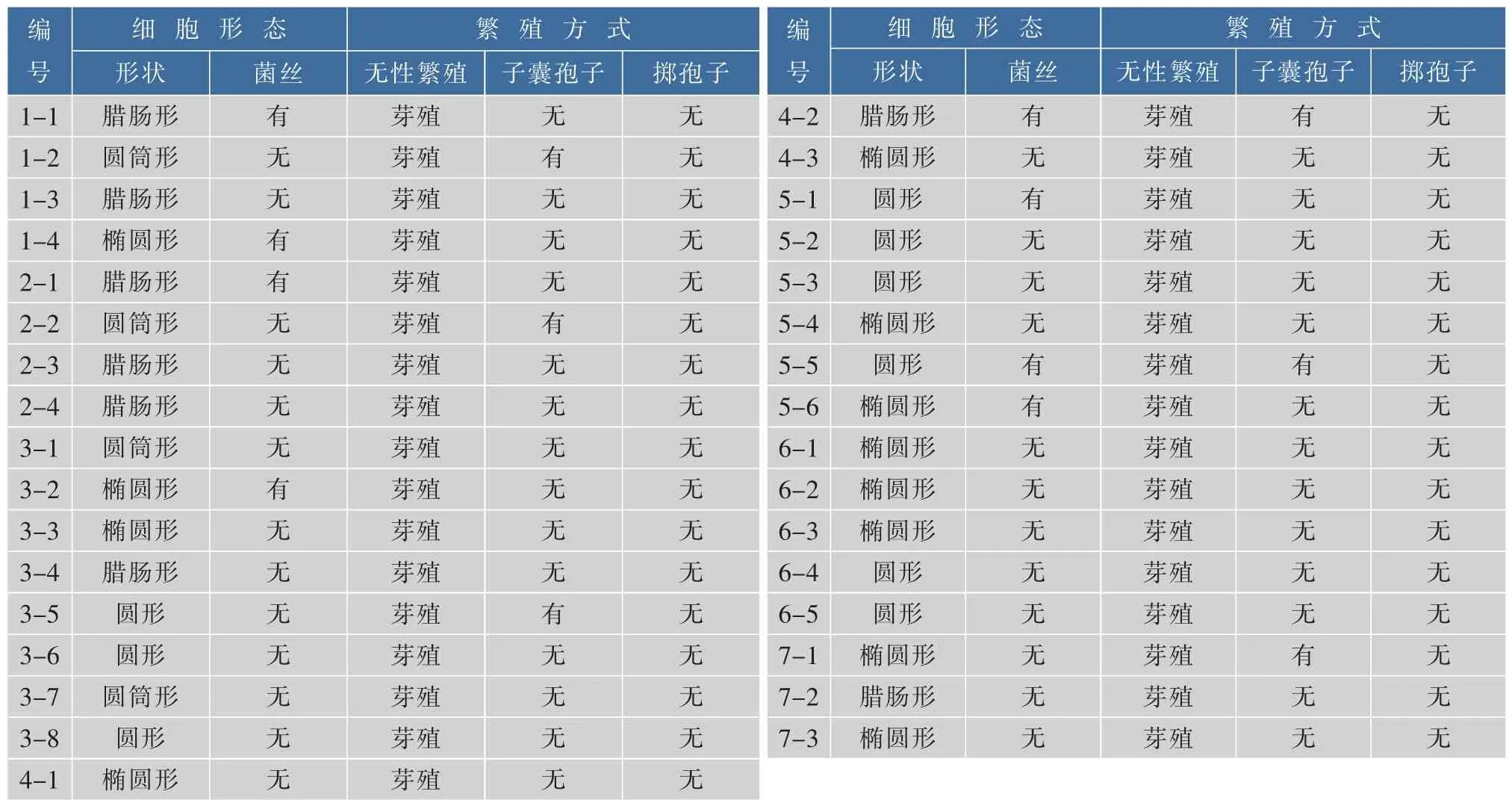
表3 酵母菌细胞形态和繁殖方式Table 3 Yeast cell morphology and reproductive modes
2.3 酵母菌的理化性质鉴定结果
依据《酵母菌的特征与鉴定手册》,对酵母菌进行鉴定,结果发现,大多数分离株均为芽殖,有些有假菌丝,在发酵实验中除葡萄糖发酵外不发酵其他被检糖,在碳源同化实验中可同化乙醇和柠檬酸,氮源同化实验中不能同化硝酸盐,属于毕赤氏酵母属;部分分离株如分离株5-3、5-4、6-5,葡萄糖发酵阳性,硝酸盐还原、类淀粉物质的生成试验阴性,归为梅奇酵母属;还有部分菌株仅依据生理生化鉴定结果,无法对其种属进行判断。酵母菌的理化性质鉴定结果见表4,碳源、氮源同化鉴定结果见表5。
2.4 酵母菌的5.8S rDNA鉴定
2.4.1 酵母菌株5.8S rDNA琼脂糖凝胶电泳检测PCR扩增结果 对酵母菌菌株进行分子生物学鉴定,PCR扩增产物经琼脂糖凝胶电泳检测后,在450~750 bp之间获得特异性扩增条带,符合酵母菌5.8S rDNA区理论预期值,检测结果见图1。

表4 酵母菌的理化性质鉴定结果Table 4 Physiological and biochemical properties of yeasts

表5 碳源、氮源同化鉴定结果Table 5 Carbon assimilation and nitrogen assimilation experiment results
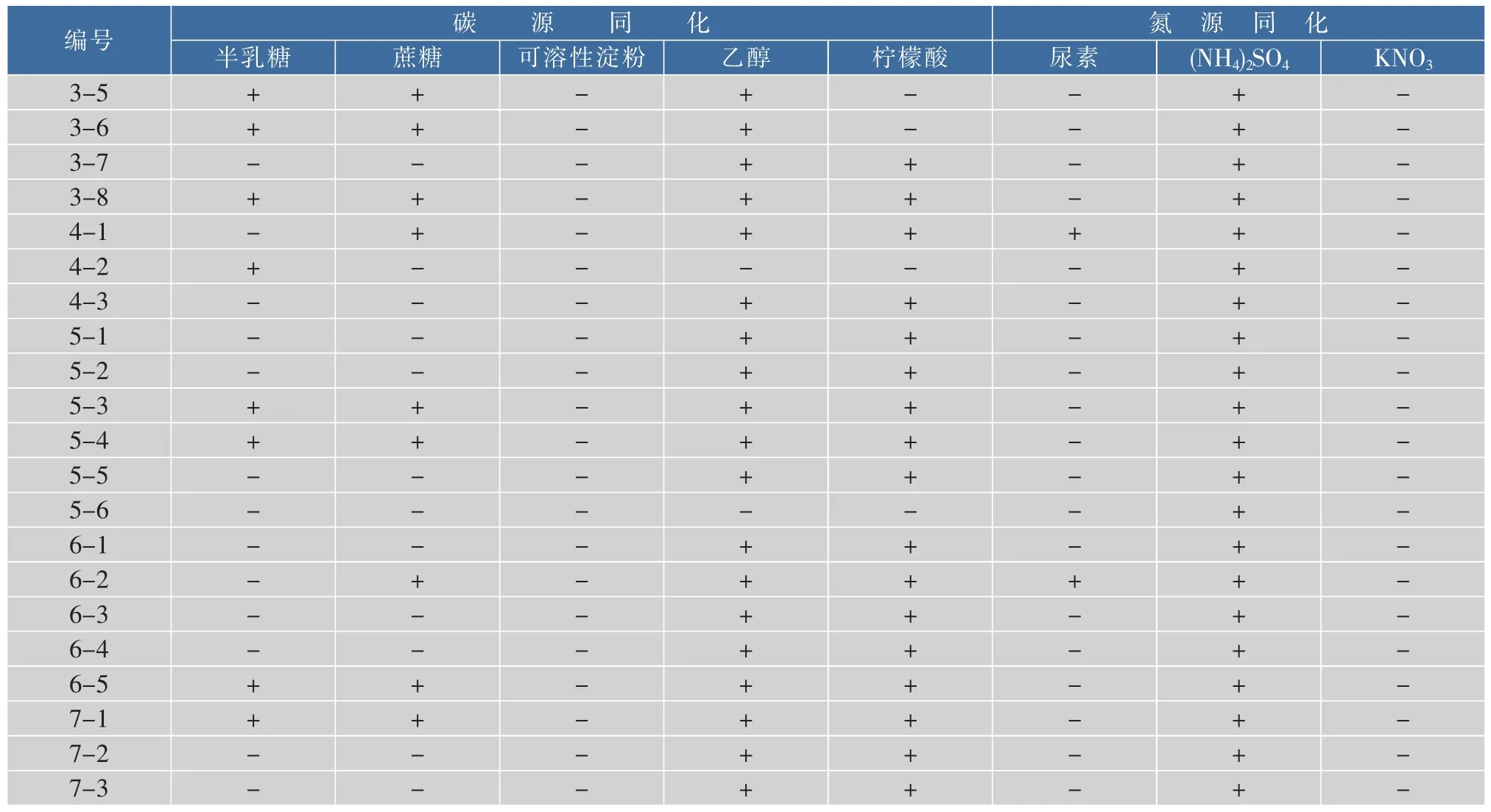
续表5
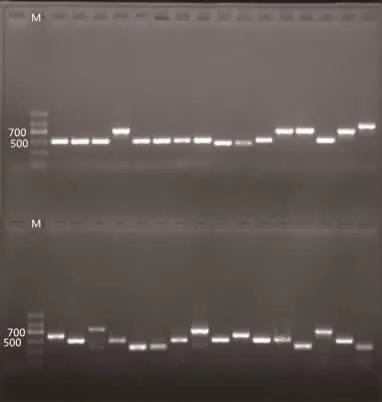
图1 酵母菌PCR产物电泳图Fig.1 Agarose gel electrophoresis of PCR products from yeasts
2.4.2 基于5.8S rDNA基因序列的酵母菌株系统发育分析 酵母菌序列经过在NCBI序列数据库中进行序列搜索,比较分离出的酵母菌菌株与已知酵母菌菌株相应序列的相似程度,总结33株分离酵母菌的分子生物学鉴定结果见表6。
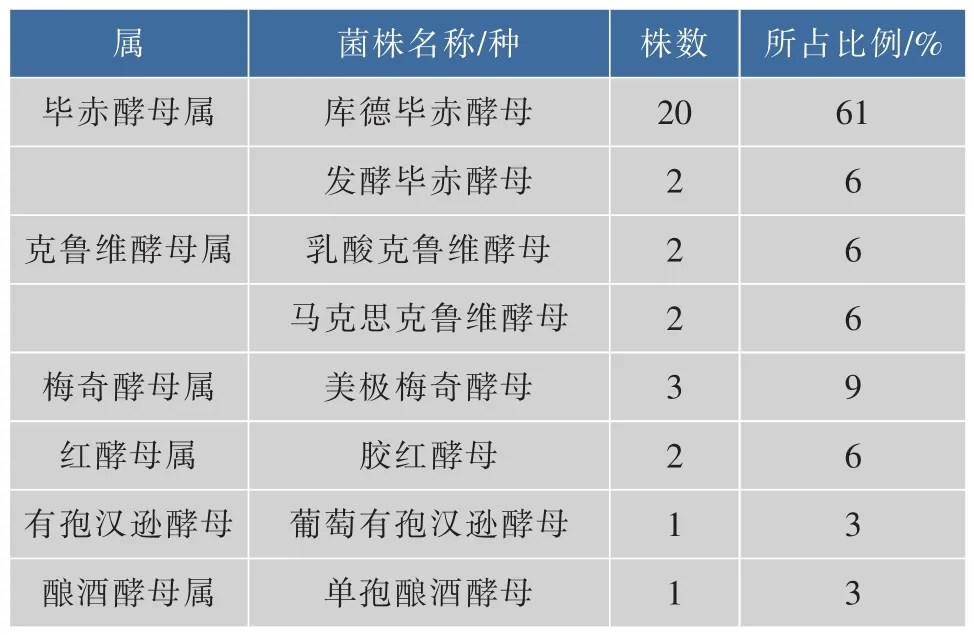
表6 33株酵母菌的ITS序列鉴定结果Table 6 ITS sequence of 33 strains yeast identification results
从中挑选出生长较为旺盛、生理生化特征典型、具有代表性的17个分离株的序列与标准菌株序列做系统发育进化树,基于ITS区序列构建的系统发育树,见图2。
由图2可知,分离株1-4与标准菌株的同源性为93%,根据酵母菌种类的划分依据,同源性低于98%的,不能归为同一个种[13],因此对于菌株1-4的种类有待进一步验证。其余所有分离菌株与之对应的标准菌株的同源性均在98%及以上,并与之聚在一起,表明其具有较近的亲缘性。
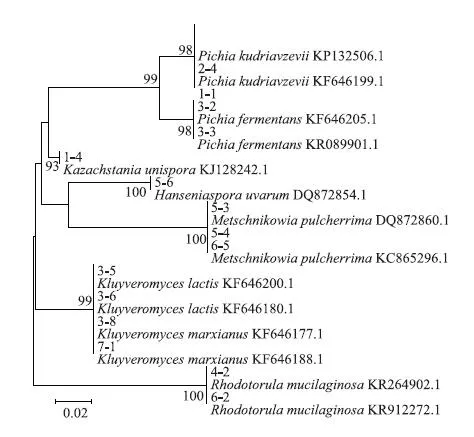
图2 系统发育树Fig.2 Phylogenetic tree
3 结 语
作者对新疆塔城地区原料乳中的酵母菌进行分离鉴定,从采集的7份样品中,经过菌种的分离纯化,共得到33株酵母菌,通过形态学观察、传统生理生化试验和对5.8S ITS区间进行PCR扩增相结合的方法成功的将其鉴定到种。其中,菌株1-4单孢酿酒酵母(Kazachstania unispora);菌株 3-2、3-3 为发酵毕赤酵母(Pichia fermentans);菌株 3-5、3-6为乳酸克鲁维酵母(Kluyveromyces lactis);菌株3-8、7-1为马克思克鲁维酵母(Kluyveromycesmarxianus);菌株 4-2、6-2 为胶红酵母(Rhodotorula mucilaginosa); 菌株 5-3、5-4、6-5 为美极梅奇酵母(Metschnikowia pulcherrima);菌株 5-6 为葡萄有孢汉逊酵母(Hanseniaspora uvarum);其余全部为库德毕赤酵母(Pichia kudriavzevii)。
综上看来,同一牧区不同牧民家庭的原料乳中分离得到的酵母菌的种类和数量存在一定差异性,如2号样品和3号样品,这可能是因为原料乳存在的环境不同,因为乳源酵母大多数来自原料乳环境及加工设备与周围环境[14]。但采集自不同牧区的原料乳样品中,所含的优势菌群是相同的,均为库德毕赤酵母(Pichia kudriavzevii),而根据他人研究,原料乳中的酵母菌主要是Candida catenulata、Candida pararugosa、Candida rugosa[15]等。 王冠群[16]等人对塔城部分地区传统发酵乳制品中酵母菌进行分离鉴定,结果表明,Issatchenkia orientalis为第二优势菌群,而根据Kurtzman等人[17]研究,已将Issatchenkia属归入Pichia属,由于P.orientalis已经存在,Iss.orientalis在归入Pichia属中后要一个新的种名,所以使用P.kudriavzevii来代替它,由此本研究与前人研究结果相符。但从目前许多对乳制品中酵母菌的研究来看,尚未发现对乳制品中库德毕赤酵母(Pichia kudriavzevii)的详尽报道。并且本研究分离得到的酵母菌的种类和数量关系与其他研究存在较大差异,可能是由于不同地区环境、气候条件、温度、湿度等存在差异,因而引起原料乳中的酵母菌含量和种类的不同。

