Ogataea minuta来源的内切-β-N-乙酰氨基葡糖苷酶的异源表达和纯化
贾元苓, 喜多岛敏彦, 李子杰, 高晓冬, 中西秀树
(江南大学 生物工程学院,江苏 无锡 214122)
糖基化是一种普遍存在于真核生物中的蛋白质翻译后修饰[1],糖链对糖蛋白的生化性质具有重要的作用。随着糖组学的发展,对糖链结构和功能的研究越来越多。然而,天然糖肽和糖蛋白上的糖链结构复杂,并呈现多样性,因而很难从中纯化出带有均一糖链的糖肽或糖蛋白[2]。目前,化学酶合成法尤其是利用内切-β-N-乙酰氨基葡糖苷酶(ENGase)来合成此类糖肽或糖蛋白是发展较快且具有实践意义的方法[3]。
ENGase(EC 3.2.1.96)是一类糖苷酶,其可以水解N糖链上两个N-乙酰葡糖胺 (GlcNAc)之间的β-1-4糖苷键[4]。在CAZY数据库中,ENGases被分成了糖苷水解酶(GH)两大家族,即GH18和GH85[4]。褶皱链霉菌(Streptomyces plicatus)来源的Endo-H(Tarentinoand Maley 1974), 酿 脓 链 球 菌(Streptococcus pyogenes)来源的 Endo-S(Collin and Olsén 2001),里氏木霉(Trichoderma reesei)来源的Endo-T(Stals et al 2010)等都从属于GH18家族,GH85家族的酶包括原玻璃蝇节杆菌(Arthrobacter protophormiae) 来源的 Endo-A (Takegawa et al 1997),肺炎双球菌(Streptococcus pneumoniae)来源的 Endo-D (Muramatsu et al 2001)及冻土毛霉(Mucor hiemalis) 来源的 Endo-M(Fujita,Kobayashi et al 2004)等。与GH18家族不同的是,GH85家族的酶不仅具有糖苷水解酶的活性,同时还具有将糖链转移到GlcNAc受体上的转糖基酶活性[5]。近几年来,ENGases的转糖基活性成为研究的热点。利用该酶的活性合成带有均一糖链的糖蛋白或糖肽,可以用于糖链结构和功能的研究[6-7]。Endo-M和Endo-A都已多次被应用,例如合成了糖基化的将血钙素[8]、带有完整N-糖链的CD52抗原[9]等。但它们也存在着局限性,如Endo-A倾向于识别高甘露型的糖链[10],已经商业化的Endo-M虽作用的底物范围较广,但难获得大量的纯酶[11],价格偏贵。
最近,Murakami等发现Ogataea minuta中存在内切-β-N-乙酰氨基葡糖苷酶(Endo-Om),其从属于GH85家族,不仅可以识别高甘露糖型的糖链同时还可作用于复合型的糖链[12]。Endo-Om是一种胞质蛋白,并且没有被糖基化修饰。因此,我们选用大肠杆菌表达Endo-Om,以期解决ENGase产量低、成本高等问题。
1 材料与方法
1.1 质粒、菌株和培养基
E.coliDH5α:由作者所在实验室保存;BL21(DE3)、BL21 (DE3)pLysS: 均购于博迈德 公 司;pOMEA1-6H3F-Endo-Om、pET 30a: 日本 AIST 提供。
LB培养基:酵母粉5 g,胰蛋白胨10 g,氯化钠10 g,琼脂粉 20 g(固体),加水定容至 1 L,121 ℃高压灭菌 15 min;Overnight ExpressTMinstant LB(O/N instant LB)培养基(novegen):称取50 g粉末溶于 1 L ddH2O中,加入10 mL甘油,121℃灭菌15 min。
1.2 主要试剂与仪器
主要试剂:T4DNA连接酶、KOD聚合酶,rTaq酶、各种限制性内切酶:均购于TaKaRa公司;EasySee Western Marker:购于北京全市金生物技术公司;Precision Plus ProteinTMStandards:BIO-RAD。
主要仪器:高效液相色谱仪:Waters;蛋白质纯化系统 AVANT:AKTA;iMarK 酶标仪:BIO-RAD。
1.3 表达载体pET30-10H3F-EOm的构建
质粒 pOMEA1-6H3F-Endo-Om (Murakami et al,2013)作为模板,使用正向引物AAGGAGATATA CATATGCATCACCATCACCATCACCATCACCATCA CGACTACAAAGACCATGACGG和反向引物TGCT CGAGTGCGGCCGCTCACACCCAAACCTCACTC(下滑线分别为NdeⅠ和NotⅠ的酶切位点)对其进行PCR扩增,获得编码N端带有10His和3Flag的Endo-Om基因片段。用NdeⅠ和NotⅠ限制性内切酶分别对基因片段和质粒pET30a双酶切,经T4 DNA连接酶连接后转化大肠杆菌DH5α,并涂布LB卡那(50 μg/mL)抗性平板。挑选单克隆进行PCR和限制性酶切的初步鉴定,将获得的阳性克隆送至上海六合华大基因测序。获得的序列结果与NCBI数据库中Endo-Om基因序列比对,从而得到正确编码的表达载体pET30-10H3F-EOm。
1.4 Endo-Om在不同宿主菌的诱导表达
将重组表达载体pET30-10H3F-Endo-Om分别转化到 BL21(DE3)和 BL21(DE3)pLysS 两种不同菌种的感受态细胞中,随机挑选4个转化子于37℃过夜培养。次日,将菌液转接新的LB培养基,起始 OD600从 0.02到 0.06,37℃继续培养 OD600至0.6~1,加入终浓度为1 mmol/L的IPTG,30℃培养4 h。收集细胞稀释至0.1 OD,加入上样缓冲液制备SDS-PAGE样品,电泳后分别进行考马斯亮蓝(R250)染色和蛋白质免疫印迹(Western blotting)分析。
1.5 蛋白质免疫印迹分析Endo-Om在BL21(DE3)pLysS 的表达
收集22.5 mL IPTG诱导后的重组大肠杆菌BL21 (DE3)pLysS, 加入 2 mL 破碎缓冲液 A(1 mmol/L的PMSF溶于PBS中)。放置冰上1 h,然后超声破碎细胞(1 s破碎,4 s间歇 ×6)。15 000g离心30 min,收集上清液与沉淀,做Western blotting。Western blotting具体操作步骤如下:首先将滤纸、PVDF膜、凝胶、滤纸由上到下的顺序放置到电转仪(BIO-RAD),25 V、1.0 A、30 min 转 膜 , 然 后 用TBST 缓冲液(150 mmol/L NaCl,10 mmol/L Tris-HCl(pH 8.0),0.05%的吐温)清洗3次后,5%的脱脂牛奶(上海生工)封闭1 h,再用牛奶稀释4 000倍的一抗 (anti-His Mouse mAb,TRANS) 室温孵育 3 h。TBST清洗后加入稀释4 000倍的二抗 (Goat Anti-MouslgG,HRP,TRANS) 孵育 1 h, 最后 TBST 清洗后,ECL显色试剂 (BIO-RAD)对其显色,放入ImageQuant LAS 4000凝胶成像系统中观察结果。
1.6 重组Endo-Om在O/N instant LB培养基中的可溶性表达
将含有重组转化子的BL21(DE3)pLysS划线到卡那(50 μg/mL)及氯霉素(34 μg/mL)抗性的 LB 平板,待长出菌落后接种至5 mL LB抗性的液体培养基,37℃振荡培养过夜。次日,将菌液转接到2 mL含有卡那及氯霉素抗性的Overnight Express Instant LB培养基,起始OD600约0.1,16℃、200 r/min培养2 d。 80 000g、2 min 离心收集菌体,加入 300 μL 破碎缓冲液A,冰上超声破碎细胞 (1 s破碎,4 s间歇,2 min)。14 000g离心10 min收集上清液,同时用等量的300 μL破碎缓冲液A重悬沉淀,分别取40 μL的上清液和重悬沉淀与10 μL的5×上样缓冲液混合均匀,水中煮沸5 min,制备SDS-PAGE电泳样品,电泳后进行Westernblotting分析。
1.7 重组Endo-Om的纯化
收集100 mL培养于O/N instant LB中的重组大肠杆菌 BL21 (DE3)pLysS, 用 PBS (137 mmol/L NaCl,2.7 mmol/L KCl,10 mmol/L Na2HPO4,2 mmol/L KH2PO4)洗后重悬于10 mL的破碎缓冲液B(18 mmol/L NaH2PO4, 2 mmol/L Na2HPO4,0.5 mol/L NaCl,50 mmol/L 咪唑,1 mol/L pMSF), 置于冰上超声破碎 (40%Amp,1 s 破碎,4 s 间歇,10 min),15 000g、4℃离心20 min,收集上清液,并用0.45 μm的针头滤头器过滤。使用蛋白质纯化仪纯化上清液中蛋白质。首先,用结合缓冲液 (18 mmol/L NaH2PO4,2 mmol/L Na2HPO4,0.5 mol/L NaCl,50 mmol/L咪唑,pH 7.4)平衡镍亲和层析柱1 mL HisTrpTMHP(GE),然后上清液以 1 mL/min的流速流过镍柱。上样完毕后,用洗涤缓冲液(18 mmol/L NaH2PO4,2 mmol/L Na2HPO4,0.5 mol/L NaCl,200 mmol/L咪唑,pH 7.4)洗去非特异性结合的杂蛋白质,最后使用洗脱缓冲液(18 mmol/L NaH2PO4,2 mmol/L Na2HPO4,0.5 mol/L NaCl,500 mmol/L 咪唑,pH 7.4)洗脱目的蛋白质,收集洗脱峰并取样进行SDS-PAGE检测。检测后剩余样品用透析袋(国药集团化学试剂有限公司)透析,除去高浓度的咪唑,并用BCA试剂盒(Beyotime)检测蛋白质质量浓度。
1.8 蛋白质的活性检测
蛋白质的酶活测定是在10 μL体系中进行。首先以100 pmol的NGA2-Asn-Fmoc(由日本AIST提供)作为底物,加入2 μL纯化的蛋白酶液(质量浓度为35 μg/mL)或5 μL的细胞破碎液上清液(总蛋白质的质量浓度为7 mg/mL)到含有100 mmol/L的醋酸钠(pH 5.3)、0.5 mol/L的氯化钠缓冲体系中,50℃反应1 h(纯酶)或 3 h(粗酶液),95℃加热5 min终止反应。然后进行高效液相色谱(HPLC)分析其酶活,检测条件为ShodexAsahipak NH2P-50 4E色谱柱 (4.6 mm ×250 mm;Showa Denko K.K.,Tokyo,Japan),流动相为0.3%的醋酸铵溶于57%乙腈,洗脱 25 min,流速 1 mL/min,激发波长 265 nm,发射波长315 nm,柱温40℃。
2 结果与分析
2.1 重组表达载体pET30-10H3F-EOm在不同宿主菌的诱导表达
将表达载体pET30-10H3F-Eom分别转入E.coliBL21(DE3)和 BL21(DE3)pLysS 两种宿主菌,随机选取4个阳性克隆,采用1 mmol/L的IPTG诱导Endo-Om表达。从图1可知,在两种不同的菌种中,IPTG都促进了Endo-Om的表达(对应的目的蛋白质条带约91 000),但是大量目的条带被降解。相比较而言,虽带有质粒pLysS的BL21(DE3)菌株也存在着蛋白质被降解的现象,但降解比例相对较低。同时其表达的Endo-Om的量明显多于BL21(DE3)菌株,只通过考马斯亮蓝染色就可以确认目标蛋白质的表达。值得一提的是,在没有IPTG诱导下,BL21(DE3)仍然表达了许多目的蛋白质,这可能是因为有少量的lacUV5启动了T7RNA聚合酶,存在着目的蛋白质的本底表达。而加入质粒pLysS之后,由于其含有T7溶菌酶的基因,T7溶菌酶可以与T7RNA聚合酶结合,从而可以降低目的基因的背景表达水平。
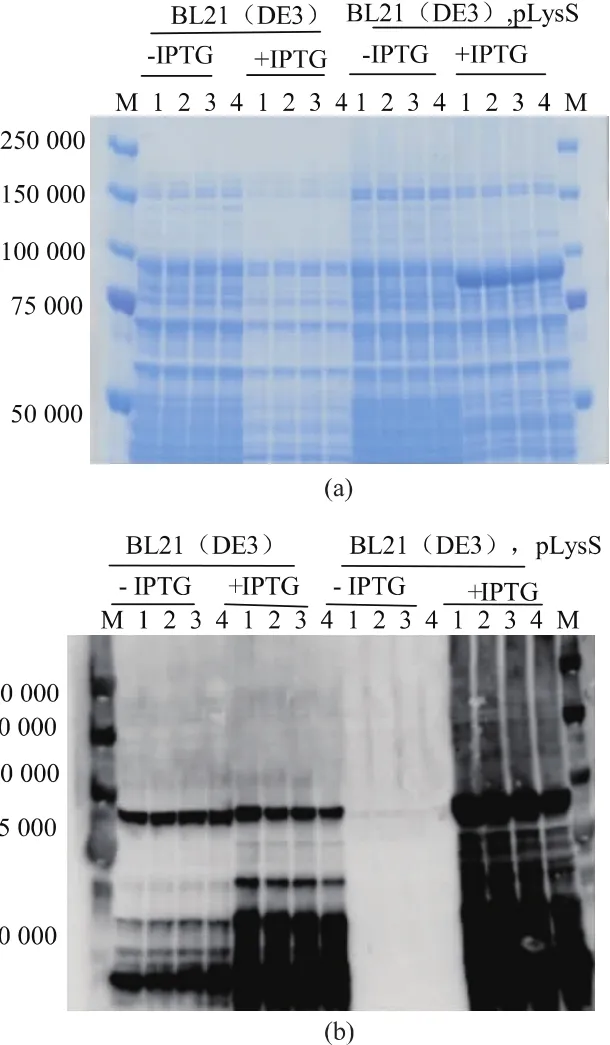
图1 SDS-PAGE和Western-blotting分析IPTG诱导重组Endo-Om的蛋白质表达Fig.1 Expression of recombinant Endo-Om by IPTG induction in various hosts
超声破碎宿主菌 BL21(DE3)pLysS,取其离心后的上清液及沉淀进行Western blotting。从图2可以看出,经IPTG诱导后,虽然大量表达了Endo-Om,但其几乎全部出现在沉淀中。说明Endo-Om在大肠杆菌中表达时易被蛋白酶降解并且极易形成包涵体。
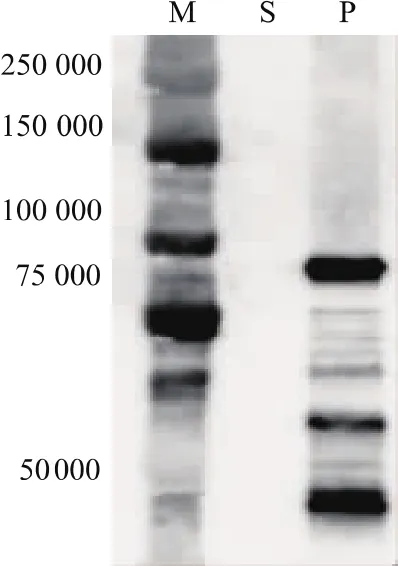
图 2 Western-blotting分析 Endo-Om 在 BL21(DE3)pLysS中的表达Fig.2 Western blotting analysis of the expression of recombinant Endo-Om in BL21(DE3)pLysS
2.2 重组蛋白在大肠杆菌BL21(DE3)pLysS的可溶性表达及活性检测
为了促进Endo-Om在大肠杆菌中可溶性表达,我们对其培养条件进行了优化。当其在O/N instant LB中16℃培养48 h后,取细胞液做western blotting分析。图3(a)显示了在这种培养条件下,Endo-Om蛋白质的降解明显地降低。同时破碎细胞后,分别取等量的上清液与沉淀进行Western blotting。图3(b)可以明显地看出,与之前IPTG诱导表达使得几乎全部重组蛋白质形成包涵体不同,约占1/4的蛋白质表达到上清液里,而且大部分的降解出现在沉淀中。Endo-Om在O/N instant LB中低温培养不仅可以减少蛋白质的降解还可促进其可溶性表达。在低温的培养条件下,菌体生长速度、代谢速度减缓,使其有更充足的时间进行蛋白质的组装,帮助外源蛋白质折叠[13]。
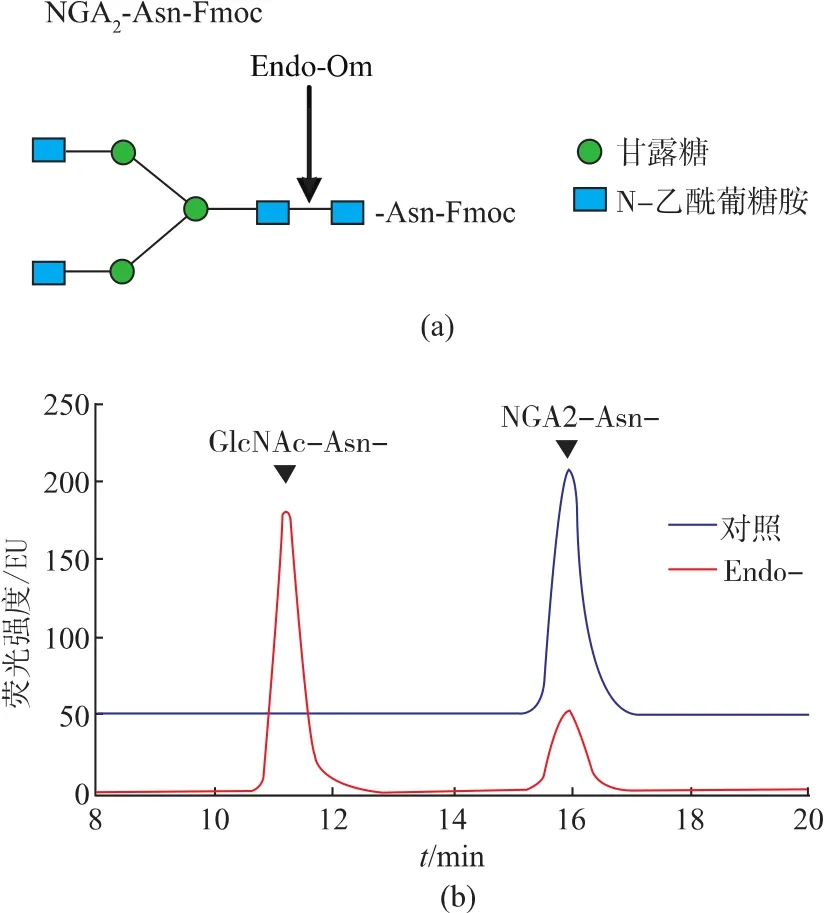
已知Endo-Om具有糖苷水解酶的活性,因此我们以NGA2-Asn-Fmoc为底物,以水为空白对照,测重组大肠杆菌粗酶液的活性,见图4(a)。从图4(b)看出,随着 NGA2-Asn-Fmoc 的峰(约 16 min)的降低,酶切产物的峰(约在 11 min)出现,即产物GlcNAc-Asn-Fmoc。因而,可溶性表达到大肠杆菌上清液里的Endo-Om是有活性的。
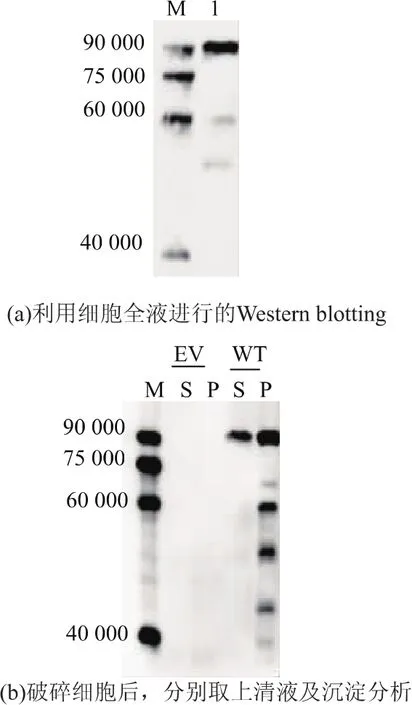
图3 Western blotting分析重组的Endo-Om 16℃在O/N instant LB培养基中的表达Fig.3 Expression of recombinant Endo-Om in O/N instant LB medium at 16℃
2.3 重组蛋白的纯化及活性鉴定
重组大肠杆菌超声破碎后,离心收集上清液,利用镍亲和层析柱HisTrpTM HP纯化。首先用200 mmol/L的咪唑洗去非特异性结合的杂蛋白质,然后,以500 mmol/L的咪唑洗脱目的蛋白质,SDSPAGE分析
纯化得到的蛋白质。从图5可以清楚的看到,在约90 000处有一条清晰的主条带,与预期的大小一致,成功实现了Endo-Om在大肠杆菌中的纯化。

图5SDS-PAGE分析纯化的重组Endo-OmFig.5 SDS-PAGE of purified Endo-Om
以NGA2-Asn-Fmoc为底物,我们检测纯化后蛋白质的活性,图6显示纯化后的Endo-Om具有糖苷水解酶活性,可以水解N-糖链中两个GlcNAc之间的β-1-4糖苷键,释放N-糖链和带有GlcNAc的多肽。计算大肠杆菌中纯化的Endo-Om的比活力为7.68 U/g,与Murakami等从Ogataeaminuta酵母中纯化出的酶的比活力9.92 U/g[12]相比,并无较大的差别。酶活单位定义为在此反应条件下,每分钟生成1 μmol的GlcNAc-Asn-Fmoc所需的酶量。
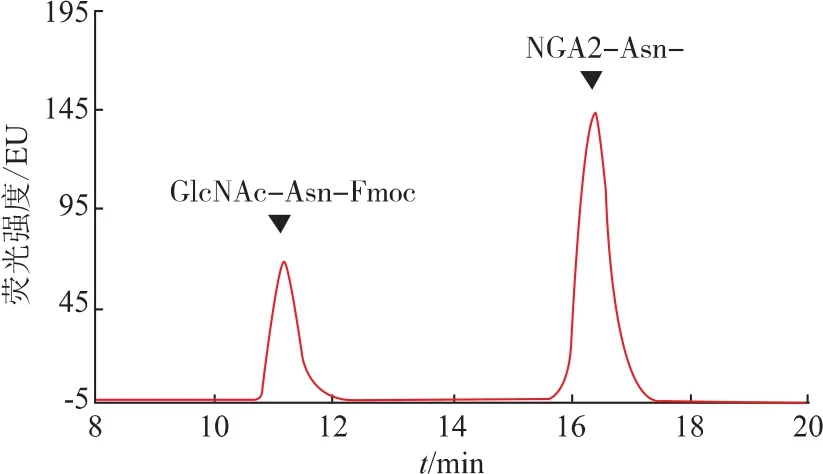
图6HPLC检测纯化后Endo-Om水解活性Fig.6 HPLC analysis of hydrolysis activity of purified Endo-Om
3 结语
糖链结构和功能的研究及糖蛋白药物、疫苗等都迫切需要带有均一糖链的糖蛋白和糖肽,化学酶合成法,尤其是利用ENGase的转糖基活性合成此类糖蛋白和糖肽成为了目前研究的热点[3]。Endo-M和Endo-A都已多次被应用,但存在着局限性[14]。最近,有研究报道来源于Ogataea minuta的内切-β-N-乙酰氨基葡糖苷酶(Endo-Om)从属于GH85家族,可识别高甘露糖型和复合型糖链。因此,Endo-Om具有较为广泛的应用。Murakami等将其在Ogataea minuta中过表达并进行了纯化,但较难得到大量的纯酶。我们研究了Endo-Om在大肠杆菌中可溶性表达,并成功检测到纯化后的酶液对缺少半乳糖的双天线复合型糖链的水解活性。与从其本身酵母中纯化的酶的比活力相比较,并无较大的区别,但众所周知,大肠杆菌的异源表达易产生包涵体,本研究虽通过条件的优化,得到了可溶性的Endo-Om,但其在 BL21(DE3)pLysS 中依旧形成了部分的包涵体,仍需继续研究。值得一提的是,在大肠杆菌中表达该酶,操作简单,我们可利用此法纯化该酶,用于其结构及功能的研究。同时接下来我们还需进一步研究Endo-Om的底物识别机制,水解和转糖基两种作用的催化机理,以期获得更高效的转糖基突变体,用于合成同源糖蛋白或糖肽。

