文蛤纤维素酶分离纯化及性质
王婷婷,宋 星,李 燕
(上海海洋大学 食品学院,上海 201306)
纤维素是植物细胞壁的主要成分,也是地球上最为丰富的可再生资源,其在纤维素酶的催化下可降解为单糖,进而可以发酵生产乙醇、菌体蛋白等有用物质,所以它的利用和转化对于人类而言意义重大[1-2]。
纤维素酶是世界上第三大工业酶,在食品、酿酒、造纸、纺织、饲料、中药提取等产业中均有较为广泛的应用[3-5]。纤维素酶是一种多组分的复合酶系,包括多种水解酶,一般认为主要包括3类具有协同作用的酶组分,即内切型葡聚糖苷酶、外切型葡聚糖苷酶和纤维二糖酶[6]。纤维素酶主要来源于微生物,然而纤维素酶生产菌产酶能力低下、Km值较大且酶系组分不均衡等问题,大大限制了纤维素酶的应用[7-8]。因此获得一种活力高且稳定的纤维素酶,成为该领域最关键的问题。近些年来,动物源纤维素酶越来越受到关注,研究者们在植物、动物包括(贻贝、白蚁、海胆、福寿螺、松线虫、蚯蚓,小龙虾等)中均发现内源纤维素酶的存在[9-11]。这为纤维素酶的应用提供了重要的纤维素酶基因来源,因此动物纤维素酶的研究具有重要的理论价值和现实意义。
文蛤是一种重要的经济贝类,在水中主要以浮游植物为食,所以可能体内含有纤维素酶,值得对其进行探究。作者利用均质、盐析、透析、离子层析和疏水层析等技术,首次从文蛤中分离纯化出一种内切纤维素酶,并对其酶学性质进行了初步研究。
1 材料与方法
1.1 材料
1.1.1 实验材料 文蛤:购于上海浦东新区泥城镇大润发超市。
1.1.2 实验仪器 高速冷冻离心机:德国Thermo Fisher scientific公司;SS250-E组织捣碎机:方胜电器实业有限公司;UNICO UV-2000紫外分光光度计:北京普析通用仪器有限公司;DYY-6C电泳仪:北京六一仪器厂。
1.1.3 主要试剂 DEAE Sepharose Fast Flow、Phenyl Sepharose 6 Fast Flow层析填料:美国GE Healthcare公司;低相对分子质量标准蛋白质:上海国药集团;DNS 试剂(3,5-二硝基水杨酸):国药;其他试剂:均为国产分析纯或化学纯。
1.2 方法
1.2.1 CMC-Na酶活测定方法 取1 mL的酶液于45℃水浴预热3 min,加入已预热的1%CMC-Na溶液 (由pH 5.0、0.1 mol/L醋酸-醋酸钠缓冲液配制)1.0 mL,混匀,45℃反应 30 min,立即加入 1 mL的2.0 mol/L NaOH溶液终止反应。取上述混合液1 mL,加入1.5 mL的DNS试剂,沸水浴中显色5 min,流水冷却后定容至25 mL,测定其在490 nm处的吸光度值(OD490)。CMC-Na酶活定义:将每分钟生成相当于1 μg葡萄糖的还原糖所需要的酶量定义为一个酶活力单位。
1.2.2 蛋白质测定方法 蛋白含量测定采用Lowry法[12]和紫外分光光度法测定。
1.2.3 粗酶液制备 文蛤于冰上去壳,取内容物,以 1∶3质量体积比与 pH 4.8、0.025 mol/L醋酸-醋酸钠缓冲液混合,用组织捣碎机捣碎,置于4℃提取4 h,10 000 r/min离心30 min,得上清液即为粗酶液。
1.2.4 纤维素酶的纯化
1)硫酸铵分级沉淀:分别取粗酶液10 mL,分装至9支试管中,在冰浴条件下慢慢加入硫酸铵固体,使9支试管的硫酸铵饱和度分别为20%、30%、40%、50%、60%、70%、80%、90%。 4℃静置过夜,冷冻离心,分别测上清液中剩余酶的活性,由此确定最佳硫酸铵分级沉淀条件。
2)DEAE Sepharose Fast Flow阴离子交换层析:硫酸铵分级沉淀所得酶液经透析除盐,上样于已用pH 8.1、25 mmol/L的 Tris-HCl缓冲液平衡后的DEAE Sepharose Fast Flow阴离子交换层析柱(1 cm×24 cm)。采用梯度洗脱,先后分别用含0.05、0.3 mol/L的NaCl的缓冲液洗脱,流速1 mL/min,每3 min收集一管。测定每管的酶活力和蛋白质含量,收集有酶活的洗脱峰。
3)苯基低取代疏水层析:离子层析所得酶液加入硫酸铵使其最终浓度为1 mol/L,过0.45 μm滤膜得清液上样于苯基疏水层析柱(1.6 cm×20 cm)。先用含1 mol/L硫酸铵的pH 7.5、25 mmol/L的Tris-HCl缓冲液洗脱不结合的蛋白质,然后分别用含0.5、0 mol/L硫酸铵的 25 mmol/L的 Tris-HCl缓冲液进行梯度洗脱。流速为1 mL/min,3 min收集一管。检测洗脱液的蛋白质含量和酶活力,绘制洗脱图谱,合并活力峰。
4)SDS-PAGE:用SDS-PAGE测定酶分子亚基相对分子质量。采用4%的浓缩胶,12%的分离胶,浓缩胶稳流是10 mA,分离胶稳流20 mA,电泳结束以后用1%考马斯亮蓝R-250染色。以标准蛋白质(14 400~97 400)作为参照。
1.2.5 文蛤纤维素酶酶学性质
1)最适pH和pH稳定性的测定:在40℃恒温下,pH 3~8缓冲体系中测定相应的酶活力。以酶活力对pH作图,探讨pH对酶活的影响。
pH稳定性试验:酶液与等量不同pH的缓冲溶液混合,置于4℃下孵育20 h后测定酶活力。
2)最适温度和热稳定性的测定:在pH 5.2的缓冲体系中,在10~70℃范围内,探究温度与酶活力的关系。
酶的热稳定性实验:将酶液放置在不同温度中孵育1 h,迅速冷却到室温,45℃测定剩余酶活力。
3)酶催化CMC-Na水解的动力学参数Km的测定:在最适反应条件下,改变底物(CMC-Na)的浓度[s],测定酶促反应的初速度v0,采用Lineweaver-Burk双倒数法作图,以1/v对1/[s]作图,从直线的截距求得该酶催化CMC-Na水解的米氏常数Km和最大速度Vmax。
2 结果与讨论
2.1 纤维素酶的分离纯化
2.1.1 硫酸铵饱和度区间确定 由图1可知:硫酸铵饱和度在0~20%之间,上清液中的纤维素酶活力基本不变,但蛋白质含量一直在减少,说明绝大多数的酶仍在上清液中,沉淀了一部分的杂蛋白质;当硫酸铵的饱和度达到70%时,上清液中的酶活力基本不再减少,说明大部分的酶已经被沉淀了,剩余的基本大多是杂蛋白质了。综合酶活和回收率两方面考虑,收集20%~70%的纤维素酶沉淀,将沉淀复溶解后置于透析袋中,4℃透析过夜。
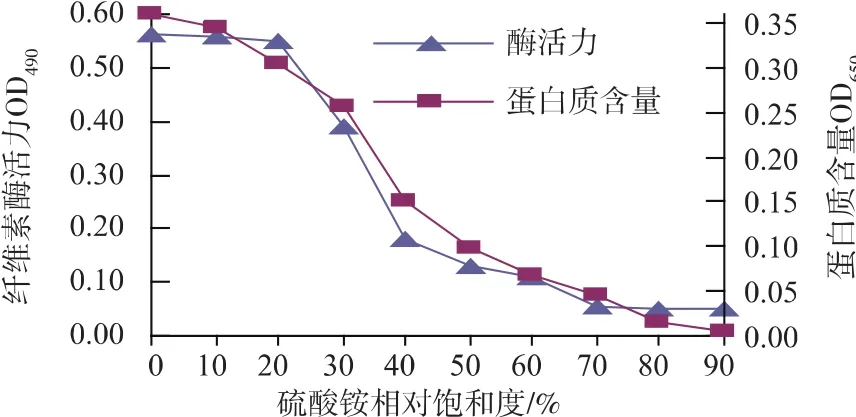
图1 硫酸铵分级沉淀结果Fig.1 Results of ammonium sulfate precipitation
2.1.2 DEAE-Sepharose Fast Flow阴离子交换层析由图2可以看出,洗脱过程共出现3个蛋白质峰,经酶活检测发现峰Ⅱ蛋白质含量最低,但酶活力最高,而峰Ⅲ虽有酶活性但比活力较低,故只收集峰Ⅱ组分,除掉了大量杂蛋白质,有利于下一步的分离纯化。
2.1.3 Phenyl-Sepharose疏水层析 从图3可以看出,第四个蛋白质峰酶活力高,蛋白质含量低,蛋白质的比活力较高,而峰1和峰3中虽然存在酶活性,但比酶活极低,故收集峰4的酶液,进一步通过SDS-PAGE电泳检测其纯度。

图2 文蛤纤维素酶经DEAE Sepharose Fast Flow阴离子交换层析洗脱图谱Fig.2 DEAE-FF column chromatography of cellulase from Meretrix meretrix L

图3 Phenyl Sepharose疏水作用层析洗脱图谱Fig.3 Phenyl sepharose column chromatography
2.2 纯化结果
2.2.1 SDS-PAGE结果 用SDS-PAGE对各纯化阶段所得酶液进行纯度分析,结果见图4。由标准蛋白质的相对分子质量的对数lgMw与其迁移率Rf的线性关系,求得文蛤纤维素酶的亚基相对分子质量为59 700。孙长乐[13]等从九孔鲍中提取到的纤维素酶的相对分子质量为55 000;日本海胆[14]纤维素酶的相对分子质量为54 000;从小龙虾[15]中分离到的两种纤维素酶的相对分子质量分别为47 800与50 300。从福寿螺[16]中分离到的纤维素酶的相对分子质量为42 000,从贻贝[17]中提取到的纤维素酶相对分子质量更小,仅为 19 700,可见纤维素酶的分子质量大小会因种族及其生活环境差异而各不相同。
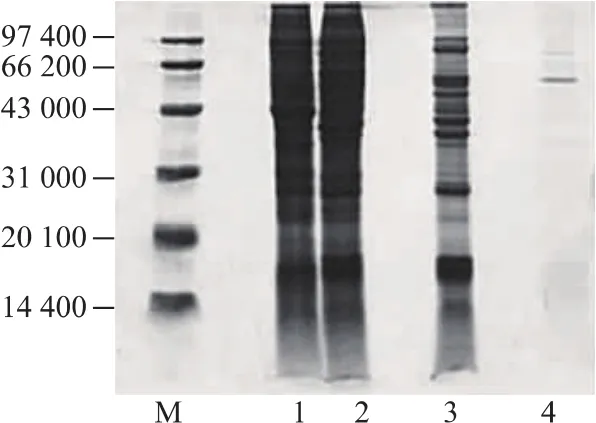
图4 纯化过程的SDS-PAGE图谱Fig.4 SDS-PAGE of Cellulase from Meretrix meretrix L
2.2.2 文蛤纤维素酶纯化结果 从表1可以看出,作者对文蛤纤维素酶进行了3步纯化:硫酸铵分级沉淀、DEAE-阴离子交换层析、苯基疏水层析后,最终纤维素酶的纯化倍数为13.12倍,其比活力为40 330 U/g,回收率为4.82%。其中,硫酸铵沉淀步骤的纯化倍数很低,可能是由于为了避免在初步分离纯化阶段目标酶的损失,选择的沉淀区间较宽造成的。DEAE-阴离子交换层析的纯化效果比盐析略好,回收率很低,结合图4分析,离子交换层析虽去掉了大量的杂蛋白质,但可能因为层析的缓冲环境(pH 8.1)远远偏离最适pH,所以酶活力损失较大。
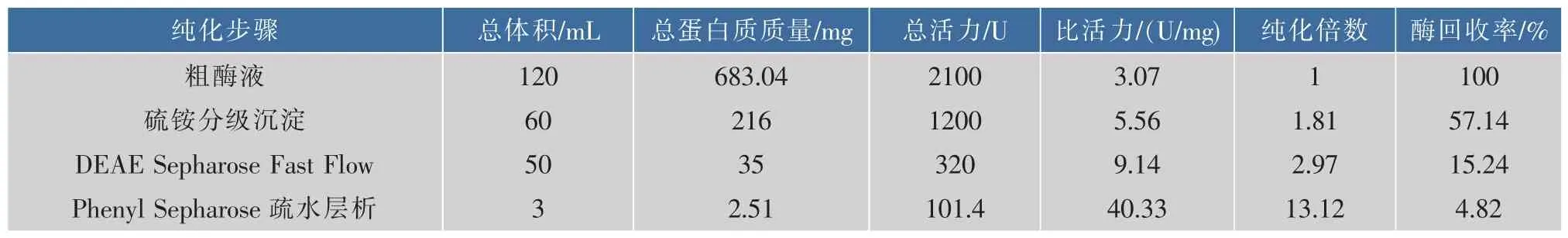
表1 文蛤纤维素酶的纯化结果(以CMC-Na酶活表示)Table 1 Purification of Meretrix meretrix L cellulose(CMCase)
2.3 酶学性质分析
2.3.1 最适反应pH及pH稳定性 在pH 2.6~8范围内,文蛤纤维素酶的最适反应pH为5.2,缓冲液pH对纤维素酶活有显著影响,见图5。pH在4以下和9以上极不稳定,酶活力损失严重,剩余酶活力不到20%。在pH 4~6范围内具有较好的稳定性,于4℃静置24 h后相对酶活力仍在70%以上,见图6。
2.3.2 最适反应温度及温度稳定性 在10~45℃范围内,随着温度的升高,文蛤纤维素酶活力升高,45℃以后酶活力逐渐降低,所以最适反应温度为45℃,见图7。由图8可知,在4~50℃范围内热稳定性良好,剩余酶活力都在80%以上。高于此温度,酶活力迅速下降,在60℃保温1 h相对酶活力仅剩余27.7%,在70℃保温1 h,仅剩14%的酶活力,热稳定性差。
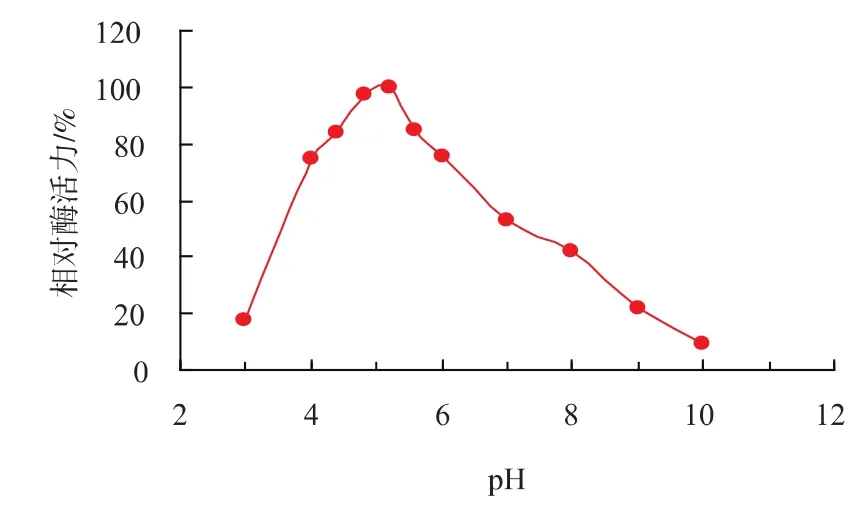
图6 文蛤纤维素酶的pH稳定性Fig.6 pH stability of the EGase from Meretrix meretrix L
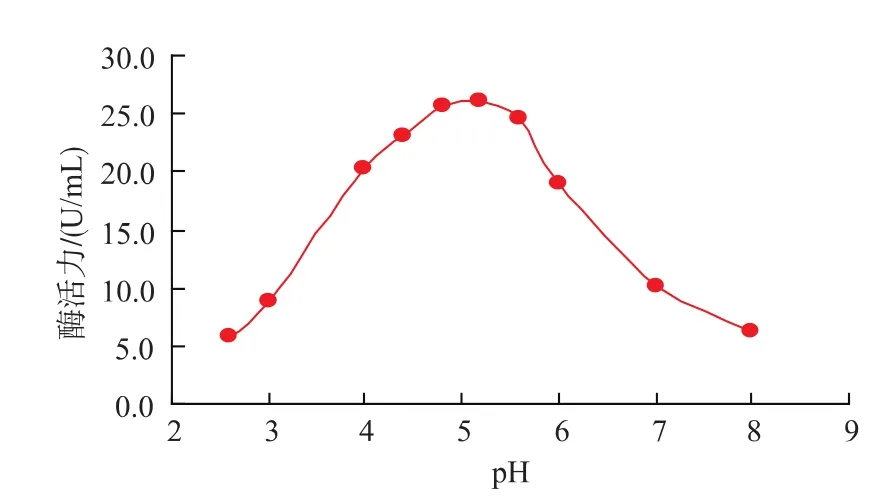
图5pH对酶催化CMC-Na活力的影响Fig.5 Effect of pH on cellulase activity
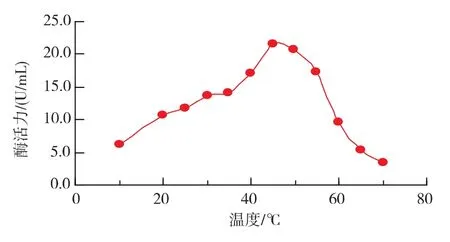
图7 温度对酶催化CMC-Na活力的影响Fig.7 Effect of temperature on cellulase activity
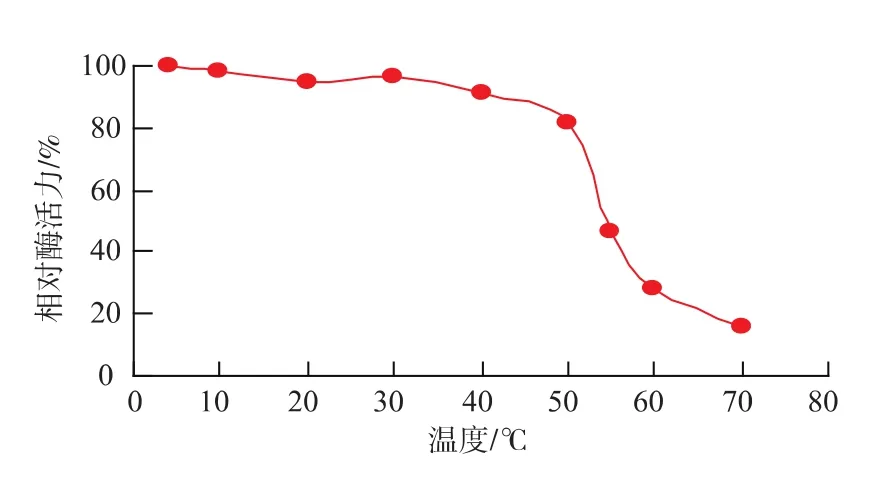
图8 文蛤纤维素酶的温度稳定性Fig.8 Thermal stability of the cellulase from Meretrixmeretrix L
2.3.3动力学常数Km和Vmax由图9得到的双倒数方程为y=0.340 6x+12.64,从而计算出以CMCNa为底物,文蛤纤维素酶的Km值为0.111 mmol/L,Vmax为 0.327 mmol/(L·min)。贺刚[18]等从草鱼肠道筛选出一个产纤维素酶的菌株,其Km值为4.212 mmol/L;胡亚东[19]等从参环毛蚯蚓中分离出的能降解CMC-Na的纤维素酶的Km值为1.193 mmol/L;朱文青[20]等人从里氏木霉发酵液分离纯化出两种纤维素酶,以CMC-Na为底物时,其Km值分别为9.085、13.958 mmol/L。相比较而言,本研究纯化所得的纤维素酶的Km值远远低于上述文献报道数据,所以该酶较其他来源的纤维素酶有更好的水解纤维素的能力,这为寻求高活力的工业纤维素酶提供了良好的基因来源。
3 结 语
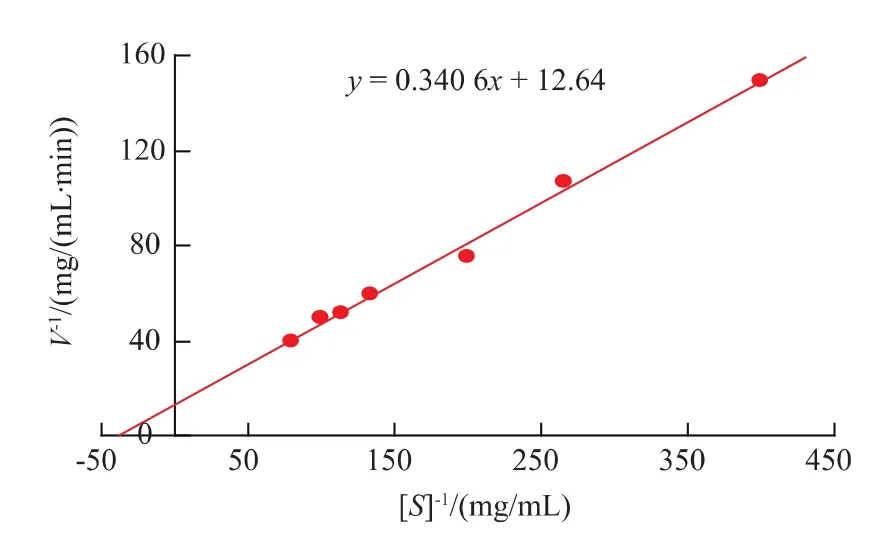
图9 pH 5.2的测活体系下,纤维素酶催化CMC-Na水解反应的双倒数图Fig.9 Lineweaver-Burk plot for determination of Kmat pH 5.2
文蛤纤维素酶粗酶液经过硫酸铵分级沉淀、透析、DEAE Sepharose FF阴离子交换层析、苯基疏水层析分离纯化后,得到一种相对分子质量为59 700的纤维素酶组分。比活力由3.07 U/mL增加到40.33 U/mL,纯化效果显著,纯化倍数为13.12,回收率为4.82%。该酶的最适反应温度为45℃,最适反应pH为5.2,该酶在50℃以下和pH 4.0~7.0之间稳定性好。以CMC-Na为底物时的Km值为0.111 mmol/L。作者分离所得的纤维素酶Km值较小,对底物的亲和性较高,可以为工业纤维素酶提供较好的基因来源。此外,分离的主要是内切纤维素酶组分,可能文蛤中还存在同工酶或其他纤维素酶组分,有待进一步的研究和探索。

