基于蛋白质折叠自由能分析的定点突变提高谷氨酰胺转胺酶热稳定性
童理明 , 刘 松 , 李江华 *, 堵国城 , 陈 坚
(1.江南大学工业生物技术教育部重点实验室,江苏无锡214122;2.江南大学生物工程学院,江苏 无锡214122)
谷氨酰胺转胺酶(Transglutaminase,EC 2.3.2.13,TGase),是一种能够发生酰胺基转移反应,最后形成ε-(γ-谷氨酰基)赖氨酸共价键的蛋白质[1]。基于上述催化反应的存在,TGase能够促使各种蛋白质分子间、分子内交联以及谷氨酰胺残基的水解,从而提高蛋白质的各种功能性质,比如乳化性、溶解性等[2];同时,TGase能够通过将一些小分子物质比如赖氨酸等引入蛋白质,来增加蛋白质的营养价值[3]。因此,市场上广泛应用TGase作为别具特色的食品添加剂于面制品、乳制品、碚烤制品、肉制品及水产品等食品的加工处理,市场需求量极其巨大[3-4]。
TGase特殊的催化能力使其在食品、纺织等工业生产中具有广泛应用,但其催化活性较低、热稳定性较差,使得TGase作为优良的催化剂在工业中的应用受到了严重限制[5-6]。因此,目前研究的热点大部分都集中于如何提高TGase的热稳定性。作为最重要的蛋白质热动力学参数之一,蛋白质折叠自由能(ΔG)是反应蛋白质的热稳定性的一种通用性指标[7]。在运用定点突变方法改造酶分子的过程中,酶突变体的ΔG越小,其稳定性反而越高[7]。随着生物信息学的发展,部分软件已经可以通过对序列或结构文件的分析来预测酶分子ΔG,如FoldX[8]、PoPMuSiC等[9]。我们可以基于折叠能的下降水平,再通过这些软件,确定合适的突变位点。
在本研究中,首先应用PoPMuSiC-2.1分析TGase突变体折叠自由能的变化值(即ΔΔG=ΔG(突变体)-ΔG(野生酶))[9],之后确定了 ΔΔG变化较大的 P132位点为影响TGase酶热稳定性的关键点,并构建得到热稳定性提高的TGase突变体。
1 材料与方法
1.1 材料
1.1.1 菌株 作者所在实验室前期构建保存的表达质粒 pET-22b (+)/pro-TG: 用于表达S.hygroscopicuspro-TGase[10]; 大肠杆菌(Escherichia coli) JM109 和E.coliBL21(DE3):来自 Qiagen 公司(美国)。
1.1.2 培养基 种子培养基(LB):酵母粉5 g/L,胰蛋白胨 10 g/L,NaCl 10 g/L;pH 7.0。
发酵培养基(TB):酵母粉 24 g/L,胰蛋白胨12 g/L, 甘油 5 g/L,K2HPO472 mmol/L,KH2PO417 mmol/L;pH 7.4。
1.2 方法
1.2.1 突变体的构建 将TGase成熟酶基因中的P132 位 点 分 别 突 变 成 P132I、P132G、P132M、P132Q。以S.hygroscopicuspro-TGase表达质粒pET-22b(+)/pro-TG 为模板,进行全质粒 PCR,引物见表1。

表1 本研究所用引物序列Table 1 Primers used in this study
1.2.2 胶回收 详细说明参见胶回收试剂盒的产品说明书(TAKARA公司)。
1.2.3 转化 将连接好的pET-22b(+)/pro-TG转进 JM109,测序正确后转进E.coliBL21(DE3)。
1.2.4 培养方法 种子培养条件:LB培养基,用250 mL摇瓶培养,装液量10%,培养温度37℃,转速220 r/min,培养时间10 h。
摇瓶发酵条件:TB培养基,采用250 mL摇瓶进行培养,装液量10%,接种体积分数3%,培养温度 37℃,转速220 r/min,当 OD600达到 2.0时,终浓度为0.4 mmol/mL的IPTG诱导,20℃诱导培养48 h。1.2.5 TGase蛋白纯化 将重组菌株的发酵液经过12 000 r/min离心后收集发酵上清液。将发酵上清液采用微孔滤膜(0.25 μm)过滤去除杂质后,将样品进样,注入AKTA蛋白纯化仪的镍柱。上样缓冲液A 液:50 mmol/L磷酸盐缓冲液(pH 7.4)、0.3 mol/L NaCl、20 mmol/L咪唑;洗脱缓冲液B液:50 mmol/L 磷 酸 盐 缓 冲 液 (pH 7.4)、0.3 mol/L NaCl、250 mmol/L咪唑。流速为1.0 mL/min,洗脱样品时的洗脱液含16.7%B液[11]。
1.2.6 pro-TGase的体外活化及TGase酶活力测定向40 μL野生或突变pro-TGase发酵上清液中加入2 μL 的中性蛋白酶 dispase(0.1mg/mL),混合均匀,37 ℃水浴 10 min[12]。
比色法测定酶活[13]。L-谷氨酸-γ-单羟胺酸作为标准曲线,α-N-CBZ-GLN-GLY为底物。1个单位的TGase酶活定义为:在37℃的条件下,每分钟催化上述底物合成1 μmol的 L-谷氨酸-γ-单羟胺酸所用的酶量(U/mL)。酶活测定条件为37℃下反应10 min,酶催化反应见图1。
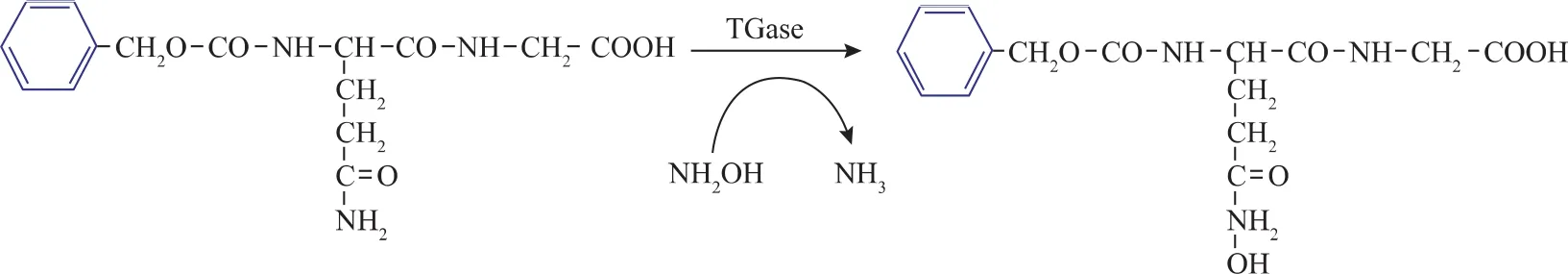
1.2.7 TGase酶学参数测定 测定TGase酶反应的动力学参数(Km、kcat)条件:温度 37 ℃,底物质量浓度范围为0~30 g/L。通过Eadie-Hofstee方程计算可得动力学参数Km值。
半衰期检测(t1/2):将纯化后的突变TGase稀释到同一质量浓度,放置于50℃水浴保温25 min,每隔3分钟取样测TGase酶残余活力。蛋白质的半衰期(t1/2)可通过作活力-时间的关系图,由曲线末端直线部分的斜率(k)解得。
1.2.8 软件分析 酶分子的折叠自由能变化值ΔΔG由 PoPMuSiC-2.1(http://dezyme.com)计算。 利用 在 线 服 务 器 SWISS-MODEL(http://swissmodel.expasy.org/), 以PDB数据 S.mobaraensis pro-TGase(PDB No.3iu0A)[14]晶体结构为模板,同源模拟S.hygroscopicusTGase晶体结构。TGase晶体结构由软件Discovery studio分析。
2 结果与讨论
2.1 突变位点的选择
PoPMuSiC-2.1可快速分析各氨基酸位点替换为其它氨基酸对应TGase突变体的折叠能,并由此计算得到各氨基酸位点的折叠能变化值ΔΔG。利用PoPMuSiC-2.1对S.hygroscopicusTGase氨基酸序列进扫描,得到了各氨基酸位点对应的ΔΔG之和,见图2。一般认为,ΔΔG值越小的氨基酸位点,突变后对酶分子热稳定性的提高越明显[15]。基于此,取TGase序列中ΔΔG之和最小的位点P132作为改造靶点,以期提高其热稳定性。为考察不同ΔΔG值对酶稳定性的影响,拟将P132分别突变为异亮氨酸(P132I)、谷氨酰胺(P132Q)、甘氨酸(P132G)及蛋氨酸(P132M)等,其ΔΔG依次增加,见表2。
2.2 TGase突变体的分泌表达
前期研究发现,TGase以酶原pro-TGase形式在链霉菌中表达,其N端前导肽对TGase大肠菌中的正确折叠有重要影响;在重组表达体系中,一般通过体外添加活化蛋白酶切割pro-TGase前导肽下得到成熟TGase[16]。在本研究中,以酶原pro-TGase的形式在大肠杆菌E.coliBL21(DE3)为宿主分泌表 达 了 TGase 及 突 变 体 (P132Q、P132I、P132G、P132M)。经蛋白酶活化,表达 P132Q、P132I、P132G、P132M的重组菌胞外TGase酶活分别较突变前提高了 115%、85%、71%和94%,见图3(a)。蛋白质电泳分析显示,表达突变体的重组菌上清液的pro-TGase条带(42 500)较改造前的重组菌明显增粗,见图3(b)。上述结果表明,重组 P132Q、P132I、P132G和P132M的pro-TGase在大肠杆菌中高效分泌。

图2 S.hygroscopicus TGase氨基酸序列中的ΔΔG值Fig.2 ΔΔG value in S.hygroscopicus TGase sequence

表2 TGase突变体的ΔΔG值Table 2 ΔΔG value of TGase mutants
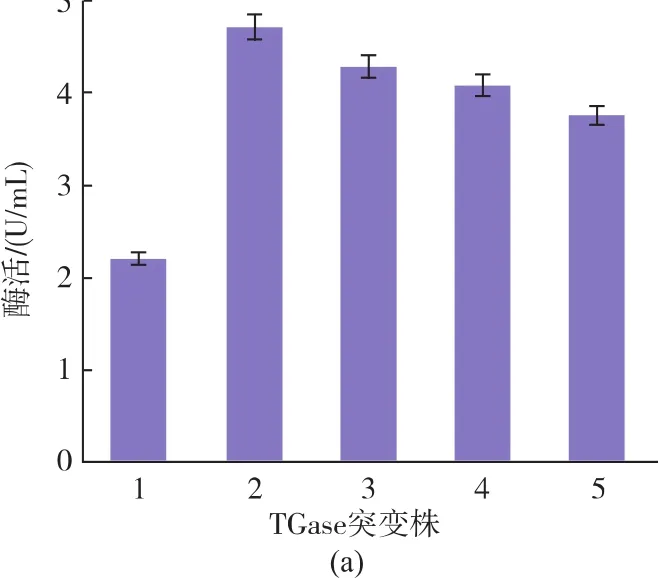
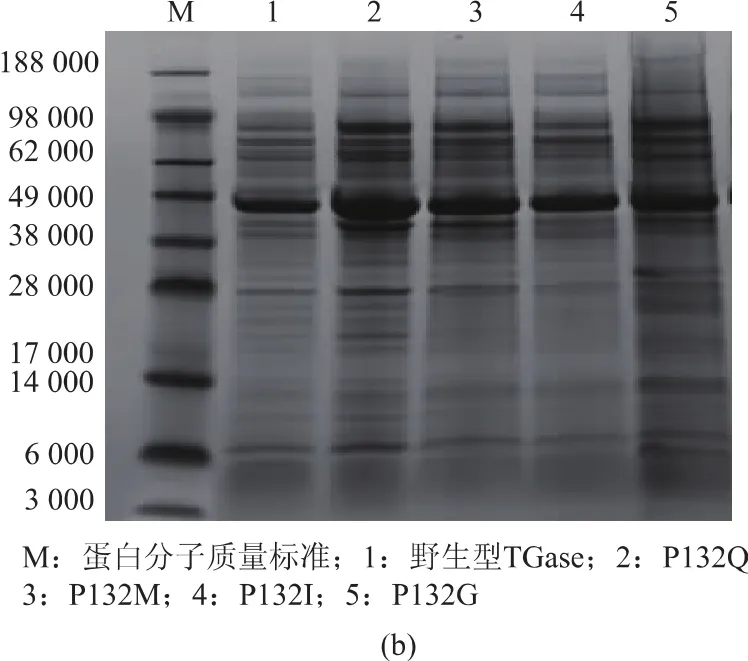
图3 重组E.coli BL21(DE3)胞外TGase突变体酶活及SDS-PAGE电泳分析Fig.3 Activity and SDS-PAGE analysis of TGase mutants in culture supernatant of recombinant E.coli BL21(DE3)
2.3 重组TGase的纯化以及酶学性质分析
含突变体发酵的上清经镍柱分离后获得电泳纯的突变体(图4),并分析了纯酶的酶学性质。结果显示,突变体P132I、P132G、P132Q和P132M在50℃下的半衰期t1/2较野生酶提高了2%~31%,其中P132I达到5.0 min,见表3。此外,P132I和P132G比酶活亦分别较野生酶提高24%和12.4%,其它突变比酶活变化不明显。与比酶活变化相对应,P132I和P132G的Km较野生酶降低,而kcat略有提高;P132M及P132Q的变化趋势相反。上述结果表明,P132I和P132G热稳定性和催化活性相比野生酶有较为明显的提高,进一步增强了底物的亲和力以及催化效率。
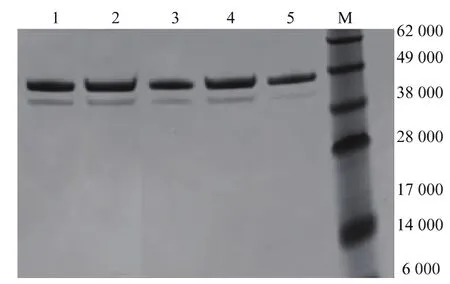
图4 纯化的pro-TGase及其突变体SDS-PAGE分析Fig.4 SDS-PAGE analysis of purified pro-TGase mutants
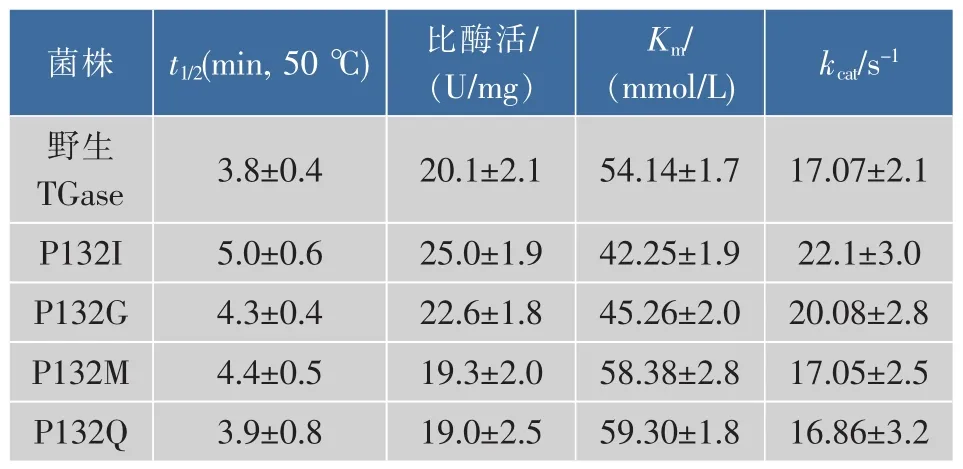
表3 TGase及突变体的酶学性质Table 3 Enzymatic properties of TGase and its mutants
2.4 P132I的稳定化机制分析
研究表明,蛋白质分子内作用力的种类和数量对酶分子热稳定性和催化活性产生重要影响[17]。为解析TGase突变体P132I的分子机制,构建了S.hygroscopicusTGase模拟结构并分析了分子内作用力的变化。P132处于酶分子内部的loop结构上,增加P132与其它基团的作用力有利于提高loop结构的刚性,进而提高酶分子的热稳定性。作用力分析显示,在野生TGase中,P132仅与S130和Y127形成两个氢键;而在突变体P132I中,I132与S130和Y127形成了4个氢键,见图5。氢键是酶分子稳定的重要作用力之一,一个氢键可为蛋白质的维持提供0.6 kcal/mol的能量[18]。因此,P132I热稳定性提高的原因之一极有可能是因为氢键的增加[19]。

图5 S.hygroscopicus TGase模拟结构Fig.5 Modeling structure of S.hygroscopicus TGase
除此之外,在突变株P132I中,132位异亮氨酸较野生酶中的脯氨酸疏水性更强。大量的研究显示,降低蛋白质表面的疏水性或增加蛋白质内部的疏水性,能够提高蛋白质的稳定性[20-21]。如有研究者将乙酰胆碱酯酶(acetylcholinesterase)表面疏水氨基酸L471突变成亲水性更高的酪氨酸,酶热稳定性提高了3倍[22]。因此,分子内部疏水性的提高,也可能是导致P132I热稳定提高的另一原因。

图6 TGase及突变体分子中132氨基酸形成的氢键Fig.6 Hydrogen bond formed by amino acid 132 in TGase and its mutants
3 结语
TGase应用广泛,包括纺织、食品、造纸和环境领域等。然而,其应用的推广却受限于其较低的热稳定性。本研究通过折叠能分析软件PoPMuSiC-2.1发现了S.hygroscopicusTGase分子中ΔΔG最小的位点P132,确定该位点为提高TGase热稳定性的潜在位点。在构建得到的突变体中,P132I的50℃半衰期和比酶活分别较野生酶提高31%和24%,这个结果表明,基于折叠能分析的定点突变策略能有效地提高TGase的热稳定性。在下一步研究中,将使用构建P132I高效分泌表达系统,以期实现高热稳定性和高催化活性TGase工业化生产。

