远隔缺血适应干预对动脉瘤性蛛网膜下腔出血患者凝血功能的影响
齐猛,徐跃峤,王宁,蒋丽丹,陈文劲,曲鑫,程玮涛
缺血预适应(ischemic preconditioning,IPC)由Charles E. Murry等[1]于1986年提出,指预先给予一个器官短暂、非致死性的轻度缺血处理后,会对以后致死性的缺血产生耐受。1993年,Karin Przyklenk等[2]提出了远隔器官缺血预适应(remote ischemic preconditioning,RIPC),即一个器官的短暂缺血会诱导另一个器官的缺血适应。近年来动物实验及临床研究发现,远隔缺血适应(remote ischemic conditioning,RIC)对包括心脏和脑在内的缺血性卒中具有保护作用,目前已成为卒中治疗的研究热点[3-4]。本研究拟探讨RIC对动脉瘤性蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)患者凝血功能的影响。
1 研究对象与方法
1.1 研究对象 本研究通过首都医科大学宣武医院伦理委员会审核,前瞻性设计连续纳入本院神经外科重症监护病房2017年11月-2018年5月收治入院的24例aSAH患者,对患者进行RIC干预,并在干预前后抽取静脉血行凝血功能检验,包括凝血酶原活动度(prothrombin activity,PTA)、凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、国际标准化比值(international normalized ratio,INR)、纤维蛋白原(fibrinogen,Fib)、D-二聚体及血栓弹力图(thromboelastogram,TEG)(包括R、K、Angle、MA、EPL、LY30、A、CI、G、A30),血管超声评估RIC干预侧深静脉血栓(deep venous thrombosis,DVT)是否发生。
1.2 纳入和排除标准 纳入标准:①年龄18~75岁;②脑血管造影证实颅内动脉瘤,Hunt-Hess分级≤Ⅳ级;③本人或法定代理人同意参加本研究;④在发病48 h内入院,通过栓塞和(或)夹闭治疗了责任动脉瘤;⑤纳入时间在发病72 h内。排除标准:①未针对破裂的动脉瘤进行治疗或无法治疗;②伴有严重心血管疾病;③发病48 h后入院;④既往有脑梗死或术后24 h内计算机断层扫描显示脑梗死;⑤伴有肢体血管闭塞性疾病及其他无法耐受治疗的疾病或状况;⑥治疗动脉瘤需要放置支架。
1.3 干预方式和数据采集 所有RIC干预均在患者常规治疗下进行,在aSAH后72 h内接受动脉瘤夹闭和栓塞治疗后至10 d内,7 d内进行5次RIC干预(注:所有干预均在aSAH后10 d内进行,但均在7 d内完成干预),采用血压袖带加压,给予肢体180 mm Hg压力(若患者收缩压>180 mm Hg,则加压为患者收缩压以上20 mm Hg),每次干预5个周期,每周期包括5 min加压充气,直至远端动脉搏动消失,5 min放气再灌注。干预期间常规监测患者血压、心率、呼吸变化,对于意识清楚患者进行疼痛视觉模拟评分,如患者不能耐受,则终止干预,患者退出该治疗干预方案。
1.4 统计学处理 使用SPSS 17.0统计软件进行数据处理与分析,计数资料采用百分率(%)表示,计量资料以表示,组间比较采用配对t检验,以P<0.05为差异有统计学意义。
2 结果
24例aSAH患者中男9例,女15例,年龄36~73岁,平均(55.5±9.0)岁;根据Hunt-Hess分级,Ⅱ级11例,Ⅲ级9例,Ⅳ级4例;责任动脉瘤包括后交通动脉瘤7例,前交通动脉瘤6例,大脑中动脉瘤5例,脉络膜前动脉瘤4例,小脑后下动脉瘤1例,大脑前动脉瘤1例;根据治疗方式,开颅手术12例,介入治疗12例,所有患者围手术期均未使用抗血小板药物或抗凝治疗。
凝血检验结果显示,RIC干预前后,患者APTT和D-二聚体无显著性变化,PTA在干预后下降(t=3.171,P=0.004),PT(t=-2.581,P=0.017)、INR(t=-3.309,P=0.003)和Fib(t=-2.304,P=0.031)在干预后略有升高,但其平均值均在正常参考值范围内(表1)。RIC干预前后,患者TEG参数中仅MA略有升高(t=-2.173,P=0.040),但仍在正常参考值范围内,其他参数R、K、Angle、EPL、LY30、A、CI、G、A30均无显著性变化(表2)。RIC干预前后,患者均未见加压肢体DVT发生。

表1 RIC干预对aSAH患者凝血功能的影响
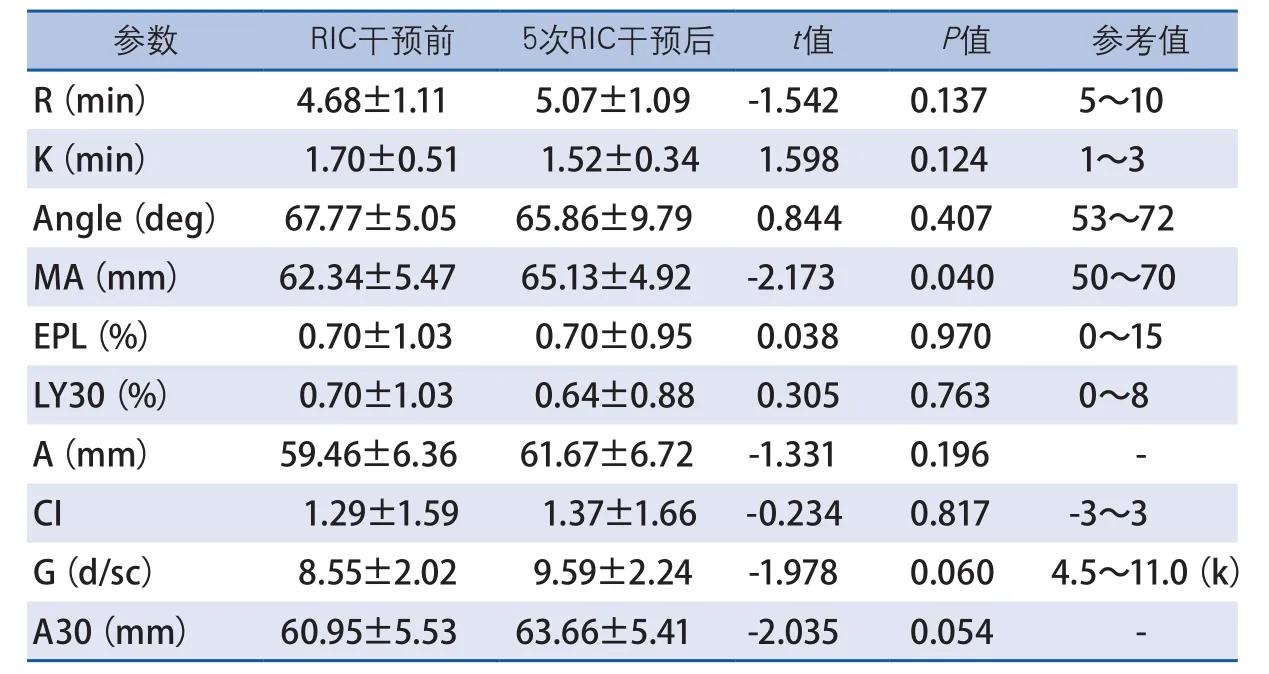
表2 RIC干预对aSAH患者TEG的影响
3 讨论
有研究提示,RIC对远隔组织器官的保护作用可能涉及多种机制、介质-受体-基因表达等多个环节[5]。近年来诸多基础及临床研究证实,RIC对心脏、肺、肾脏、肝脏、肠等多个靶器官具有保护作用[6-10],亦对缺血性脑损伤及缺血性脊髓损伤有神经保护作用,为缺血性脑与脊髓损伤提供了一种有前景的治疗方式[11]。在缺血性脑血管病研究方面,Wenbo Zhao等[12]对重度动脉粥样硬化性颈动脉狭窄患者在行颈动脉支架置入术前给予RIC治疗,可通过改善机体炎性反应降低术后相关栓塞发生率,为进一步提高颈动脉支架置入术的安全性、降低远期不良事件发生率提供了新的治疗措施。对于颅内动脉粥样硬化患者,使用血压计加压行短暂重复双上肢缺血,可以改善脑灌注,减少卒中复发[13]。
RIC在出血性脑血管病中的研究尚不多,因蛛网膜下腔出血的研究起步较晚,需要深入探索。aSAH是一种临床常见的急危重脑血管病,尽管只占卒中的5%[14],但发病年龄相对较轻(40~60岁为发病高峰),病情较其他类型卒中更加严重,是神经外科基础和临床研究的热点之一。随着影像诊断技术、显微神经外科手术技术和介入治疗技术及材料的不断进步,aSAH的病死率在过去20年内下降近50%,并且仍在以每年0.9%的速度下降[15]。然而存活者的神经功能缺损却没有同步改善,约有2/3的患者遗留神经功能缺损。尽管单纯解决了动脉瘤的再出血问题,但并不能彻底改善临床预后。早期脑损伤是造成蛛网膜下腔出血患者不良结局的主要原因,蛛网膜下腔出血后继发的脑血管痉挛、脑血管自动调节功能损伤、微血栓等多种因素造成的迟发性脑缺血损伤也是影响预后的重要因素。约30%的aSAH患者出现缺血性卒中症状,15%~20%的患者发生致残性的脑梗死[16-17]。溶血产物、炎性反应、内皮细胞损伤等各种因素均参与aSAH后的病理过程,aSAH后脑血管痉挛、早期脑损伤及迟发性脑缺血的作用越来越受到重视[18]。而RIC在蛛网膜下腔出血后缺血性脑损伤发生前有治疗的窗口期。有报道显示,既往存在慢性缺血性脑血管病与aSAH后出现脑血管痉挛的关系,即既往存在“自然IPC”的患者造影显示脑血管痉挛发生率下降。IPC对人确实存在保护急性缺血性脑损伤的作用[19]。而在不同疾病中RIC干预对患者的安全性需要进行相应的多方面评估,如本研究中对aSAH患者进行凝血功能的评估,RIC是否会增加患者加压肢体DVT的发生率。只有在安全性得以保证的前提下,才有利于进一步开展有效性的评估,以及本干预措施在临床中的推广应用。
既往Fernando Mayor等[20]报道监测RIC对aSAH患者凝血功能影响的情况,21例aSAH患者在出血后2~12 d,每24~48 h接受1次RIC干预,所有患者均皮下注射低分子肝素预防DVT,监测每次RIC干预前后的PTT、PT、INR及出血并发症,结果显示每次干预前后差异均无统计学意义(9例),但在21例患者中至少4次RIC干预后,PTT和INR明显延长,且与干预次数直接相关,但仍在正常参考值范围内,且未引起再出血、脑实质内新发出血等出血并发症,而年龄、性别相仿的对照组患者(同样接受皮下注射低分子肝素治疗)的PTT和INR相同随访期内无明显变化。因此,该治疗虽可直接作用于aSAH患者的外源性凝血途径,但应用于aSAH患者时,对凝血功能的影响至少是安全的,而且这种轻度的抗凝作用可能通过抑制患者的高凝状态发挥保护作用。该研究纳入了Hunt-Hess Ⅴ级的蛛网膜下腔出血患者,为RIC在各个级别蛛网膜下腔出血患者中的应用提供了初步的经验和凝血安全性的基础。本研究结果显示,即使患者在干预前后部分参数出现变化,但整体凝血功能仍大致在正常范围内。此外,TEG检测结果也进一步证实在干预前后RIC对患者的凝血功能无明显影响。
Nestor R. Gonzalez等[21]发表了Ⅰ期临床观察研究,结果显示76次RIPC干预期间,患者均未出现RIPC相关的症状性下肢静脉血栓形成或肢体青肿损伤,2例患者在RIPC完成后的11 d和18 d出现症状性DVT,但该2例患者在RIC完成后及DVT出现前,曾因高热行同侧股静脉导管置入,提示患者安全性和耐受性良好,而且参与试验的患者中未出现迟发性脑缺血。Azim N. Laiwalla等[22]报道的一项临床对照研究发现,在年龄、性别、动脉瘤位置、动脉瘤干预方式(夹闭或栓塞)、Fisher分级及Hunt-Hess分级差异均无统计学意义的情况下,患者RIC干预前后未见DVT发生。在本研究中,RIC干预后肢体超声监测均未发现DVT发生,提示RIC应用于aSAH患者未促进DVT的发生,这可能是因为RIC是一种加压装置,其作用于肢体深静脉,有预防DVT的效果,但RIC是否会预防并减少肢体DVT的发生率,尚需进一步对照研究证实。

