经肝动脉化疗栓塞术联合RFA对大肝癌血清炎症因子、免疫功能的影响及疗效分析
,, ,
(湖南省中医药研究院附属医院,湖南 长沙 410006)
肝癌在我国较为常见和多发,目前肝癌切除术仍是治疗的首选,但有60%~80%的患者因肿瘤多发、肿瘤巨大或合并肝硬化而无法手术切除。对于不能手术切除的肝癌,首选方法为经肝动脉化疗栓塞(transcatheter arterial chemoembolization,TACE),但远期效果并不理想,研究指出[1],TACE联合经皮射频消融(radiofrequency ablation,RFA)能使直径≥5 cm的大肝癌患者预后有效改善,但存在一定争议。本研究通过对2015年3月至2018年3月期间我院收治的大肝癌患者临床资料进行分析,探讨大肝癌采取TACE联合RFA治疗的临床疗效及对血清炎症因子、免疫功能的影响,现报道如下。
1 资料与方法
1.1一般资料选取2015年3月至2018年3月我院收治的大肝癌患者60例。纳入标准:1)患者均经血清甲胎蛋白(alpha fetoprotein,AFP)、影像学检查(B超、MRI、CT及肝动脉造影)诊断为中晚期肝细胞癌;2)患者一般状况良好,KPS评分不低于70分;3)肝功能Child-Pugh分级为A或B级;4)未发现肝外转移,无腹水、黄疸;5)无TACE或RFA治疗禁忌;6)不伴有门静脉或下腔静脉癌栓(portal vein tumor thrombus,PVTT);7)不能手术或不愿接受手术治疗;8)患者均知情同意,并经医院伦理委员会批准。将入选者根据治疗方式不同分为对照组(n=30)与观察组(n=30)。观察组中,男16例,女14例,年龄35~72(48.5±5.3)岁;对照组中,男17例,女13例,年龄34~73(48.6±4.5)岁。2组大肝癌患者年龄、性别等资料比较差异无统计学意义(P>0.05),具有可比性。
1.2方法2组均行TACE治疗,采用Seldinger法穿刺股动脉,于肝总动脉、肝左右动脉及肝固有动脉处超选择性置入导管,行动脉造影,确定肿瘤供血动脉后,将化疗药物和栓塞剂注入。选择奥沙利铂(130 mg·m-2)、5-Fu(500 mg·m-2)。采用超液态碘化油,根据癌灶大小选择合适剂量的吡柔比星混悬液和碘化油,必要时可用明胶海绵对血管作进一步栓塞。2组均间隔1~2个月进行一次TACE治疗,治疗1~3次。观察组在TACE治疗2~4周后行RFA治疗,采用LDRF120S多极RFA仪,予以局麻,在CT或B超引导下,选择穿刺点及穿刺途径,对治疗程序进行设定,根据肿瘤大小、位置、形态等对RFA参数进行调整,采用距表皮由远及近的原则,采用多针重叠、多次叠加的消融方法,消融应将肿瘤及超过病灶区0.5~1.0 cm的区域完全覆盖。
1.3观察指标术后1个月时采用CT或MRI对瘤体大小进行检测。采用mRECIST标准,将近期疗效分为完全缓解(CR)、部分缓解(PR)、稳定(SD)及进展(PD)。以CR+SD+PR计算疾病控制率[2]。于治疗前、治疗后1个月清晨患者空腹状态下抽取2 mL外周静脉血,外周血CD3+、CD4+/CD8+通过酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)检测。应用双抗体夹心ELISA测定降钙素原(procalcitonin,PCT)及肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)水平,C反应蛋白(C-reactive protein, CRP)采用散射免疫比浊法测定。

2 结果
2.12组近期疗效比较观察组疾病控制率显著高于对照组,差异有统计学意义(P<0.05)。见表1。
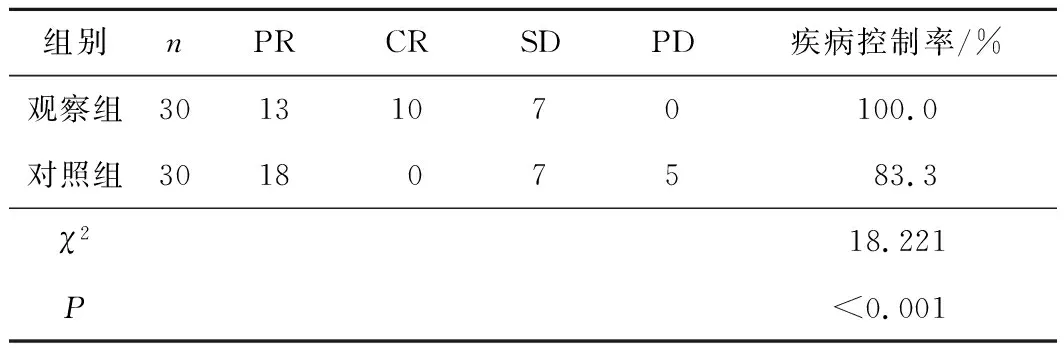
表1 2组近期疗效比较
2.22组血清炎症因子水平比较治疗后,观察组各项炎症因子水平显著低于对照组,差异有统计学意义(P<0.05)。见表2。
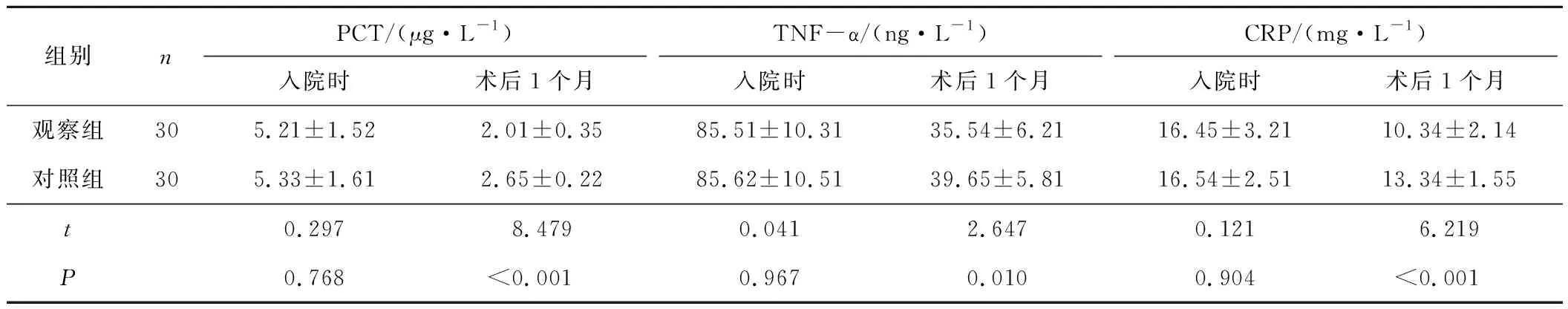
表2 2组血清炎症因子水平比较
2.32组免疫功能指标比较治疗后,观察组CD3+、CD4+/CD8+水平均有效改善,且优于对照组,差异有统计学意义(P<0.05)。见表3。
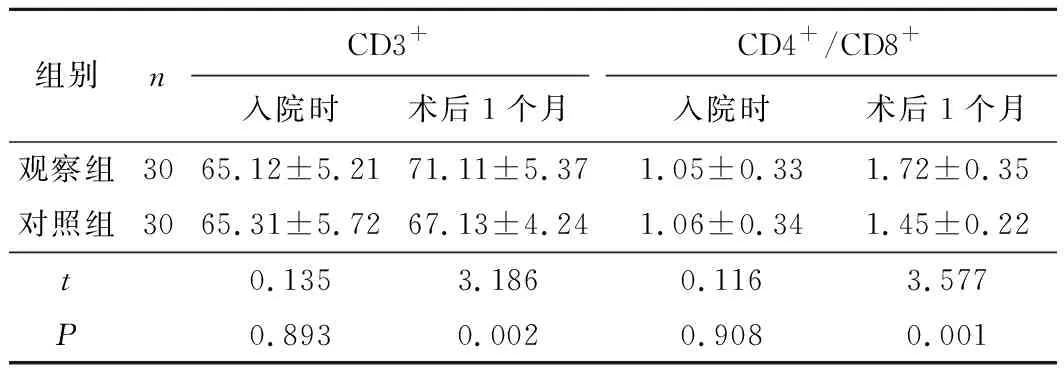
表3 2组免疫功能指标比较
3 讨论
对于中晚期肝癌患者,临床目前多采取以TACE为主的综合疗法治疗。TACE主要是于肿瘤的供血动脉内注入化疗药物及栓塞剂,使肿瘤细胞发生缺血缺氧,进而导致细胞凋亡坏死。但大肝癌患者由于肿瘤供血动脉比较复杂,瘤体较大,单纯TACE治疗肿瘤坏死率较低,一般肿瘤完全坏死率仅为1.5%~5.5%,同时,TACE能促使病灶周边形成侧支循环,从而导致TACE术后原位复发。RFA是一种热消融技术,其治疗效果取决于交变电流的持续时间及强度,且是一种非电离辐射,对人体无危害,在B超或CT引导下,将电极放置于病灶内,通过其发出的高频对病灶进行等离子震荡,离子间相互摩擦和碰撞可使组织局部温度达60 ℃,使肿瘤细胞发生凝固性坏死,另外其还能切断肿瘤血供,从而阻断肿瘤转移,适用于直径<4 cm的肿瘤,对于小肝癌疗效接近于手术切除,而对于直径≥4 cm的肝癌疗效较差,肿瘤残存率较高。
近年来,诸多研究[3]显示,TACE与RFA联合治疗原发性肝癌具有协同增效作用,主要与以下几点因素有关:1)TACE使肿瘤的供血血管减少和闭塞,减少RFA治疗中血流的冷却效应,使RFA时肿瘤的坏死范围增加,且TACE后肿瘤组织容易形成包膜,使RFA治疗中热量主要集中于肿瘤区域,不易向外肿瘤外弥散,使肿瘤彻底灭活率提高;2)RFA时的热效应使肿瘤组织对化疗药物的敏感性增加,增强化疗药物对肿瘤的杀伤性;3)TACE可标记并治疗RFA治疗范围以外的卫星病灶,弥补后者治疗范围局限的缺陷。对于介入治疗的肿瘤组织,若MRI检查仍有肿瘤存活或碘油沉积不密实,则可加用RFA治疗,RFA可使残留肿瘤组织进一步坏死,对于血供少的肿瘤组织,联合RFA治疗可提高临床疗效。针对中晚期肝癌,且癌灶≥5 cm者,可先行TACE治疗,在肿瘤缩小、部分坏死后,再行RFA治疗,能提高肿瘤彻底坏死率。研究[4]显示,TACE联合RFA治疗肿瘤完全坏死率较RFA或TACE单一治疗组明显要高。本研究结果显示,观察组疾病控制率显著高于对照组(P<0.05);治疗后,观察组CD3+、CD4+/CD8+水平均有效改善,且优于对照组(P<0.05)。可见TACE联合RFA治疗,能显著改善机体免疫功能,考虑原因为以下几点:1)肿瘤细胞被杀死后,肿瘤细胞负荷减少,从而减少其免疫抑制因子的产生,使免疫功能得到改善;2)RFA术后局部免疫原性提高,增加抗肿瘤效应细胞浸润,从而改善免疫功能。研究[5-7]发现,炎症因子在肝癌的发生、发展中起重要作用,其中CRP、PCT与肝癌的发生风险呈显著相关,而TNF-α是诱导上皮间质角化的主要因子,可促使肿瘤细胞的侵袭,其水平的升高往往预示着肿瘤预后不良。本研究结果还显示,相比于对照组,观察组患者的血清炎症因子显著降低,提示TACE联合RFA治疗能有效抑制机体内炎症因子的释放,从而促进病情的改善。
综上所述,采取TACE联合RFA治疗大肝癌可提高疗效,改善机体免疫功能及机体炎症反应,具有临床推广价值。

