程序性死亡受体1抑制剂治疗晚期恶性肿瘤的临床观察
,,,, ,
(1.涿州市医院放疗科,河北 涿州 072750;2. 解放军总医院第一附属医院肿瘤一科,北京 100048)
程序性死亡受体1(programmed death receptor-1,PD-1)主要表达于活化的T细胞上,是一种抑制性受体,与其配体PD-L1结合,可显著抑制T细胞的活化和增值,并调节细胞因子的表达和分泌。PD-L1则广泛表达于多种免疫细胞、上皮细胞、肿瘤细胞上。多种人类肿瘤细胞大量表达的PD-L1分子与患者临床病理特征及预后紧密联系。肿瘤细胞通过高表达PD-L1,与T细胞上的受体PD-1结合,传递负调控信号,导致肿瘤抗原特异性T细胞的诱导凋亡和免疫无能,使肿瘤细胞逃逸机体的免疫监控和杀伤[1]。目前美国FDA批准的PD-1抑制剂有Nivolumab和Pembrolizumab[2-3]。PD-1抑制剂已经在多种类型的肿瘤患者中获得较好的疗效[4-10]。本研究回顾性观察30例采用PD-1抑制剂治疗的晚期肿瘤患者,分析其临床疗效和不良反应。
1 资料与方法
1.1临床资料入组2015年7月至2017年12月解放军总医院第一附属医院使用PD-1抑制剂(Pembrolizumab、Nivolumab)治疗的晚期恶性肿瘤患者30例,其中霍奇金淋巴瘤8例、弥漫大B细胞淋巴瘤1例、肺癌14例、滤泡树突状细胞肉瘤1例、卵巢癌1例、食管癌1例、胃癌1例、胆管癌1例、肾癌1例;男20例,女10例;年龄13~88岁;PD-1抑制剂一线治疗5例,二线治疗7例,三线及以上治疗18例;25例为单独应用PD-1抑制剂,5例联合化疗。所有患者至少具有一个可客观评价病灶。
1.2治疗方法所有患者均接受PD-1抑制剂(Pembrolizumab、Nivolumab)静脉滴注治疗,持续用药至出现肿瘤进展或不可耐受的不良反应,治疗2周期(Pembrolizumab)或3周期(Nivolumab)后进行疗效及不良反应评价,直至出现疾病进展或不可耐受的不良反应。
1.3评价标准根据RECIST实体肿瘤标准评价近期疗效,分为完全缓解、部分缓解、疾病稳定和疾病进展。以完全缓解+部分缓解计算有效率,以完全缓解+部分缓解+疾病稳定计算疾病控制率。疾病无进展生存时间是指患者接受该方案治疗时至疾病进展或发生因为任何原因的死亡之间的时间。不良反应根据化疗药物不良反应分度标准进行评价。
1.4统计学处理采用SPSS 22.0进行统计分析,计数资料比较用Fisher确切概率法,检验水准α=0.05。
2 结果
2.1近期疗效所有患者使用PD-1抑制剂2周期(Pembrolizumab)或3周期(Nivolumab)后首次评价,完全缓解0例,部分缓解10例,疾病稳定8例,疾病进展12例,有效率为33.3%(10/30),疾病控制率为60.0%(18/30)。淋巴瘤亚组有效率66.7%,疾病控制率88.9%。肺癌亚组有效率28.6%,疾病控制率57.1%。见表1。
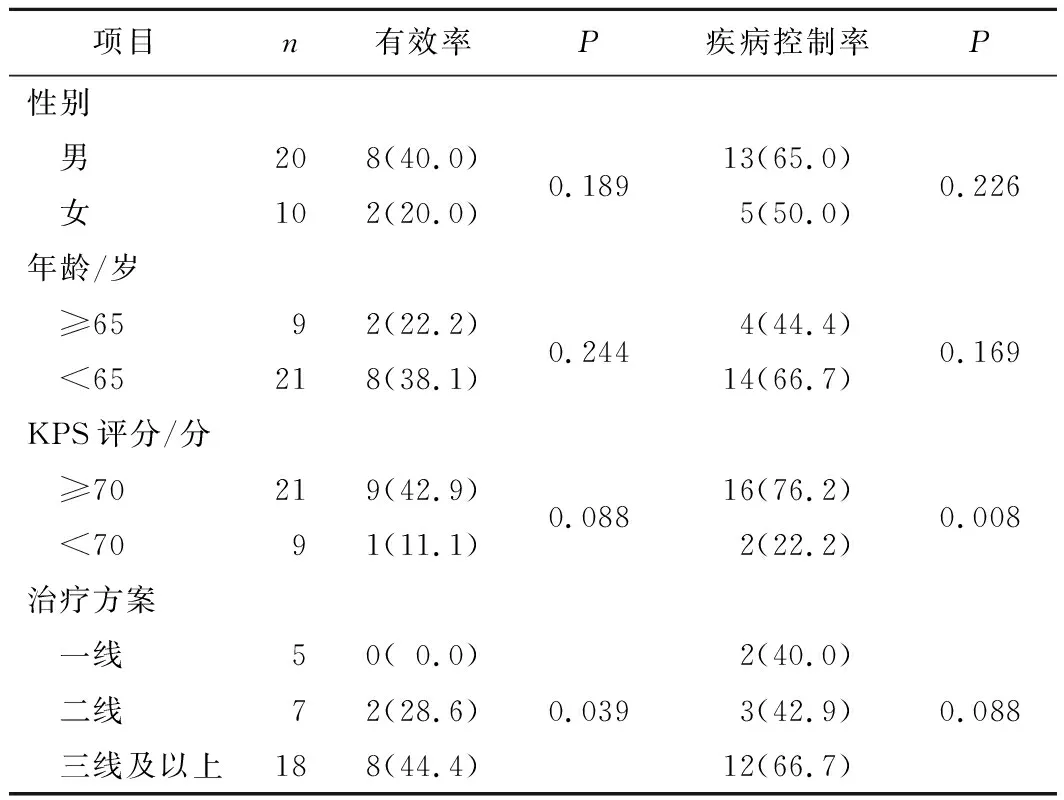
表1 30例患者的近期疗效 n(%)
2.2疾病无进展生存时间截止2017年12月30日随访结束,18例患者出现疾病无进展生存时间终点事件,14例出现总生存时间终点事件,中位疾病无进展生存时间为102 d。淋巴瘤亚组中位疾病无进展生存时间为320 d。肺癌亚组中位疾病无进展生存时间为84 d。
2.3不良反应全组不良反应发生率53.3%,其中Ⅰ、Ⅱ度占90.9%,Ⅲ、Ⅳ度占9.1%。见表2。
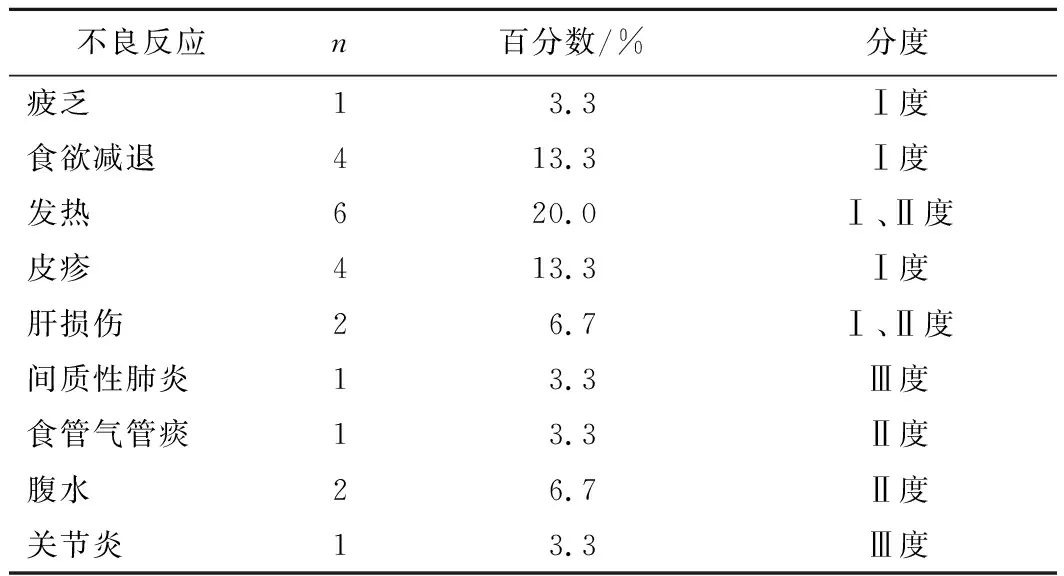
表2 不良反应 n(%)
3 讨论
PD-1和PD-L1免疫疗法是通过药物阻断PD-1、PD-L1通路,激活人体自身的免疫系统攻击肿瘤细胞,虽然获批治疗的恶性肿瘤较多,但在不同类型的肿瘤患者中实际疗效存在差异。一项Ⅲ期临床试验,试验对象为305例局部晚期非小细胞肺癌,且PD-L1表达≥50%,没有EGFR或ALK基因突变,比较PD-1抗体组与化疗组的疾病无进展生存时间和总生存时间,结果显示,在KEYNOTE-024研究中,一线应用Pembrolizumab较化疗组具有更好的疾病无进展生存时间和总生存时间,以及更轻的不良反应[11]。目前国外的临床试验表明,对于没有表皮生长因子受体及ALK基因突变的晚期非小细胞肺癌患者,PD-1抑制剂推荐为一线治疗,效果优于化疗。对于晚期肺癌患者,无论有无PD-L1表达,都可以尝试PD-1抑制剂治疗。
PD-1抑制剂治疗霍奇金淋巴瘤、弥漫大B细胞淋巴瘤或滤泡淋巴瘤的疗效良好,但是作用机制不同。小剂量PD-1抑制剂可诱导某些淋巴瘤亚型的缓解。霍奇金淋巴瘤的恶性细胞通常不表达PD-1,但是有报道显示PD-1阳性肿瘤浸润淋巴细胞疗效较好[12-13]。
有研究[14]报道259位晚期胃癌患者,二线、三线,甚至四线,单药使用PD-1抑制剂(Pembrolizumab),有效率11.2%,疾病控制率17.0%。其中PD-L1表达阳性患者的有效率高达15.5%,而PD-L1表达阴性患者的有效率只有5.5%。PD-1抑制剂在膀胱癌中也取得了可观的成绩。Ⅰ期和Ⅱ期临床试验表明PD-1抑制剂在不适合使用含顺铂化疗的晚期患者中发挥着重要作用[4]。
本研究30例晚期恶性肿瘤患者中,有效率33.3%,疾病控制率60.0%,中位疾病无进展生存时间为102 d。其中淋巴瘤亚组有效率为66.7%,疾病控制率为88.9%。肺癌亚组有效率为28.6%,疾病控制率为57.1%。肺癌亚组14例患者中4例使用PD-1治疗后部分缓解,均是与化疗联合治疗,另肺癌亚组PD-L1表达阳性患者有效率为55.6%(5/9)。有研究表明在未经挑选的晚期患者中,单独使用PD-1抑制剂,有效率10%~30%。本研究整体有效率尚可,考虑与本研究中淋巴瘤及肺癌病例数较多有关,且肺癌患者一部分检测PD-L1作为治疗筛选条件。虽然有些类型的恶性肿瘤疾病控制率偏低,但PD-1抑制剂对绝大多数肿瘤都可以尝试使用。为了进一步提高有效率,联合治疗是趋势。
由于不同肿瘤对PD-1抑制剂治疗的有效率差异较大,筛选适合治疗的病例显得尤为重要,研究表明有4种情况使患者更加适合使用PD-1抑制剂:1)患者的PD-L1表达程度高:PD-L1阳性病例比PD-L1阴性病例具有更好的反应率,阳性病例反应率约是阴性病例的1.5~3倍(因肿瘤类型、治疗方案的不同而不同)。多项关于PD-L1检测的临床试验表明,PD-L1表达水平对预测免疫治疗在非小细胞肺癌、黑色素瘤、霍奇金淋巴瘤等多瘤种的疗效上都起到重要作用[1, 5, 12, 14];2)肿瘤突变负荷:在2017年世界肺癌大会上公布的一项研究显示:211例患者有肿瘤突变负荷,其中高突变负荷患者当中,Nivolumab单用的总应答率为21%,联用(与Yervoy联用)应答率为46%。而在中、低突变负荷的患者中,Nivolumab单用1 a总生存率只有26%、22%。不过,结直肠癌是一个例外,结直肠癌具有较高的肿瘤突变负荷,却对免疫疗法的总体应答较低[15-17];3)dMMR/MSI-H类型的实体瘤患者:5项多中心单臂研究,共有149例dMMR/MSI-H肿瘤患者参与。这些患者一共有15种不同类型的实体瘤:小细胞肺癌、胰腺癌、胃癌、胆管癌、子宫内膜癌、乳腺癌、前列腺癌、食管癌、结直肠癌等。患者有效率为39.6%,48例患者获得部分缓解,11例患者获得完全缓解,其中缓解时间达到半年以上的患者超过了78%。在90位结直肠癌患者中,患者缓解率为36%,其他14种不同恶性肿瘤患者(n=59例)总体缓解率为46.5%[18-19];4)曾接受过放疗的患者:放疗会活化免疫系统中与免疫治疗耐药相关的关键部分,很多肿瘤细胞并不表达MHC-I分子、或表达水平较低,而放疗可以上调这类分子以及肿瘤相关抗原的表达。放疗联合不同形式的免疫治疗如PD-1抑制剂可以起到改善肿瘤局部控制、并诱导产生具有记忆功能的特异性抗肿瘤免疫效果。进行过颅脑外照射的患者,其6个月疾病无进展生存率为54%,而未行颅脑外照射患者的这一比例仅为21%[20]。
PD-1抑制剂的不良反应相比于传统放化疗要小得多,严重不良反应的发生率降低一半甚至更多。并不是说PD-1抑制剂就毫无风险,大约5%~10%的患者,会出现严重的免疫相关的炎症反应:免疫性肺炎、免疫性肠炎、免疫性肝炎、甚至免疫性心肌炎,此外部分患者会出现垂体炎和甲状腺减退症。对于不同部位的免疫相关毒性的出现似乎有规律可循,皮肤毒性通常用药后2~3周开始出现,胃肠道毒性通常用药后5周左右出现,肝脏和内分泌毒性通常用药后6周左右出现上述免疫性炎症,如果发现不及时,处理不到位,偶尔发生致命的事故[21-22]。本研究中有1例关节炎及1例间质性肺炎出现Ⅲ度不良反应,给予激素治疗后症状改善,其中发生间质性肺炎的患者终止治疗,发生关节炎的患者使用激素后继续PD-1抑制剂治疗。另有1例小细胞肺癌的患者使用PD-1抑制剂4周期后出现食管-气管瘘,行食道支架后继续PD-1治疗,但后期因反复肺部感染、呼吸功能衰竭而死亡。
PD-1抑制剂治疗晚期恶性肿瘤有一定疗效,但在不同类型的肿瘤中疗效存在差异,淋巴瘤患者疗效最优,由于病例数较少,可能存在主观选择偏倚及其他混杂因素。尽管其耐受性良好,严重不良反应少见,但因其阻断免疫抑制通路的同时,可累及绝大多数正常组织,引起免疫相关不良反应多且复杂,对于临床医师而言应该提高警惕,不仅仅关注抗肿瘤疗效,对不良反应,也要予以重视,做到早诊断早治疗,降低危险,改善预后。

