肺癌细胞株侧群细胞的分选及干细胞特性的鉴定
度 蔚,陈昭颖
(武汉市精神卫生中心检验科 430012)
肺癌的发病率和病死率居我国恶性肿瘤首位,有80%的患者为非小细胞肺癌(NSCLC),在诊断时,70%的NSCLC患者都已经达到晚期,5年生存率较低[1]。肺癌的复发和转移成为患者长期生存的重要因素[2]。有研究显示,在肿瘤的发生、发展过程中,肿瘤干细胞(CSC)具有非常重要的作用。此种细胞是指具有多向分化潜能、无限自我更新的干细胞生物学特性的一种细胞群体[3]。侧群细胞(SP细胞)是在流式细胞实验中发现的一组细胞亚群,含有丰富的造血重建细胞,存在较为明显的干细胞特性[4]。研究发现,大部分肿瘤SP细胞中可能含有大量的肿瘤起始细胞,在实验过程不仅在体外表现出显著的增殖活力,而且在体内异种移植瘤实验中也表现出较强的成瘤能力,比非SP细胞(NSP细胞)明显较强[5]。针对此种情况,本研究旨在对分选肺癌细胞株SP及鉴定其干细胞特性进行分析,从而更好实施肺癌的预后评估以及靶向治疗。
1 材料与方法
1.1材料来源 肺癌细胞株NCI-H460和SK-MES-1购买自中国科学院细胞库,在常规复苏结束之后通过RPMI 1640培养基进行培养,其中还包括了链霉素100 μg/mL、青霉素100 U/mL和10%的胎牛血清。然后将培养基放置在37 ℃,CO2饱和湿度为5%的培养箱中进行培养,定期更换培养液,进行传代培养。选择从上海生工动物实验中心购买的18只BALB/C裸小鼠进行裸鼠成瘤实验,小鼠均为雌性,且均为4周龄大小,正常的方式进行饲养,适应1周。
1.2方法 通过流式细胞仪对SP与非SP细胞进行分选,然后进行培养并且传代,选择的培养基分别为正常情况及干细胞培养基。对细胞分化能力与表型进行观察;通过电镜对细胞进行观察,了解其超微结构;利用免疫荧光对干细胞标志物CD44的表达进行检测;利用CCK-8法对细胞增殖能力进行检测,平板克隆、裸鼠成瘤实验及Transwell侵袭实验对细胞进行了解,明确其恶性程度。
1.2.1流式细胞仪分选SP细胞 选择对数生长期细胞,然后采取胰酶消化并进行离心操作,选择含2%胎牛血清的RPMI 1640培养液重悬,制备浓度为1×106/mL单细胞悬液。加入Hoechst 5 μg/mL和维拉帕米50 μmol/L,采取水浴孵育的方式,温度设定为37 ℃,时长为60 min;当染色完成后马上放置在冰上,然后停止染色操作,进行离心,并且充分的洗涤与重悬后,将1 μg/mL的碘化丙啶加入其中,放置30 min;选择美国BD公司生产的流式细胞仪进行分选,按照加维拉帕米组的流式,即“门”的图形来设定未加维拉帕米组流式图形的SP区域。
1.2.2观察细胞表型和分化能力 对干细胞培养基进行配置:DMEM/F12(1∶1)培养基+表皮细胞生长因子(20 μg/L)+重组(人)碱性成纤维细胞生长因子(20 μg/L)+B27(2%),培养基选择RPMI 1640培养液,其中加入10%胎牛血清,重悬细胞浓度为1×105/mL;选择直径为6 cm的培养皿,定期更换培养液,进行传代培养。培养3 d之后,通过倒置显微镜对细胞形态进行观察并拍照,然后重复3次实验。进行连续培养直到第5代,然后对SP细胞的分化能力与比例进行检测。
1.2.3电镜观察超微结构 单细胞悬液的标准为1×106/mL,然后进行离心运动,转速为1 000 r/min,时长为5 min,然后进行洗涤,结束之后继续进行离心操作;通过乙醇进行固定,然后进行离心操作等一系列过程中,最终进行充分的洗涤;进行离心操作,在4 ℃环境下,在1%四氧化锇的环境中固定2 h;首先进行脱水操作,然后利用618号树脂进行包埋处理,再者通过Reicher超薄切片机进行切片,最后利用Philips CM120透射电镜进行观察。
1.2.4免疫荧光检测CD44的表达 选择标准为2×104/mL的细胞,然后接种在培养皿中进行细胞爬片,培养3 d后通过免疫荧光进行检测;首先进行洗涤处理,然后放置在4%多聚甲醛进行固定,时长为30 min,然后继续洗涤,然后加入10%封闭液放置在室温环境中30 min;通过滴加的方式加入美国Sigma公司生产的鼠抗人单克隆一抗,标准为1∶2 000,放入到37 ℃环境中进行孵育,时长为2 h,然后放入到4 ℃环境中过夜;通过滴加的方式加入美国Sigma公司生产的羊抗鼠多克隆抗体IgG二抗,标准为1∶2 000,放入到37 ℃环境中进行孵育,时长为45 min,采取闭关处理;选择的标准为10 μg/mL DAPI,放入到37 ℃环境中进行孵育,时长为10 min,然后进行洗涤处理,烘干操作;最后盖上玻璃片进行封片处理,通过荧光显微镜进行观察并且拍照。
1.2.5细胞增殖能力和恶性程度 CCK-8法:选择具有96个孔的孔板进行接种,每孔接种的细胞数量标准为1×104/mL,接种结束后通过CCK-8试剂分别对第2、5和7天的情况进行检测,通过光吸收度值(AV值)来衡量活细的胞增殖速度。每个组中设置有重复孔,具体数量为5,重复3次实验取得平均值。
平板克隆:1×104/mL重悬细胞,培养板为6孔,选出100 μL进行接种,选择的培养液为RPMI 1640,其中加入了15%胎牛血清,培养液的容量为3 mL,每个组中设置有重复孔,具体数量为3,然后将培养基放置在37 ℃,CO2饱和湿度为5%的培养箱中进行培养,时长为2周;结束后,每孔加入的染液标准为1∶10 Giemsa,在室温环境下进行染色,时长为10 min,对克隆的形成过程进行观察并计数。
Transwell侵袭实验:创造出人工重组基底膜,对细胞浓度进行调整,具体标准是1×106/mL,把Transwell小室的上室浸入到下室培养液当中,上室中加入细胞悬液,容量为100 μL,在下室中加入培养液RPMI 1640,容量为600 μL,培养液中还加入了20%胎牛血清;小室放置在培养箱中进行孵育,时长为24 h,然后进行充分的洗涤,利用浓度为75%的乙醇进行固定,时长为10 min,然后4%台盼蓝进行染色,时长为10 min,继续洗涤,然后通过200倍光镜对微孔滤膜下室面侵袭的肿瘤细胞数进行计数,每张膜选择上、中、下、左、右5个不同的视野,选择平均值。重复3次实验。
裸鼠成瘤实验:通过随机数字表法将祼鼠进行分组,共包括3组,每组6只,每组接种的细胞数量分别为104、105和106个。然后,通过RPMI 1640培养液和Matrigel混合液(1∶1)重悬细胞为5×104/mL、5×105/mL和5×106/mL 3个浓度。浓度为10%的水合氯醛,共75 μL对裸鼠进行麻醉,在腋下皮下进行注射细胞悬液,容量为200 μL,8周后将裸鼠处死,对转移及成瘤的情况进行观察,取出瘤体行HE和免疫组织化学染色。
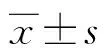
2 结 果
2.1流式细胞仪分选SP细胞 初次分选NCI-H460和SK-MES-1细胞株NSP和SP细胞所占百分比,与再纯化细胞株NSP和SP细胞所占百分比进行比较,差异均无统计学意义(P>0.05),见表1。

表1 流式细胞仪分选两种肺癌细胞株中SP细胞百分比和再纯化百分比
2.2细胞表型和分化能力 在干细胞培养基中,NSP和SP细胞都无法形成干细胞球,然而增殖速度较快。SP细胞具有较小的胞体,存在折光性及较长的神经丝样突起,表现集聚生长;NSP细胞具有较大的胞体,存在扁平的特征,以及没有神经丝样突起,表现接触抑制的单层生长。当培养到第5代时,SP细胞与NSP细胞分别表现出的是不显著的变化及混杂表型。其中,当培养到第4代的时候,NSP细胞表现出的是一致的表型,逐渐表现出分化能力,见图1。
2.3电镜观察超微结构 电镜下SP细胞具有较大的核体、细胞质较少,即具有较高的核质比;NSP细胞具有较小的核体、较多的细胞质,具有较低的核质比。从细胞器方面进行比较,SP细胞质显著少于NSP细胞,见图2。
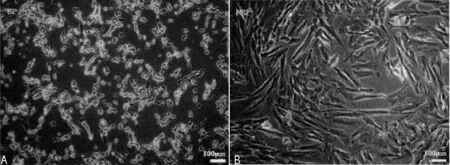
注:A为SP细胞表型;B为NSP细胞表型
图1光镜下观察SP和NSP的细胞表型(×200)

注:A为SP细胞超微结构;B为NSP细胞的超微结构
图2电镜观察SP和NSP的细胞超微结构(×1 000)
2.4免疫荧光检测CD44的表达 NCI-H460和SK-MES-1细胞株SP细胞能够对CD44高表达,组间比较差异无统计学意义(P>0.05),见表2。

表2 免疫荧光检测两种肺癌细胞株中SP和NSP细胞CD44的表达

表3 两种肺癌细胞株SP和NSP细胞不同培养时间的细胞增殖能力比较
注:与同细胞株同时间NSP细胞比较,#P<0.05; 与同细胞株同细胞第2天比较,△P<0.05;与同细胞株同细胞第5天比较,*P<0.05
2.5细胞增殖能力 对比NCI-H460和SK-MES-1细胞株SP细胞与NSP细的AV值在第2、5和7天时的数据情况,前者明显比后者高,差异有统计学意义(P<0.05),见表3。
2.6细胞恶性程度 SK-MES-1和NCI-H460细胞株SP细胞平均克隆数和克隆形成率显著高于NSP细胞,侵袭过膜的平均细胞数增加,成瘤裸鼠数目增多,均无转移灶,瘤体HE和免疫组化染色证实为典型肺癌细胞,见表4。

表4 两种肺癌细胞株SP和NSP细胞的细胞恶性程度比较
注:与NSP细胞比较,#P<0.05
3 讨 论
实验表明,大部分肿瘤细胞系和肺癌组织都具有SP细胞,且存在类干细胞特性[6]。然而对于肺癌SP细胞而言,在生物学特性方面至今都没有给予肯定。本研究表明,经过初次分选之后,所得两种不同的肺癌细胞株SP达到3.5%,再纯化之后具有较高的百分比,传代培养细胞具有良好的生长状况。在干细胞培养基中,NSP和SP细胞都无法形成干细胞球,但具有更快的增殖速度;SP细胞表现出的是集聚生长,NSP细胞表现出接触抑制的单层生长;在传代培养过程中,SP细胞变化表现不显著,当培养到第5代时,NSP细胞表现出混杂表型,以及一定的分化潜能;通过电镜进行观察,从细胞核质方面进行分析,SP细胞较高,而NSP较低。这些都反映出SP细胞具有肿瘤的分化与增殖能力[7]。从CSC学说的角度进行研究,它们一方面启动了肿瘤的生长和形成,另一方面还对肿瘤的复发与转移具有重要的意义,是导致肿瘤异质性一项重要因素[8]。SP细胞中富含CSC,SP分选技术已成为富集CSC十分简单、有效方法。SP细胞具有高致瘤性、自我更新、多向分化、耐药潜能,这些特性与CSC十分相似,已成为研究CSC的重要切入点。
通过深入研究得知,SP细胞能够对CD44高表达,从增值能力进行对比发现SP细胞明显比NSP细胞高,克隆形成率和平均克隆数明显提高。在侵袭过膜方面,平均细胞数有所提高,成瘤裸鼠的数量也有所增加,都没有转移灶,瘤体HE与免疫组织化学染色都得到了证实,均属于典型肺癌细胞。需要注意的是肺癌细胞株SP细胞具有干细胞特性,在肿瘤的侵袭、增殖及分化等方面都有参与[9-10]。目前,在多种肿瘤细胞系如NSCLC、胃癌、肝癌、鼻咽癌、结肠癌、乳腺癌、子宫内膜癌等,和多种肿瘤组织如肝癌、胶质母细胞瘤、平滑肌瘤、骨髓等中成功分离得到SP细胞。在悬浮肿瘤细胞球的形成能力方面,在无血清培养基中SP细胞比NSP细胞更强;在SP细胞中ABCG2和CD133的表达强度比NSP细胞更强;SP细胞的耐药存活能力及体外增殖能力比NSP以及未分选出的细胞更强;在体外SP细胞能够发生分化现象,变成NSP细胞,然而NSP细胞无法分化成SP细胞,在裸鼠体中SP细胞的致瘤性非常强。
综上所述,本研究证实肺癌细胞中的确存在SP细胞,并且存在干细胞促瘤特性,为更好地研究肿瘤的靶向治疗及发生机制提供了依据。

