LncRNA ANRIL靶向miR-214的表达调控卵巢癌细胞增殖与侵袭行为*
余心华 张 华 张 波 祝雪毅
(1 枣阳市妇幼保健院妇产科,2 枣阳市第一人民医院肿瘤科,枣阳 441200)
卵巢癌是女性生殖系统恶性肿瘤的主要类型之一,也是全球范围内女性第二常见的恶性肿瘤和第一常见的肿瘤死亡原因[1]。患者5年生存率可达40%以上[2]。然而,由于晚期卵巢肿瘤高复发率和转移率,晚期卵巢癌的预后很差[3]。因此,需要进一步研究卵巢癌发生进展的分子机制,寻找有效的治疗方式。最近研究表明,生物体内存在长度超过200nt的长链非编码RNA(lncRNA)在多种恶性肿瘤细胞的致癌和发育过程中起着关键的生物学作用[4]。lncRNA可用于不同类型的恶性肿瘤的诊断和预后指标,并且可作为恶性肿瘤治疗的潜在靶标[5-6]。在卵巢癌中,一些差异表达的lncRNA,例如HULC[7]、MEG3[8]、GAS5[9]等,已被证实在卵巢癌中起到肿瘤启动因子或抑制因子的作用[10]。ANRIL在多种恶性肿瘤中均存在表达异常的现象,且对肿瘤的发展及行为具有一定的影响作用,ANRIL已被认为是一种致癌基因,在很多肿瘤中发挥作用[11-17]。然而,ANRIL在卵巢癌中的生物学作用和临床意义未进行全面的研究和揭示。本研究评估了ANRIL和miR-214在卵巢癌细胞中的表达状态,并进一步探讨ANRIL与miR-214之间的相互作用,研究其在卵巢癌的增殖和侵袭过程中的作用及其机制。
1 材料和方法
1.1 临床标本采集与处理
收集2016年7月~ 2017年1月在医院手术切除并且经病理检查确诊为卵巢癌的组织70例,同时取癌旁正常组织70例。离体后放入4%多聚甲醛中固定。全部患者术后病理分期明确,所有患者术前无化疗或放疗,卵巢癌为原发病灶并经病理科证实,签署知情同意书。
1.2 细胞株与主要试剂
人卵巢癌Ovcar3、COC1、A2780和SKOV3细胞株均购买于复旦大学细胞库。细胞培养条件:含10%胎牛血清的RPMI 1640,37℃,5% CO2条件下培养。胎牛血清、RPMI 1640培养基均购自美国Gibco公司;Transwell小室购自美国Millipore公司;Matrigel购自美国BD公司;ANRIL、miR-214及对照慢病毒购自上海吉凯制药技术有限公司;Lipofectamine2000转染试剂购于日本TaKaRa公司;逆转录试剂盒(FSQ-101)购自日本TOYOBO公司;PCR试剂盒购自美国Sigma公司;荧光素酶活性检测试剂盒购自Promega公司。荧光素酶报告载体由Promega公司合成;裸鼠购买于复旦大学实验动物中心。
1.3 qPCR实验检测miR-214的表达
使用miRNA提取试剂盒进行mRNA抽提,实验过程按照试剂盒使用说明进行,抽提之后,使用核酸浓度检测仪检测RNA浓度和纯度,最后将其浓度稀释至40μg/ml,使用特异性反转录引物进行cDNA合成,反应条件按照cDNA合成试剂盒使用说明进行设置。反应条件:95℃预变性10min、95℃变性15s、60℃退火32s,循环50次后检测其溶解曲线,检测完成后,通过计算机系统自动分析各样本Ct值,然后采用2-ΔΔCt计算miRNA的相对表达量。实验重复3次。ANRIL引物序列:5′-CTGCTGTAGTCGTAGTCGGTAAG AC-3′(正向)和5′-GCGCGTAGTCGTAGCGGTTAT GGCT-3′(反向)。miR-214引物序列:5′-CGTAGCG TAGGCTGACGTAGGTTTC-3′(正向)和5′-TGTG CCAGGGCTAAAGCTAGCAAAC-3′(反向)。
1.4 双荧光素酶实验检测miR-214和ANRIL之间关系
从人类基因组DNA产生全长miR-214-3′UTR,并通过退火合成的信号寡核苷酸产生突变体miR-214-3′UTR。将这些DNA片段克隆到ph-TK载体(肾荧光素酶)中,miR-214-3′UTR WT代表野生型质粒载体和质粒结合共转染到293T细胞内,miR-214-3′UTR MUT代表突变型质粒载体和质粒结合共转染到293T细胞内,同时使用pGL-3.0(荧光素酶)作为内参照,检测NC组和ANRIL-siRNA组293T细胞中miR-214的荧光活性相对值。使用Lipofectamine 2000TM(Invitrogen)检测转染效率在孢菌素酶活性的基础上正常化。根据制造商的说明书,使用双荧光素酶报告系统试剂盒(Promega)测量萤火虫和海肾荧光素酶活性,通过双荧光素酶检测ANRIL对miR-214的表达活性的调控能力,明确MALAT1对miR-205荧光活性的调控情况。
1.5 Transwell侵袭试验检测卵巢癌细胞侵袭能力
将5×104个SKOV3卵巢癌细胞置于模具上室,并加入Matrigel基质胶,涂抹均匀。将具有10%FBS的培养基置于下室中。在37℃下孵育24h后,小心地去除上膜表面上的细胞。用95%乙醇固定20min后,用0.5%结晶紫溶液染色10min,自来水冲洗干净过后,于倒置显微镜下计数。实验重复3次。
1.6 克隆形成实验检测卵巢癌细胞增殖能力
使用常规培养的SKOV3的细胞经胰酶消化后,1000r/min,3min,弃去上清液。加入5ml的无菌PBS溶液,轻轻吹散洗涤细胞沉淀并再次离心。反复洗涤3次后加入培养基,制备成单细胞悬液。测定细胞浓度并调整为1000cells/ml,将单细胞悬液均匀的种植在无菌6孔板内,进行克隆形成实验。分为NC组实验组和ANRIL-siRNA对照组。每3d更换培养基1次,14d后观察细胞克隆形成情况。
1.7 MTT细胞增殖实验检测卵巢癌细胞增殖能力
消化离心重悬SKOV3细胞,分为转染细胞组和未转染细胞组,使用96孔板,设置3个复孔,每空加入2×103细胞,稀释TGFβ1因子浓度为200ng/ml,在37℃、5% CO2的孵箱内培养。培养后的1~5d分别按每100μl培养基加入10μl CCK-8液体,放于细胞培养箱内孵育1h,用酶标仪在450nm下检测各孔吸光值。以时间为横轴,以每个时间点各组细胞的吸光值比率为纵轴,绘制细胞生长曲线。
1.8 裸鼠动物实验检测miR-214对成瘤能力的影响
给5周龄的裸鼠腋下皮下注射卵巢癌细胞株(5×105个细胞)。此后每周监测肿瘤大小。6周后,将小鼠处死并除去肿瘤,处死后检测两组(各10只)裸鼠肿瘤异种移植物的质量生长情况。
1.9 统计学处理
2 结果
2.1 lncRNA ANRIL和miR-214在卵巢癌组织和细胞株中的表达情况
qPCR结果表明(图1A),与正常卵巢组织相比,ANRIL在卵巢癌组织中的表达水平明显升高[(1.35±0.11)vs(3.18±0.21),P<0.05],miR-214在卵巢癌组织中的表达水平也相对升高[(2.25±0.19)vs(5.67±0.42),P<0.05],差异均具有统计学意义。与其他细胞株相比,SKOV3细胞中ANRIL mRNA表达水平明显较高[(10.02±0.18)vs(3.05±0.10),P<0.05],差异有统计学意义;ANRIL在SKOV3细胞株中表达水平比其他卵巢癌细胞株较高(图1B)。综合上述实验结果,考虑ANRIL在卵巢癌中可能有一定的致癌作用,而miR-214也可能发挥一定的促癌效果,后续挑选SKOV3为生物学功能实验的细胞株。
2.2 lncRNA ANRIL与卵巢癌患者临床病理参数之间的关系
为了证实ANRIL在卵巢癌组织标本中的表达与其临床病理参数之间关系,把70例卵巢癌肿瘤组织样本和癌旁正常卵巢组织进行临床病理参数的统计分析。ANRIL在不同年龄的卵巢癌患者之间的表达差异无统计学意义(P>0.05,表1)。ANRIL的表达与卵巢癌的病理分期相关以及淋巴结转移情况有关,随着分期越高,ANRIL在卵巢癌组织中表达越高,而在有淋巴结转移的患者中ANRIL的表达也相对较高(P<0.05,表1)。
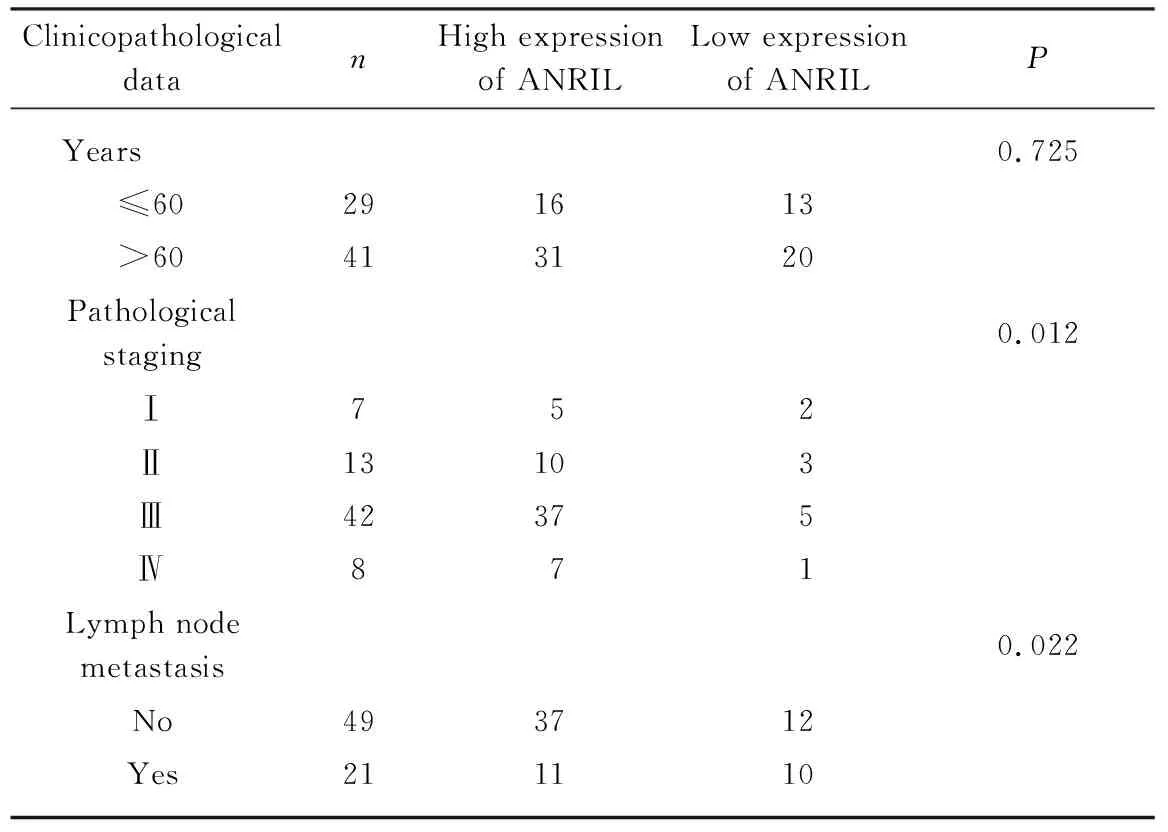
表1 ANRIL表达与卵巢癌患者临床病理特征之间的关系
2.3 lncRNA ANRIL和miR-214之间的相互调控关系
为明确与ANRIL相关的miRNA在卵巢癌细胞中的表达情况,使用生物信息学预测工具发现ANRIL可能与miR-214有直接作用,两者结合序列有相似的结合位置(图2A)。为了验证ANRIL能否与miR-214 3′UTR相结合,将ANRIL-siRNA与miR-214共转染到293T细胞中。双荧光素酶报告基因结果显示(图2B):ANRIL-siRNA可以明显抑制miR-214的荧光素酶活性。结果表明,ANRIL-siRNA能与miR-214的3′UTR特异性结合,并可以调控其表达活性与水平。
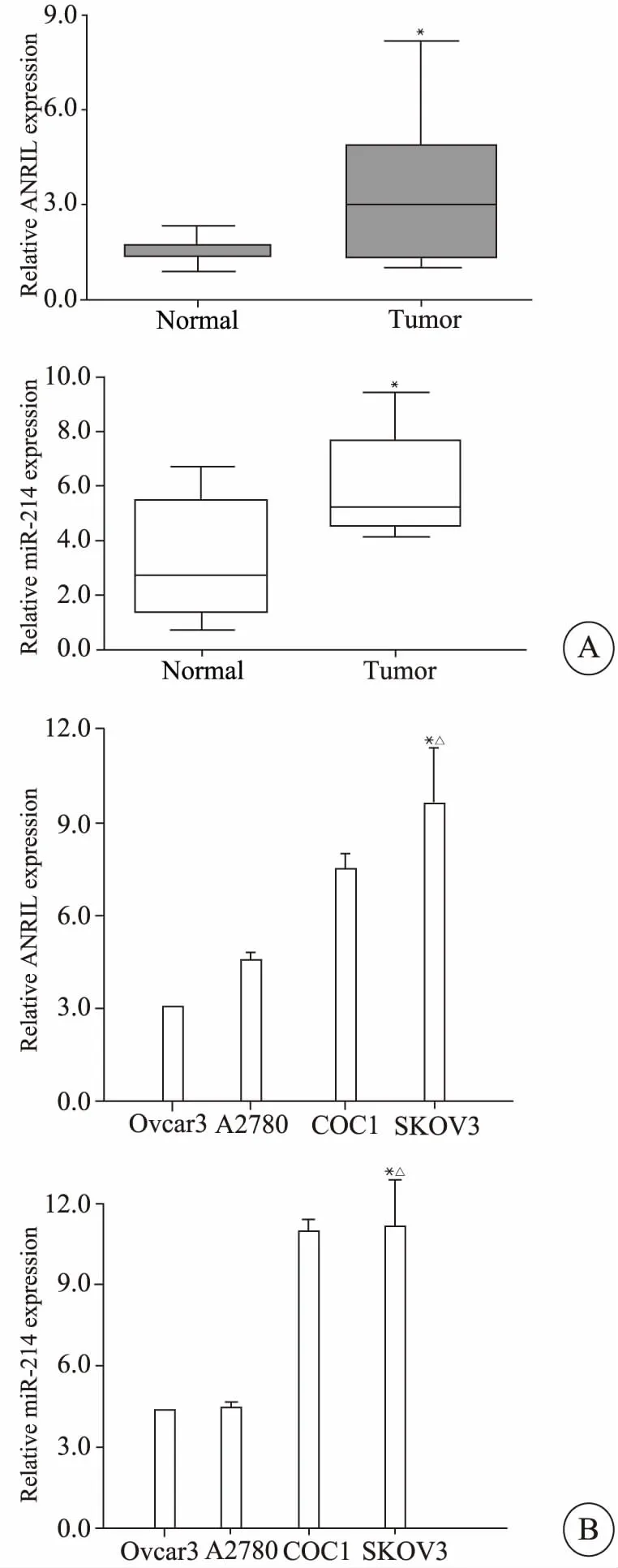
图1 ANRIL和miR-214在卵巢癌细组织(A)及卵巢癌细胞株中的表达情况(B)Fig 1 ANRIL and miR-214 expression in ovarian cancer tissues (A) and ovarian cancer cell lines (B)*P<0.05 vs normal;△P<0.05 vs the other groups
2.4 lncRNA ANRIL对卵巢癌细胞株增殖能力的影响
克隆形成实验结果显示(图3A),ANRIL-siRNA组细胞克隆形成数目明显少于NC组[(0.82±0.09)×104vs(2.44±0.29)×104,P<0.05],差异具有统计学意义。MTT增殖实验结果显示(图3B),ANRIL-siRNA实验组的细胞增殖速率明显低于NC组[3d(1.21±0.09)vs(1.85±0.21),P<0.05;4d(1.72±0.21)vs(3.28±0.30),P<0.05;5d(2.20±0.18)vs(3.98±0.29),P<0.05],两组差异具有统计学意义,表明抑制ANRIL的表达后,卵巢癌SKOV3细胞的增殖能力得到一定的抑制。
2.5 lncRNA ANRIL对卵巢癌细胞株侵袭能力的影响
Transwell侵袭结果显示(图4),ANRIL-siRNA组通过Matrigel基质胶的细胞数量明显少于NC组,[(65.82±7.98)vs(173.26±12.98),P<0.05],差异有统计学意义(P<0.05)。说明抑制ANRIL的表达后可以在一定程度上抑制卵巢癌SKOV3细胞的侵袭能力。
2.6 裸鼠成瘤实验检测lncRNA ANRIL对卵巢癌细胞株成瘤能力的影响
裸鼠体内成瘤实验表明,抑制ANRIL后的卵巢癌SKOV3细胞在裸鼠体内成瘤能力明显与对照组相比明显减弱,6周后裸鼠肿瘤体积与对照组相比明显减小[(2.83±0.42) cm3vs(0.51±0.16) cm3,P<0.05],6周后肿瘤质量与对照组相比明显减小[(2.58±0.38) gvs(0.68±0.20) g,P<0.05]。差异有统计学意义(图5),说明抑制ANRIL后卵巢癌SKOV3细胞在裸鼠体内成瘤能力相应减弱。
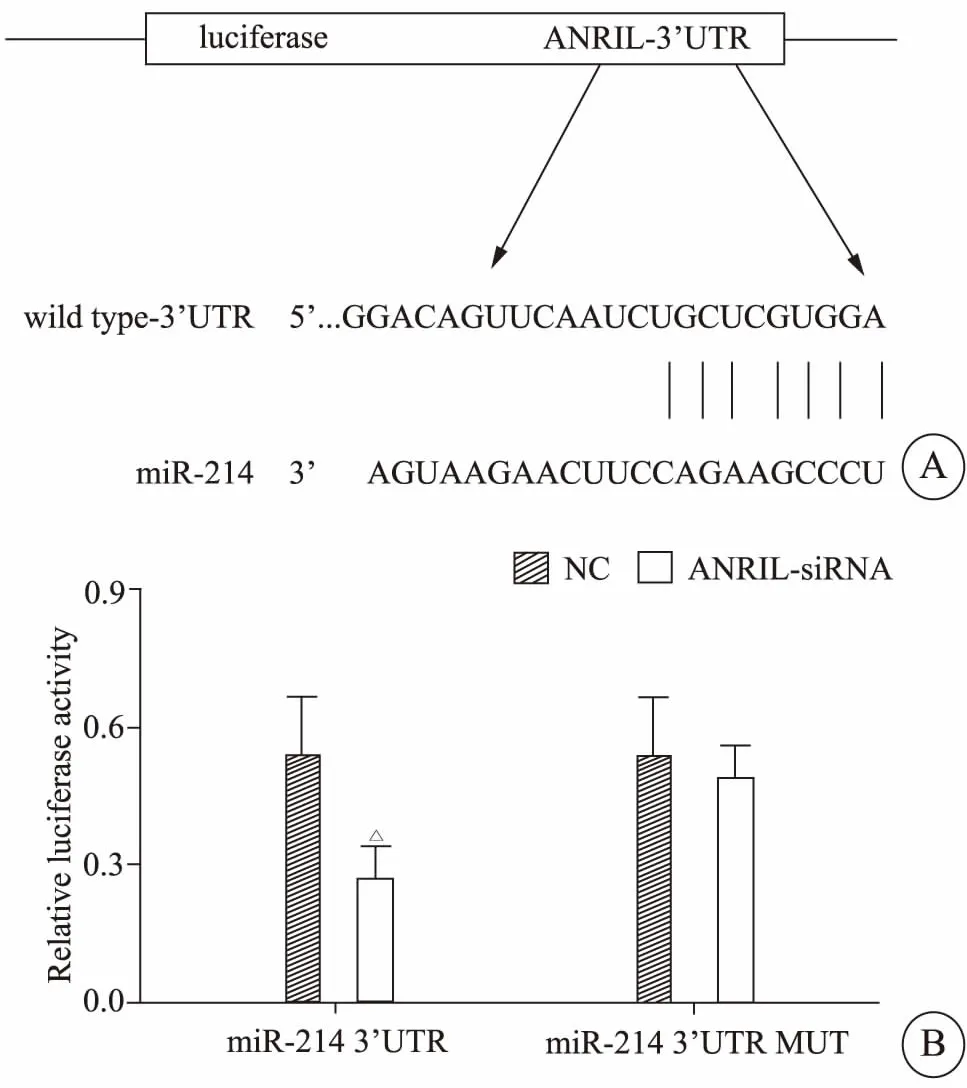
图2 ANRIL和miR-214的结合位点(A)和双荧光素酶检测ANRIL和miR-214之间的相互关系(B)Fig 2 Binding sites for ANRIL and miR-214(A).Double luciferase detecting the correlation between ANRIL and miR-214(B)*P<0.05 vs NC
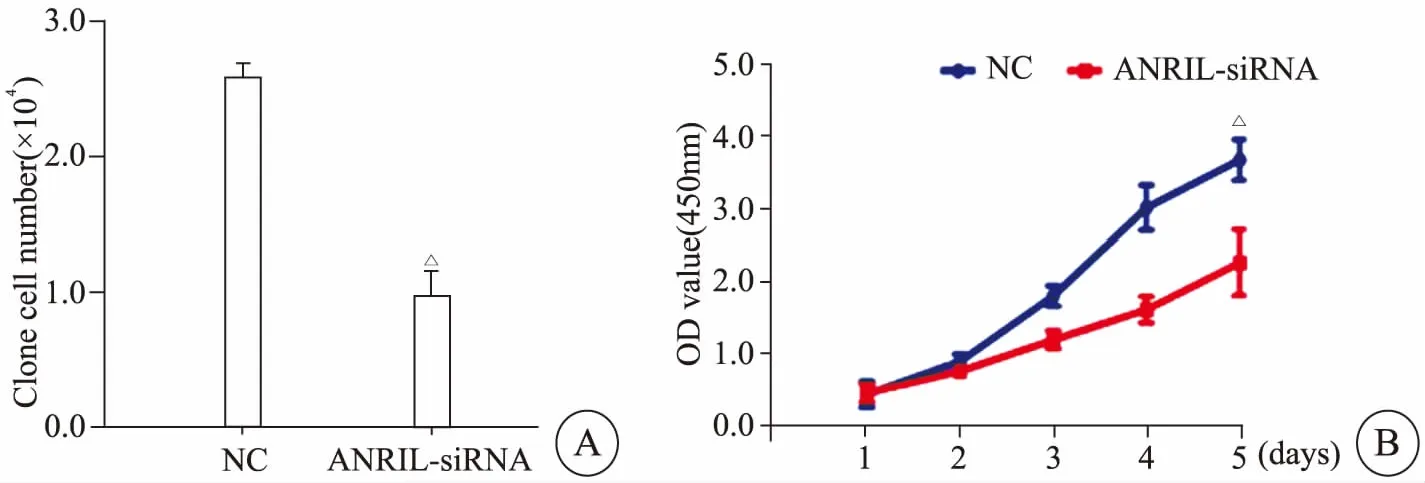
图3 克隆形成实验(A)和MTT细胞增殖实验(B)检测ANRIL对卵巢癌细胞增殖能力的影响Fig 3 Cloning formation assay(A) and MTT cell proliferation assay (B) detecting the effect of ANRIL on the proliferation of ovarian cancer cells△P<0.05 vs NC

图4 Transwell侵袭实验检测ANRIL对卵巢癌细胞侵袭能力的影响Fig 4 Transwell invasion assay detecting the effect of ANRIL on invasive ability of ovarian cancer cells△P<0.05 vs NC
3 讨论
近年来众多研究表明并指出在多种类型的肿瘤中lncRNA的表达存在异常。lncRNA作为一种新型调控因子是目前肿瘤学领域研究的热门方向。lncRNA是一类长度大于200个核苷酸分子,没有蛋白质编码
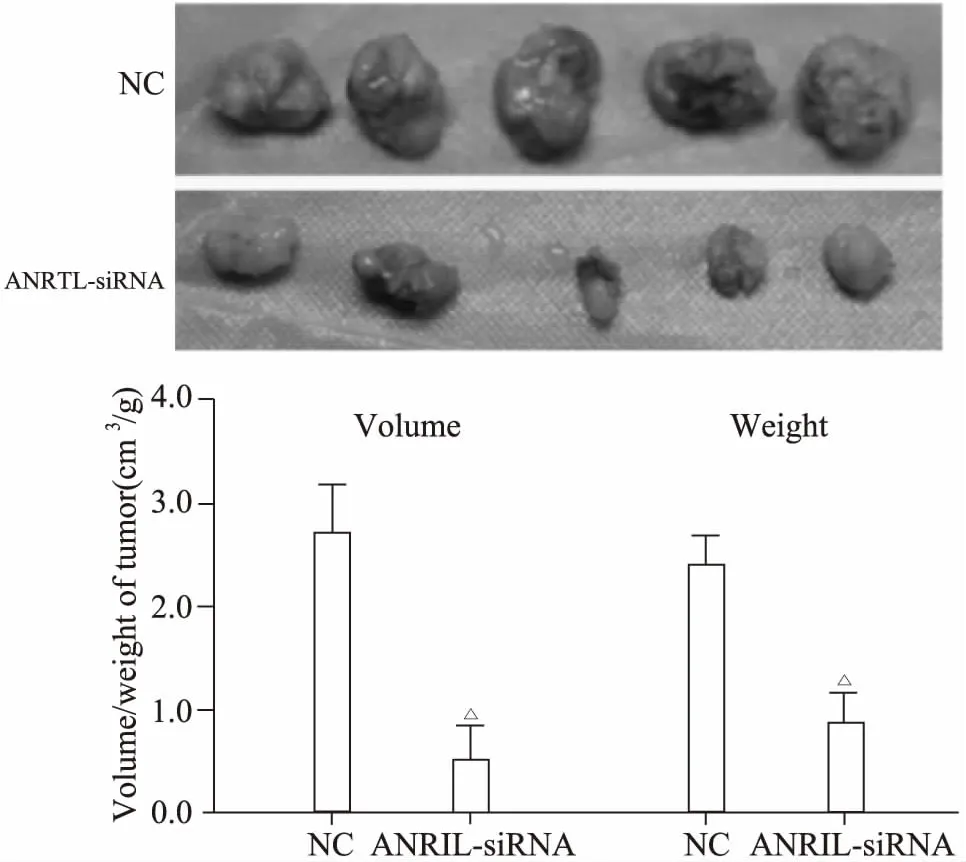
图5 抑制ANRIL的表达对卵巢癌SKOV3细胞在裸鼠体内成瘤能力的影响Fig 5 Effect of inhibition of ANRIL expression on ovarian cancer SKOV3 cells in nude mice△P<0.05 vs NC
功能,不能进行常规的RNA转录。但是很多研究指出lncRNA可以与蛋白质相互作用,可以结合相应的蛋白起到调控作用[18]。有研究指出ANRIL与前列腺癌中的miR-146a表达水平呈负相关关系,可以通过诱导其启动子中CpG岛的甲基化来介导miR-146a的表达[19]。Lin等[20]学者研究指出,高表达的ANRIL与非小细胞肺癌患者的临床分期,淋巴结转移和远处转移的状态有一定关系,可以作为非小细胞肺癌患者的预后检测的生物标志物。本实验结果显示,ANRIL在卵巢癌组织中表达上调,ANRIL表达水平的卵巢患者与分化等级、病理分期及淋巴街转移相关。此外,生物学功能实验分析显示,抑制ANRIL的表达后可以在一定程度上抑制卵巢癌细胞的增殖和侵袭行为。
本实验除了检测细胞学中ANRIL对卵巢癌细胞的相关作用,还进行裸鼠体外成瘤实验检测ANRIL的敲除在裸鼠体内的反应情况,确定ANRIL对卵巢癌细胞的综合作用。之前也有相关研究表明lncRNA ANRIL可以通过与非小细胞肺癌细胞中的EZH2,LSD1蛋白结合进而抑制下游KLF2,P21和E-钙黏蛋白的表达,参与非小细胞肺癌的生物学行为的调控[21]。同时lncRNA ANRIL可以通过结合EZH2抑制p15和p21蛋白的激活,促进胃癌细胞的细胞周期进程,加快胃癌细胞的生长和增殖[22]。在甲状腺癌中,抑制ANRIL的表达可以降低miR-128的表达,进而调节甲状腺激素受体(TSHR)的表达情况,参与甲状腺癌细胞的生物学行为的调控[23]。本研究通过生物信息学网站预测显示ANRIL与miR-214有一定的相似序列,ANRIL可能调控miR-214的表达后参与卵巢癌细胞的行为调控,后续的MTT细胞增殖实验和Transwell侵袭实验验证了前面的推测。这与其他研究报道miR-214可以作为部分恶性肿瘤细胞的肿瘤诱导因子的结论一致。Penna等[24]报道miR-214可以通过靶向增加E2F3的表达促进人肝细胞癌细胞的增殖。而在最近的一项研究中,Wang等[25]指出miR-214可以联合lncRNA减少宫颈癌细胞的上皮间质转化进而影响宫颈癌的转移过程。
总之,本研究发现ANRIL通过与miR-214相互作用调控卵巢癌SKOV3细胞增殖和侵袭行为,抑制其表达后,SKOV3细胞增殖和侵袭能力明显减弱;ANRIL在卵巢癌组织中的表达水平明显高于邻近正常组织,表明其是通过影响卵巢癌细胞增殖侵袭起到促癌基因的作用。研究提示,ANRIL和miR-214可能通过影响卵巢癌细胞增殖侵袭过程干扰其进展,为卵巢癌的早期诊断和治疗靶点提供一定的理论支持,为卵巢癌的治疗和预后监测提供帮助。

