脑缺血后程序性坏死的形态学观察及necrostatin-1的保护作用*
杨吉平 费 琳 赵朝华 李悦卓 苟兴春△
(1 西安医学院基础医学研究所,陕西省脑疾病防治重点实验室,西安 710021;2 西安交通大学第一附属医院精神心理科,西安 710061)
脑缺血后损伤区细胞发生死亡的方式主要包括凋亡和坏死,既往研究多集中在前者,这种继发性凋亡过程主要发生在缺血损伤区的周边,即半暗带区,它是一种涉及多种基因及其蛋白质相互作用的自主死亡的过程[1]。传统观点认为脑缺血后损伤区的核心成份主要是细胞坏死,它是一种被动的、无序性的过程,不受调控[2]。然而,近年来研究发现了一种非凋亡性的程序性细胞死亡方式,有坏死的形态学特点,能在干扰半胱氨酸天冬氨酸蛋白水解酶-8(caspase-8)介导的凋亡时触发,被命名为细胞程序性坏死(necroptosis)[3]。当细胞凋亡不能正常发生而细胞必须死亡时,坏死作为凋亡的“替补”方式被激活,最近有研究表明,necroptosis参与了脑缺血后损伤区的病理变化和进程[4-5]。但是,脑缺血后局部发生程序性坏死的具体细胞和分子机制尚不完全清楚。因此,本研究拟建立永久性小鼠大脑中动脉闭塞(pMCAO)模型,探索脑缺血后损伤区发生程序性坏死的时间变化规律、细胞类型以及 necrostatin-1(一种特异性的受体相互作用蛋白-1激酶抑制剂,Nec-1)对其保护作用。
1 材料和方法
1.1 主要试剂与仪器
碘化丙啶(PI)(Sigma公司);兔抗NeuN抗体和兔抗GFAP抗体(武汉博士德);兔抗Iba-1抗体和磷酸化MLKL(pMLKL)抗体(Milipore);抗小鼠β-actin(Santa Cruz)。Nec-1(Abcam),ZH-ZKL型动物手术显微镜(安徽正华生物设备公司);线拴(美国Doccol);ABS型小动物气体麻醉机和异氟烷(上海玉研科学仪器有限公司);激光共聚焦显微镜(Olympus FV-1000);电子显微镜(Philips CM-120),WB成像系统(上海Tannon)。
1.2 实验动物分组及给药
30只雄性C57BL/6小鼠,体质量25~30g,由西安交通大学医学院动物实验中心提供,许可证号为SCXK(陕)2007-001,随机分为假手术组、模型组和Nec-1给药组。模型组及Nec-1给药组进行脑缺血模型,假手术组不插线,其余过程相同。按照文献方法和剂量[6-7],Nec-1给药组小鼠在造模前10min给予左侧侧脑室注射6μl Nec-1。Nec-1为10mg包装,以DMSO溶解配制成100mmol/L,分装保存于-80℃,使用前用生理盐水稀释成4mmol/L。
1.3 建立小鼠永久性大脑中动脉阻塞模型
3%异氟醚吸入麻醉诱导及维持,将麻醉好的小鼠置于动物手术显微镜下,背位固定,消毒,取颈正中切口,暴露气管,分离右侧颈总动脉并穿2根缝线备用,再分离颈内、颈外动脉,并结扎颈外动脉。在已分离的颈总动脉近心端用缝线结扎,远心端用动脉夹阻断血流,在此之间,剪一小口,将选择好的线栓插入小口,去掉动脉夹,然后缓慢推入至大脑前动脉起始端(6~7mm),通过阻断大脑中动脉的血供局灶性脑缺血,缝合皮肤。假手术组只分离动脉但不插线。术中保留自主呼吸,使用肛温探头监测肛温,通过恒温加热板将小鼠体温维持在 37.0℃±0.5℃。
1.4 组织细胞碘化乙啶(PI)染色
选取建立pMCAO模型小鼠3只,分别于术后6h、12h、1d、3d、5d、7d进行在体组织细胞PI染色。在相应时间点灌注前1h,生理盐水稀释PI(10mg/ml),按20mg/kg剂量给予腹腔注射,每只小鼠用量不超过100μl,整个过程需注意避光。
1.5 免疫组织荧光染色
用1%戊巴比妥钠40mg/kg腹腔注射将小鼠麻醉后,用0.01mol/L PBS(pH 7.4)冲血,4%多聚甲醛(PFA)灌注后取材,置30%蔗糖4℃至组织沉底,然后连续冠状冰冻切片。染色前将切片置室温3~4h晾干。然后将切片置于含3% BSA及0.3% Triton X-100 的封闭液中封闭透膜 1h,按如下稀释比加入一抗:抗NeuN 1∶200,抗GFAP 1∶300,抗Iba-1 1∶400。室温过夜。PBS漂洗后,分别避光加入相应FITC标记的二抗:1∶1000。室温孵育2h,PBS漂洗后,按1∶5000入Hoechst,水洗,封片,于激光共聚焦显微镜下观察照相。
1.6 免疫电镜技术
用4% PFA加0.05%戊二醛灌注固定,取材,后固定2~4h;从损伤区边缘行冠状位振动切片,厚度50μm;PBS漂洗;5%BSA+5%NGS+0.05%Triton X-100封闭2h后PBS漂洗;加pMLKL一抗(1∶500),室温孵育24h,PBS漂洗;加相应二抗(1∶2000),4℃,孵育过夜;PBS漂洗;用2%戊二醛固定45min,去离子水漂洗;避光进行银加强,去离子水漂洗后,再用0.1mol/L PB漂洗;1%锇酸/0.2mol/L PB溶液室温固定1h;0.1mol/L PB漂洗,每次5min;依次梯度乙醇和丙酮脱水,然后包埋,聚合;修块后行100nm超薄切片;铜网捞起切片,晾干;进行铅、铀染色;去离子水冲洗铜网,吸取多余水分,晾干后电子显微镜下观察。
1.7 免疫印迹检测
于术后3d取各组小鼠损伤侧皮层脑组织,免疫印迹检测Nec-1对pMLKL蛋白表达的影响。小鼠断头后,以损伤区为中心,边缘旁开约0.5mm为范围取皮层组织于1.5ml EP管中,每管加入RIPA(pH 7.4)200μl,超声裂解20min,4℃,12000r/min,离心20min;上清液转至另一离心管中,采用BCA法蛋白定量。取等量总蛋白上样,以SDS-聚丙烯酰胺凝胶电泳分离,湿电转移至PVDF膜,用5% 脱脂奶粉封闭1h,TBST漂洗后,分别加入pMLKL 1∶500和β-actin 1∶3000,4℃过夜,TBST漂洗后,加入1∶5000 HRP标记的二抗,室温孵育2h。TBST漂洗后ECL发光,蛋白表达条带用Image J软件进行灰度分析。
1.8 统计学处理
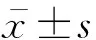
2 结果
2.1 脑缺血后不同时间点的细胞坏死数量分析
在体细胞PI染色结果显示,在造模后6h,缺血区已经开始出现PI阳性细胞,且随时间推移PI阳性细胞数量逐渐增多,到脑缺血后1~3d时达到最多,约769/mm2。在缺血后第5天,PI阳性细胞逐渐开始减少,缺血后第7天时,PI阳性细胞明显减少(图1)。
2.2 脑缺血后不同时间点坏死细胞的类型分析
免疫组织荧光观察可见,在脑缺血后第3天,损伤区PI阳性细胞约80%与NeuN共标(图2A),很少与GFAP和Iba-1共标。在脑缺血后第7d,损伤区PI阳性细胞总体数量减少,大部分分布于损伤区周边,主要与GFAP和Iba-1共标,GFAP+细胞呈现胞体增大,突起增多、增粗,呈现反应性星形胶质细胞形态特征(图2B)。Iba-1+细胞胞体也变大,形态清楚,突起伸长变粗,成阿米巴样形态(图2C)。
2.3 脑缺血后损伤区细胞的超微结构和pMLKL的分布
免疫电镜显示,经pMCAO处理后第3天,损伤区可见神经元细胞膜破裂,细胞器结构异常、紊乱,有空洞形成,呈现坏死的超微结构特征,pMLKL 的胶体金颗粒主要沉积于神经元胞体内(图3A)。脑缺血术后第7天,损伤区周围可见大量的星形胶质细胞和小胶质细胞募集和浸润,有一些细胞也呈现出坏死的超微特征,pMLKL的胶体金颗粒主要分布在这些星形胶质细胞和小胶质细胞的细胞质或细胞膜上(图3B、C)。
2.4 Nec-1对脑缺血后损伤区pMLKL蛋白表达的影响
免疫印迹检测各组大鼠脑缺血后3d损伤区组织的pMLKL蛋白表达,pMLKL条带清晰地表达在54kDa 左右(图4),与相应的β-actin条带进行相对灰度值分析显示,模型组损伤区pMLKL的表达较对照组明显升高(P<0.01);与模型相比,Nec-1给药组pMLKL的表达明显下降(P<0.01)。

图4 Nec-1对脑缺血后损伤区磷酸化 MLKL 蛋白表达的影响Fig 4 The effects of Nec-1 on pMLKL expression in the injured area after cerebral ischemia Western blotting.**P<0.05 vs sham group, △△P<0.05 vs model group
3 讨论
脑卒中一直是危害人类健康的主要杀手,而缺血性脑卒中占脑卒中总数的 60%~70%,目前临床上仍缺乏有效的治疗手段。坏死是一种重要的细胞死亡方式,脑缺血后的组织损伤大部分为细胞坏死,主要表现为细胞器水肿、活性氧和细胞内Ca2+升高、ATP含量下降以及细胞器和细胞膜最终破裂[8]。过去认为坏死是不可逆的,不可调控的,因此,相对于凋亡而言,坏死的研究较少。然而,最近研究表明一种可调控的细胞坏死,被称之为程序性坏死,它在病毒感染[9]、心肌缺血[10]和脑缺血再灌注损伤[11]等疾病中都可发挥重要作用。
3.1 脑缺血后不同时期损伤区程序性坏死的分布和细胞类型分析
本研究结果显示,在脑缺血术后3d,损伤区组织染色显示PI阳性细胞最多,且大部分与NeuN共标,表明在缺血的急性期发生了以神经元为主的程序性坏死;而在脑缺血术后7d时,PI阳性细胞的数量明显减少,主要与GFAP和Iba-1双标,表明缺血后亚急性期主要坏死的细胞是星形胶质细胞和小胶质细胞,这可能与脑缺血后的炎症反应和坏死区周围水肿有关。程序性坏死的发生是由受体相互作用蛋白激酶(receptor interacting protein kinase,RIPK)1和RIPK 3传递死亡信号,募集并磷酸化MLKL蛋白(mixed lineage kinase domain-like protein)形成坏死小体,最终导致细胞死亡,有研究已经证实,pMLKL蛋白的膜易位是程序性坏死的最终执行者[12]。因此,本研究做了pMLKL的免疫电镜,结果显示,在脑缺血术后第3天,损伤区出

图2 脑缺血后损伤区坏死的细胞类型分析,免疫荧光染色,×400Fig 2 The types of dead cells in the lesion after cerebral ischemia detected by immunofluorescence,×400A:PI+NeuN (3d);B:PI+GFAP (7d);C:PI+Iba-1 (7d)

图3 脑缺血后不同时间点损伤区pMLKL的表达及分布,免疫电镜,bar=1.0μmFig 3 The distribution of pMLKL in neurons,astrocytes and glial cells of the injured area after cerebral ischemia examined by immuno-electron microscopy,bar=1.0μmA:Neuron (3d);B:Astrocyte (7d);C:Microglia (7d)
现大量的具有坏死特征的细胞,表现为胞膜破裂,染色质溶解,细胞器瓦解,pMLKL的胶体金颗粒主要沉积于神经元。而在脑缺血术后第7天 在损伤区边缘出现具有坏死特征的细胞,pMLKL的胶体金颗粒分布在星形胶质细胞和小胶质细胞。这与PI染色及免疫荧光染色结果一致。
3.2 Nec-1对脑缺血后损伤区细胞程序性坏死的保护作用
Nec-1为RIPK1的特异性抑制剂,它能将RIPK1的活性片断锁定在无活性状态,从而达到抑制RIPK1的功能活性和程序性坏死形成,并且通过作用于RIPK1和RIPK3的激酶部分,阻断两者相互磷酸化,进而抑制RIPK1-RIPK3-MLKL复合物的形成而发挥效应[13]。本研究免疫印迹结果显示,Nec-1给药组能够明显降低脑缺血模型组损伤区组织pMLKL的表达,这可能与Nec-1通过抑制RIPK1的磷酸化减轻神经元的程序性坏死有关,从而减轻缺血性脑卒中引发的炎症反应,减轻周围组织水肿。综上所述,脑缺血后损伤区局部发生了程序性坏死,在损伤后3d以神经元坏死为主,而在5~7d发生以星形胶质细胞和小胶质细胞为主的坏死。因此,在研究脑缺血的治疗方案中不仅要抗凋亡,抑制程序性坏死也是至关重要的,“拮抗坏死”或为脑缺血治疗的一个很好的策略。

