双酚A对腔前卵泡体外发育的干扰作用
王喜艳,孙艳美,何海,齐孟飞,邱新茹,潘晓燕
双酚A(bisphenol A,BPA)是世界上使用最广泛的工业化合物之一,主要用于生产环氧树脂和聚碳酸酯等材料。2003-2004年,美国健康和营养调查协会对6岁以上不同年龄和性别的2517名被调查者进行了尿样检测,结果在95%以上的受检者尿样中检测到BPA。BPA结构类似于雌二醇(estradiol,E2),具有弱的雌激素活性,其在机体中发挥作用的方式与雌激素相似,主要通过与靶细胞上的雌激素受体结合发挥调控细胞的功能。研究发现,动物接触较高浓度的BPA后,其生殖系统的发育和功能会受到严重影响[1-4]。还有研究发现,不孕妇女尿液中高浓度的BPA与其原始卵泡数量降低密切相关[5]。BPA作为一种内分泌干扰物可干扰卵巢的卵泡发育[6-7],但其作用和剂量尚不明确。本研究以小鼠腔前卵泡的体外发育为研究系统,使腔前卵泡在体外培养过程中接触不同浓度的BPA,系统地检测BPA对腔前卵泡中卵母细胞和颗粒细胞生长发育的干扰作用,旨在为确定BPA对女性生殖健康的影响提供有价值的参考依据。
1 材料与方法
1.1 实验动物及分组 D14昆明小白鼠60只,雌性,清洁级,购自吉林大学实验动物中心。随机分为正常组、对照组、4.5μmol/L BPA组和45μmol/L BPA组。正常组小鼠腔前卵泡的培养液为正常培养液,对照组小鼠腔前卵泡的培养液中添加1μl/ml DMSO,4.5μmol/L BPA组和45μmol/L BPA组小鼠腔前卵泡的培养液中分别添加4.5μmol/L BPA和45μmol/L BPA。
1.2 腔前卵泡体外培养 颈椎脱臼法处死小白鼠,迅速取其双侧卵巢置于含10%FBS的L-15工作液(Gibco公司,美国)中。体视镜下去除卵巢周围组织,机械分离出腔前卵泡。根据Pedersen和Peter的分级标准[8],选取5a类卵泡进行培养。5a类卵泡包含一个圆的、被透明带包绕的、位于整个卵泡中间的卵母细胞,2~4层颗粒细胞,完整的基膜以及附着在基膜上的若干卵泡膜细胞。将挑选的卵泡放在含有不同浓度BPA(0、4.5、45μmol/L)的α-MEM培养液(含5%FBS,1%ITS和0.1U/ml r-FSH)中,置于37℃、5%CO2的培养箱中培养。次日测量腔前卵泡的直径,选取直径为110~160μm的卵泡继续培养10d,观察并记录各组卵泡生长情况,统计卵泡的成腔率和裸卵率,测定卵泡的直径和颗粒细胞层厚度。第10天在α-MEM培养液中添加2.5U/ml人绒毛膜促性腺激素(human choionic gonadotophin,hCG),继续培养16h后,去除卵丘卵母细胞复合体(cumulus oocyte complexes,COCs)周围的颗粒细胞,倒置显微镜下观察并记录卵母细胞的成熟情况。
1.3 ELISA法检测培养液中E2水平 分别收集第4、8、10天的卵泡培养液,采用ELISA检测试剂盒(GS-C5401,上海安迪生物科技有限公司)测定培养液中E2水平,操作步骤严格按照说明书进行。
1.4 免疫荧光法检测卵泡中卵母细胞的雌激素受体表达水平 收集D10卵泡,去除颗粒细胞,将卵母细胞在4%多聚甲醛中固定1h,0.01mol/L PBS(pH 7.0~7.2)洗3次,5min/次,把固定好的卵母细胞移入封闭液(含1%BSA、0.01% Triton-X100的PBS)中封闭1h。然后将卵母细胞放到雌激素受体抗体(BS-0174R,武汉博士德生物科技有限公司)中孵育1h。经PBS洗涤3次后,将卵母细胞移到羊抗兔FITC标记的二抗(bs-0295G-FITC,武汉博士德生物科技有限公司)中,37℃孵育1h,5μg/ml hochest33342常温孵育10min。将标记好的卵母细胞移到载玻片上,在Olympus IX73荧光显微镜下观察拍照。
1.5 Western blotting检测卵泡中生长分化因子9(growth differentiation factor 9,GDF-9)和骨形态发生蛋白15(bone morphogenetic protein 15,BMP-15)的表达 每个实验组取体外培养D10的卵泡各80个,用RIPA强裂解液(含1%PMSF)提取蛋白。制胶,上样,100V恒压电泳约90min,300mA湿转膜45min,5%脱脂奶粉封闭1h,然后将膜在兔源GDF-9抗体(bs-4720R)、BMP-15抗体(bs-6612R)和β-actin抗体(bs-0061R,均购自武汉博士德生物科技有限公司)中4℃孵育过夜。次日,将膜在HRP标记的羊抗兔二抗中室温孵育2h。然后将转有蛋白的PVDF膜放入Chemi DOC XRS+成像系统中,覆上增强显影液,用Image Lab 3软件进行拍照,Image J软件对图像进行灰度值分析。
1.6 统计学处理 卵泡直径和颗粒细胞层厚度采用Image Pro-Plus 6.0进行测量分析。所有数据以±s表示,采用SPSS 17.0软件进行单因素方差分析(oneway ANOVA),进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 BPA对腔前卵泡体外生长的影响 从D14小鼠卵巢中分离出腔前卵泡,采用倒置显微镜观察其在D2、D4、D6、D8和D10的生长状态。结果显示,各组卵泡在D2开始贴壁生长;D4和D6卵泡的颗粒细胞开始向外扩展,且卵泡体积不断增大;D8开始出现卵泡腔;D10卵泡腔的体积增加到最大(图1)。与正常组比较,45μmol/L BPA组腔前卵泡的成腔率和卵母细胞成熟率(图2、表1)明显降低(P<0.05),而裸卵率明显增加(P<0.05,表1);且与对照组比较,45μmol/L BPA明显降低了D10卵泡直径和颗粒细胞层厚度(P<0.05,表2),但其他各组间比较差异无统计学意义(P>0.05)。
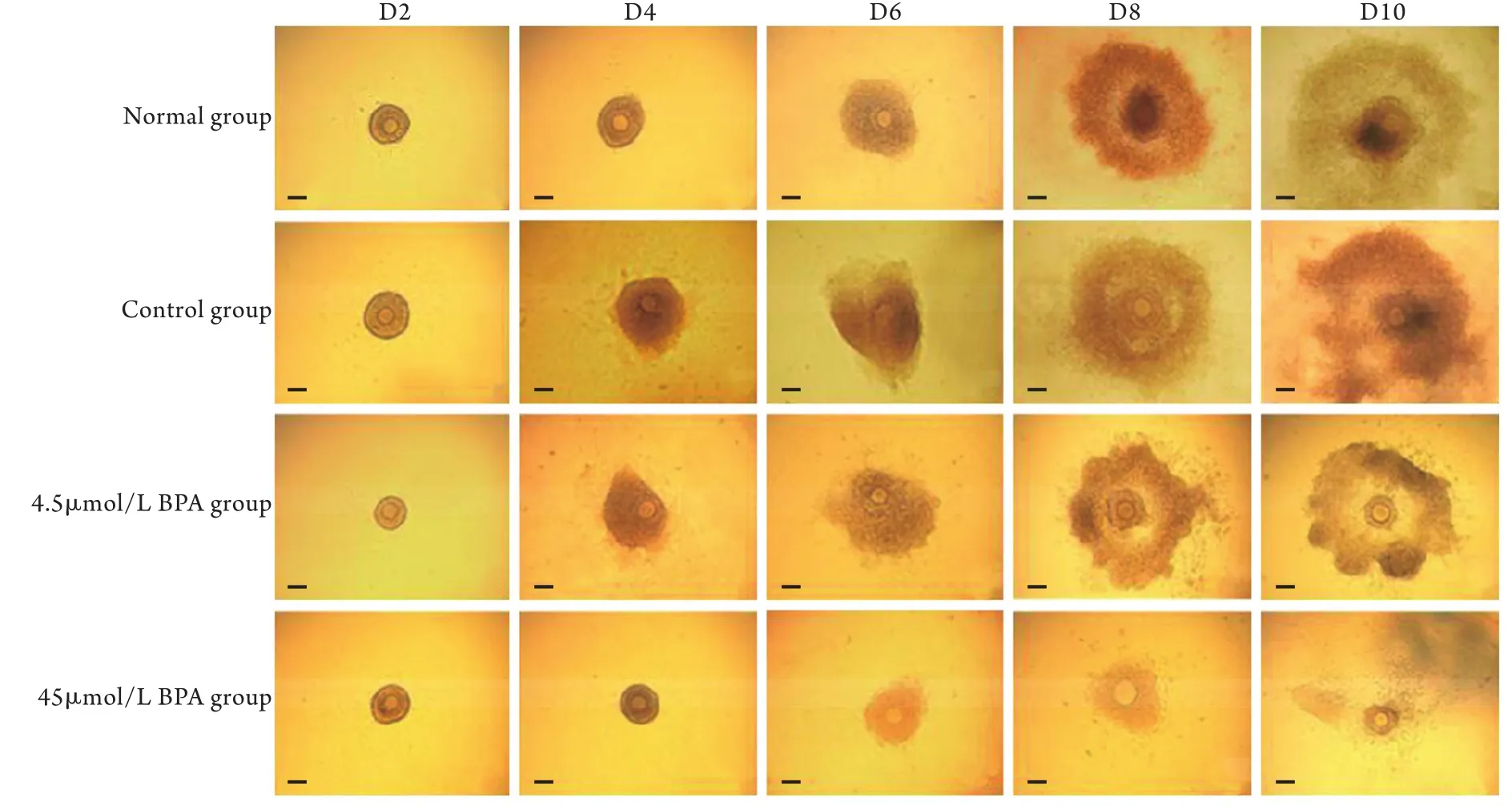
图1 腔前卵泡体外发育过程(倒置显微镜,标尺=100μm)Fig.1 The development process of preantral follicles in vitro (Inverted microscope, bar=100μm)

图2 体外培养D10卵丘卵母细胞复合体和卵母细胞观察(倒置显微镜)Fig.2 Cumulus oocyte complexes (COCs) and oocytes at the 10th day of culturing in vitro (Inverted microscope)
表1 体外培养卵泡的成腔率、裸卵率和卵母细胞成熟率(%,±s,n=500)Tab.1 Percentages of antral follicles, denuded oocytes and matured oocytes during cultivation in vitro (%, ±s, n=500)

表1 体外培养卵泡的成腔率、裸卵率和卵母细胞成熟率(%,±s,n=500)Tab.1 Percentages of antral follicles, denuded oocytes and matured oocytes during cultivation in vitro (%, ±s, n=500)
(1)P<0.05 compared with normal group
Group Percentage of antral follicles Percentage of denuded oocytes Percentage of matured oocytes Normal 92.6±4.9 2.1±0.1 80.3±8.6 Control 90.7±6.4 2.7±0.8 74.5±12.7 4.5μmol/L BPA 91.8±4.6 3.5±0.5 75.5±10.1 45μmol/L BPA 10.1±5.6(1) 28.6±3.8(1) 60.0±3.1(1)
表2 体外培养D10卵泡直径和颗粒细胞层厚度(μm,±s,n=20)Tab.2 Diameter of follicles and thickness of cumulus cell layers at the 10th day of cultivation in vitro (μm, ±s, n=20)

表2 体外培养D10卵泡直径和颗粒细胞层厚度(μm,±s,n=20)Tab.2 Diameter of follicles and thickness of cumulus cell layers at the 10th day of cultivation in vitro (μm, ±s, n=20)
(1)P<0.05 compared with normal group
Group Diameter of folliclesThickness of cumulus cell layers Normal 633.5±60.2 561.1±51.3 Control 629.2±63.4 553.5±56.1 4.5μmol/L BPA 627.8±66.1 554.6±57.6 45μmol/L BPA 421.2±55.7(1) 310.4±43.3(1)
2.2 BPA对卵泡分泌E2的影响 分别收集各组D4、D8和D10的卵泡培养液,采用ELISA法检测卵泡培养液中E2的含量,结果显示,45μmol/L BPA对D4卵泡培养液中E2水平没有明显影响(P>0.05),但明显降低了D8和D10卵泡培养液中E2水平(P<0.05);而4.5μmol/L BPA组E2水平与正常组比较差异无统计学意义(P>0.05,表3)。
2.3 BPA对卵母细胞雌激素受体表达的影响 采用免疫荧光染色法检测D10卵母细胞中雌激素受体的表达情况,结果显示,雌激素受体主要表达在细胞膜和细胞质中(图3A)。与正常组比较,4.5μmol/L BPA组卵母细胞雌激素受体的表达无明显差异(P>0.05),而45μmol/L BPA组卵母细胞雌激素受体的表达明显降低(P<0.05,图3B)。
表3 D4、D8和D10卵泡培养液中E2水平(ng/L,±s,n=5)Tab.3 Contents of E2 in the follicle culture media at the 4th,8th and 10th day (ng/L, ±s, n=20)
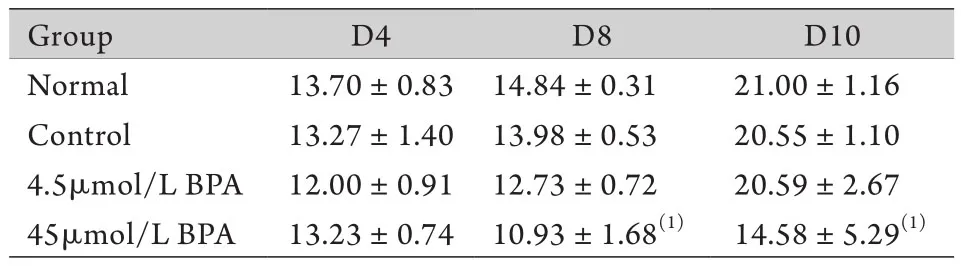
表3 D4、D8和D10卵泡培养液中E2水平(ng/L,±s,n=5)Tab.3 Contents of E2 in the follicle culture media at the 4th,8th and 10th day (ng/L, ±s, n=20)
(1)P<0.05 compared with normal group
Group D4 D8 D10 Normal 13.70±0.83 14.84±0.31 21.00±1.16 Control 13.27±1.40 13.98±0.53 20.55±1.10 4.5μmol/L BPA 12.00±0.91 12.73±0.72 20.59±2.67 45μmol/L BPA 13.23±0.74 10.93±1.68(1) 14.58±5.29(1)
2.4 BPA对卵母细胞GDF-9和BMP-15表达的影响
收集D10卵泡,采用Western blotting检测卵泡中GDF-9和BMP-15的表达,结果显示,与对照组比较,45μmol/L BPA明显降低了卵母细胞GDF-9和BMP-15的表达(P<0.05),而4.5μmol/L BPA对GDF-9和BMP-15的表达无明显影响(P>0.05,图4)。
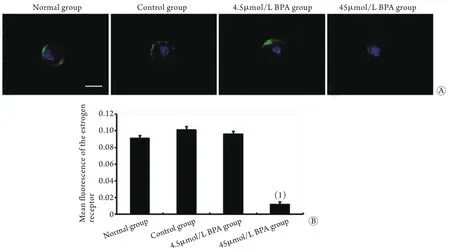
图3 培养D10卵母细胞雌激素受体的表达Fig.3 Expression of estrogen receptor at the 10th day
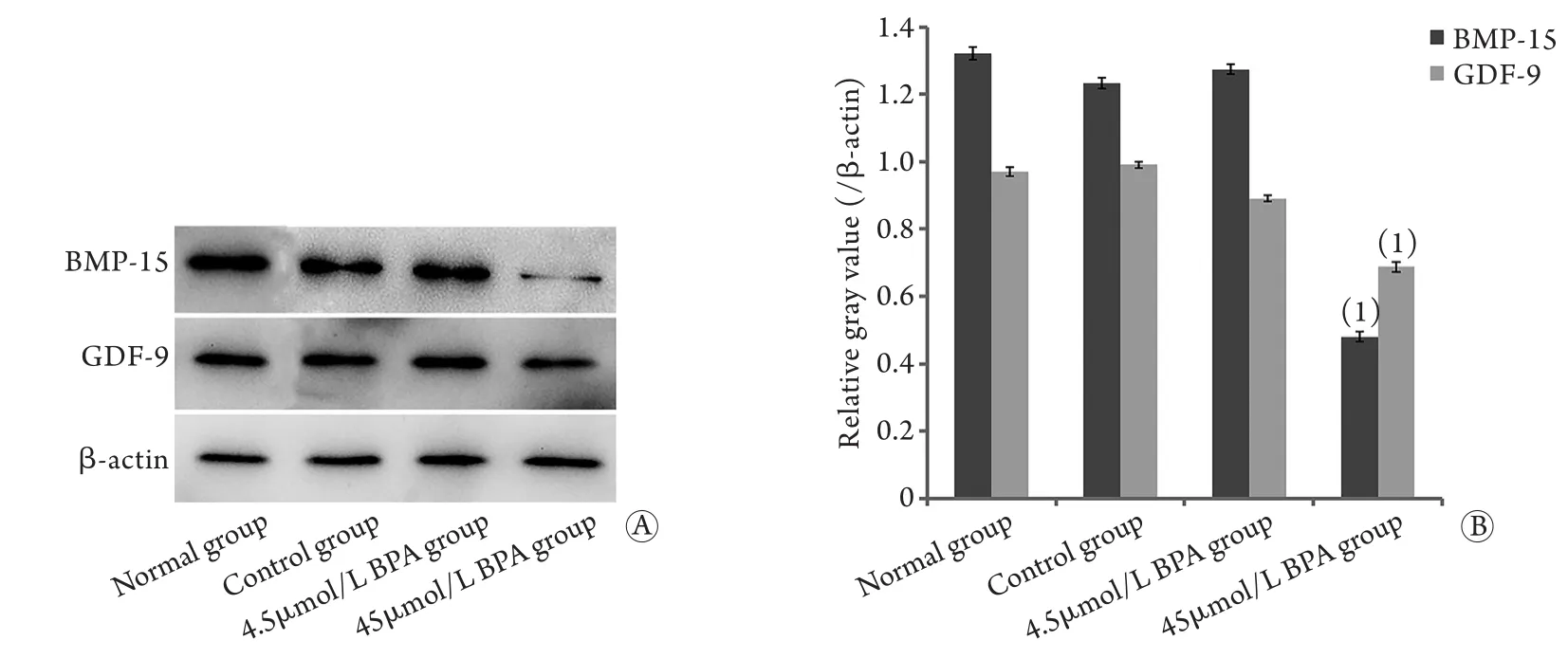
图4 培养D10卵泡GDF-9和BMP-15蛋白表达Fig.4 Protein expression of GDF-9 and BMP-15 in follicles at D10
3 讨 论
美国食品和药品监督管理局确定人类每天BPA的摄入耐受剂量不超过50μg/kg[9]。但是人们在更多的动物实验中发现低于50μg/(kg·d)的BPA也会对动物健康产生明显的不良影响,尤其是生殖系统[10]。Hunt等[11]的研究指出,不应简单地把BPA仅仅当做一种有毒的化合物,因为BPA具有弱的雌激素活性,而激素类物质在剂量较高时仅能抑制人体的某些反应,在低剂量时反而会发挥较强的毒性作用。因此,2008年4月17日,美国国立卫生研究院决定,重新考虑BPA的安全剂量。目前一些国家正在对人类接触的BPA安全浓度范围进行更加科学、严谨的研究,在这一安全浓度确定之前,有必要在动物实验中研究BPA对雌性生殖的影响及其作用机制。
本研究将体外分离获取的小鼠腔前卵泡分别培养在含有不同浓度BPA的培养液中,结果发现,45μmol/L BPA明显抑制了腔前卵泡的生长发育,大多数腔前卵泡直径和颗粒细胞层厚度增加不明显,培养后期无卵泡腔形成,最终导致成熟的M2期卵母细胞数量明显减少,提示45μmol/L BPA抑制了颗粒细胞增殖,干扰了卵泡的体外发育。Zhou等[12]在大鼠卵巢颗粒细胞和卵泡膜细胞的体外培养液中添加BPA,发现100μmol/L BPA明显抑制了卵泡膜细胞和颗粒细胞的增殖。Xu等[13]发现100fmol/L~100μmol/L BPA可明显抑制小鼠颗粒细胞的增殖,且随着BPA浓度增加,其抑制作用更加明显。目前由于采用的检测系统不同,在检测BPA对卵泡发育的影响时出现了不同的结果,对BPA的影响浓度存在着很大的争议。大多数研究是将卵泡膜细胞和颗粒细胞从卵泡上分离下来单独进行培养,以研究BPA的影响。实际上卵泡是一个复杂的整体结构,各类细胞之间会发生相互作用,单独分离出某类细胞以研究BPA的作用,其结果会因未考虑卵泡的整体结构而产生偏差。本实验采用腔前卵泡的体外培养系统,对整个卵泡进行体外培养,研究BPA对整个卵泡发育过程的影响,保证了结果的准确性和可靠性,为研究环境毒性物质对生殖的干扰作用提供了一个很好的研究思路。
考虑到BPA具有类雌激素的作用,可能会影响卵泡对E2的分泌和雌激素受体的表达,本研究检测了小鼠卵泡培养液中E2的分泌水平。结果发现45μmol/L BPA组D8和D10培养液中E2的分泌水平明显降低,抑制了卵泡中雌激素的合成和分泌。Jackye等[14]也发现44~440μmol/L BPA可明显抑制卵泡雌激素及孕激素的合成和分泌。雌激素是由颗粒细胞和膜细胞共同合成的,雌激素分泌水平下降表明颗粒细胞和膜细胞的激素合成功能受损,可能会影响卵泡中卵母细胞雌激素受体的表达。Yu等[2]在鸡胚上发现BPA通过雌激素受体途径干扰了原始卵泡的形成。同时本研究发现,BPA抑制了颗粒细胞增殖,降低了卵母细胞雌激素受体的表达,抑制了雌激素对卵母细胞的促发育作用,导致裸卵率明显增加,成熟的M2期卵母细胞数量明显减少。Campen等[15]也发现50μmol/L BPA明显干扰了减数分裂纺锤体的形成和染色体的正常排列,进而影响了卵母细胞的成熟。
综上所述,本实验采用腔前卵泡的体外培养系统,保持了卵泡结构的完整性,研究了BPA对卵巢卵泡发育的干扰作用,发现45μmol/L BPA明显干扰了卵泡发育,抑制了卵母细胞的成熟,结果准确可靠,为研究BPA对人类健康的影响浓度和影响作用提供了借鉴依据,同时为研究环境内毒性物质对女性生殖健康的影响提供了一个合理、可行的研究思路。

