海洋寡糖及其衍生物活性的研究进展
赵小亮, 王钰婷, 肖 宁, 王 莎, 张伟杰
1.兰州理工大学生命科学与工程学院, 兰州 730050;2.甘肃省高校中藏药筛选评价及深加工重点实验室, 兰州 730050
海洋多糖具有不同于陆生生物多糖的结构及生物学活性,海洋植物、动物及微生物均可产生大量结构新颖的糖类化合物,特别是海藻多糖产量巨大,已实现大规模的制备,在医药、食品、保健品及化妆品等诸多领域应用广泛。海洋褐藻来源的褐藻胶、褐藻糖胶及褐藻淀粉,红藻来源的琼胶和卡拉胶,海洋绿藻来源的复杂硫酸多糖,海参来源的岩藻糖化硫酸软骨素,海洋甲壳动物来源的甲壳素等,已成为海洋糖类化合物研究的主要目标[1,2]。由于多糖存在分子量大、结构复杂、溶解性差、质量控制难以把握、在药物开发过程中不易被生物体吸收、很难穿过细胞膜及血脑屏障发挥作用等问题,因此,通过生物酶法、物理或化学的方法降低多糖的分子量制备寡糖或低聚糖,并将多糖用于药物的开发成为了糖化学、糖生物学及糖药物学的重要研究内容。因此,近年来对于海洋糖类化合物的研究逐渐转向对海洋寡糖的制备、结构、活性及机理的研究,以及功能产品和药物的开发等方面[3,4]。
海洋寡糖是以海藻、海洋动物及微生物来源的多糖为原料,经过稀酸、多糖水解酶、自由基或其他方法降解制备的聚合度为2~20的糖分子。由于海洋多糖结构类型多样,降解方法不同,可以获得不同结构类型的海洋寡糖。活性研究发现,海洋寡糖具有多种生物学活性,其活性与寡糖的聚合度、单糖组成及序列、修饰基团的数量及位置等结构特点密切相关。近年来对于寡糖的制备方法、结构特征及生物活性研究较多的典型海洋寡糖主要有来源于红藻的琼胶寡糖和卡拉胶寡糖、来源于褐藻的褐藻胶寡糖、褐藻糖胶寡糖和褐藻淀粉寡糖,以及来源于海洋甲壳动物的壳寡糖等[4]。海洋寡糖来源丰富、结构独特、活性多样,随着研究的不断深入,已取得了大量的研究成果。本文就近年来海洋寡糖及其衍生物活性方面的研究情况进行了简要总结,以期为海洋寡糖的进一步研究和深入开发提供参考。
1 典型海洋寡糖及其结构
1.1 琼胶寡糖(agaro-oligosaccharides)
以琼胶为原料通过酸降解可以获得以β-D-半乳糖(Gal)为还原端和非还原端的奇数聚合度寡糖 (图1A),通过琼胶酶则可以获得不同结构的偶数聚合度寡糖,其中α-琼胶酶裂解琼胶中的α(1→3)糖苷键,产生以β-D-Gal为非还原端和以3,6-内醚-α-L-Gal (3,6-AnGal) 为还原端的寡糖 (图1B),而β-琼胶酶裂解琼胶中的β(1→4)糖苷键,产生以β-D-Gal为还原端和以3,6-AnGal为非还原端的结构不同的新琼胶寡糖 (图1C)。除此之外,某些琼胶分子中Gal残基C6被硫酸基取代,经降解可以获得硫琼胶寡糖[4]。不同聚合度及不同末端的琼胶寡糖表现出不同的生物学活性,王玉峰等[5~7]通过糖芯片研究了不同结构琼胶寡糖与蓖麻凝集素RCA120的相互作用,发现非还原端为Galβ1,4→结构、聚合度为3~11的奇数寡糖与RCA120具有较强的结合力,亲和力与聚合度大小无关,当非还原端为Gal的C6被硫酸基取代的硫琼胶时,活性明显增强,而当非还原端为被3,6-AnGal取代的酶降解的偶数琼胶寡糖时,大大降低了与RCA120的亲和力,并且亲和力的强弱也与寡糖的聚合度无关,表明琼胶寡糖非还原端的结构与硫酸基的修饰会明显影响其与功能蛋白的结合活性。
1.2 卡拉胶寡糖(carrageenan oligosaccharides)
卡拉胶寡糖以大分子量卡拉胶为原料,通过酸水解或酶解等方法降解制备。按卡拉胶Gal上硫酸基的位置及数量不同可分为十多种类型,其中最常见的是κ-卡拉胶、ι-卡拉胶和λ-卡拉胶3种。杨波等[8,9]对海洋硫酸半乳聚糖降解机理进行了系统的研究,发现酸水解κ-卡拉胶可获得系列还原端和非还原端均为1,3-β-D-4-硫酸半乳糖(G4S)的奇数寡糖(图2A),通过卡拉胶酶降解则可以获得系列κ-卡拉胶偶数寡糖(图2B)。ι-卡拉胶经过酸水解可以获得以2-硫酸3,6-内醚半乳糖(A2S)为还原端、以G4S为非还原端的偶数寡糖(图2C),其结构与酶水解获得的以A2S为非还原端、以G4S为还原端的偶数寡糖(图2D) 结构明显不同。由于λ-卡拉胶结构中没有3,6-AnGal的结构,其酸水解寡糖为奇数和偶数均有的连续聚合度的寡糖混合物(图2E)。通过糖芯片研究卡拉胶与凝集素RCA120结合作用发现,卡拉胶寡糖非还原端的Gal C4位被硫酸根取代的κ-卡拉胶、ι-卡拉胶寡糖与凝集素几乎无结合活性。而RCA120与脱硫前后的λ-卡拉胶寡糖结合实验发现,非还原端Gal C2位被硫酸根取代可以增强寡糖与凝集素的亲和力[5~7],这说明硫酸根的取代以及取代位置均会对寡糖的活性产生影响。
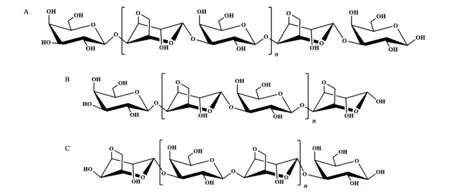
图1 不同琼胶寡糖结构Fig.1 Structure of different agaro-oligosaccharides.A: 酸水解奇数琼胶寡糖;B: α-琼胶酶水解获得的偶数琼胶寡糖;C: β-琼胶酶水解获得的偶数新琼胶寡糖
1.3 褐藻胶寡糖(alginate-derived oligosaccharide)
在褐藻胶的分子结构中存在3种组成不同的结构片段:β-D-1,4-连接的聚甘露糖醛酸、α-L-1,4-连接的聚古洛糖醛酸以及甘露糖醛酸和古洛糖醛酸交替共聚的片段。褐藻胶经过酸水解和酶水解均可以获得不同聚合度的寡糖,其中褐藻胶酶水解可以在寡糖的非还原端产生不饱和双键(图3),这为褐藻胶寡糖的检测提供了方便,同时,双键的产生也会引起褐藻胶寡糖活性发生变化。

图2 卡拉胶寡糖结构Fig.2 Structure of carrageenan oligosaccharides.A: 酸水解获得的奇数κ-卡拉胶寡糖;B: 酶水解获得的偶数κ-卡拉胶寡糖;C: 酸水解获得的偶数ι-卡拉胶寡糖;D: 酶水解获得的偶数新ι-卡拉胶寡糖;E: λ-卡拉胶寡糖
1.4 褐藻糖胶寡糖 (fuco-oligosaccharide)
褐藻糖胶是来源于褐藻的一类结构复杂的褐藻多糖,因含有岩藻糖(Fuc)和硫酸基也称为岩藻聚糖硫酸酯,典型褐藻糖胶中Fuc以α-1,3或α-1,3/1,4方式连接,并在C2、C3位有不同程度的硫酸化取代,或在C2位有Fuc的分支。褐藻糖胶经过酸水解或者酶降解可以获得相应不同聚合度的寡糖(图4),酸水解过程中可能伴随硫酸根的脱落。
1.5 壳寡糖(chitosan oligosaccharide)
壳寡糖是以壳聚糖为原料,采用不同的方法降解制备的寡聚β-D-1,4-葡萄糖胺(图5)。壳聚糖降解制备壳寡糖既可以采用酸降解、氧化降解等化学降解方法,也可以通过微波、超声波等物理学方法实现,另外也可以采用专一性的壳聚糖酶及非专一性的纤维素酶、半纤维素酶、果胶酶降解等生物学方法。由于壳聚糖是将甲壳素经过脱乙酰处理获得,脱乙酰过程往往存在不完全的情况,因此,获得的壳寡糖也可能会有不同程度的N-乙酰化修饰。

图3 褐藻胶寡糖结构Fig.3 Structure of alginate-derived oligosaccharide.A: 酸水解古洛糖醛酸寡糖;B: 酶水解非还原端不饱和古洛糖醛酸寡糖;C: 酸水解甘露糖醛酸寡糖;D: 酶水解非还原端不饱和甘露糖醛酸寡糖;E: 酸水解杂合褐藻胶寡糖;F: 酶水解非还原端不饱和杂合褐藻胶寡糖

图5 壳寡糖结构Fig.5 Structure of chitosan oligosaccharide.
2 海洋寡糖活性
2.1 免疫调节及抗肿瘤活性
海洋寡糖结构类型多样,具有体内多靶点的作用特点,很多其他生物活性都与其免疫调节功能相关。因此,关于海洋寡糖免疫增强作用及抗肿瘤活性的研究是海洋寡糖活性研究的热点之一。Xu等[10]研究发现κ-卡拉胶寡糖可以保护小胶质细胞免受LPS的激活,免疫活性与硫酸根含量相关,硫酸根含量越高,其活性越强。分子量对褐藻胶及其寡糖的免疫活性存在明显影响,Xu等[11]比较了大分子量褐藻胶与3种不同方法制备的褐藻胶寡糖对巨噬细胞的激活作用,发现酶解制备的非还原端具有不饱和双键的寡糖可以激活NF-κB和MAPK信号通路,诱导NO、ROS和TNF-α产生,其活性与分子量、寡糖末端结构以及分子中古洛糖醛酸和甘露糖醛酸的比例都有关。 褐藻胶寡糖末端结构及聚合度对其活性有明显的影响,酶解褐藻胶寡糖能够以结构依赖性方式诱导RAW264.7细胞分泌TNF-α,其中古洛糖醛酸八糖和甘露糖醛酸七糖活性最强,而酸水解获得的末端饱和的寡糖活性很低,研究发现褐藻胶寡糖通过模式识别受体刺激先天免疫发挥免疫增强活性[12]。此外,Fang等[13]发现古洛糖醛酸寡糖GOS可以被巨噬细胞RAW264.7识别并上调Toll样受体4(TLR4),通过TLR4被巨噬细胞内吞,刺激TLR4/Akt/NF-κB、TLR4/Akt/mTOR和MAPK信号通路并发挥免疫刺激活性。由于壳寡糖分子中含有氨基基团,其生物活性与酸性寡糖存在明显的差异,也成为药物研发的重要研究对象。已有研究证明,壳寡糖可以促进单核巨噬细胞吞噬功能,提高抗体产生及免疫器官指标,能增强小鼠细胞免疫、体液免疫和非特异性免疫[14]。
海洋寡糖显著的免疫增强活性也为其抗肿瘤作用机制的研究提供了思路。κ-卡拉胶寡糖可以通过增强免疫提高抗肿瘤活性,其衍生物尤其是硫酸化修饰产物能够显著增强荷瘤小鼠抗肿瘤活性[15,16]。海洋寡糖抗肿瘤作用的强弱也与结构相关,Hu等[17]制备了2种硫酸基含量的κ-卡拉胶寡糖,在100 mg/kg剂量下对S180荷瘤小鼠肿瘤抑制率可达70.8%,高硫酸化卡拉胶寡糖抗肿瘤活性明显强于低硫酸化寡糖,机制研究发现其抗肿瘤作用是通过促进免疫器官如胸腺的生长而实现的。酶法制备的κ-卡拉胶二糖、六糖及八糖在体内和体外均具有抗肿瘤和抗血管生成活性,特别是能够抑制肿瘤细胞向血管内皮细胞的分化[18]。Chen等[19]建立了κ-卡拉胶寡糖金纳米颗粒 (CAO-AuNPs) 的绿色合成方法,并研究了CAO-AuNPs体外抗肿瘤活性,发现其对肿瘤细胞HCT-116和MDA-MB-231具有明显的细胞毒性。
不同结构类型的褐藻胶寡糖及其衍生物也表现出抗肿瘤活性。硫酸化的甘露糖醛酸寡糖具有类似肝素的结构特点,在体外和体内均显示具有抑制肿瘤生长和迁移的作用[20, 21]。硫酸化的甘露糖醛酸寡糖JG6能够通过与CXCL12相互作用,剂量依赖性的抑制CXCL12诱导的Bel-7402和HeLa细胞中AKT、ERK、FAK和Paxillin等蛋白的磷酸化,进而抑制CXCL12/SDF-1介导的人肿瘤细胞的增殖和侵袭[22]。Huang等[23]的研究则发现JG6可以结合到Cofilin,占据Cofilin的肌动蛋白结合位点,破坏Cofilin调节的肌动蛋白转换,抑制人乳腺癌细胞的迁移和乳腺癌异种移植中的癌症转移。Ma等[24]降解、硫酸化及C6位部分酯化制备的硫酸化甘露糖醛酸寡糖MdOS可以抑制HER2、EGFR、VEGFR、PDGFR、c-Kit、FGFR1和c-Src表达,抑制PTK磷酸化,作为ATP的竞争性抑制剂抑制HMEC的增殖和血管的生成,阻止大鼠主动脉环的微血管生长和阻碍小鸡尿囊膜的新血管形成,以PTK依赖性的方式发挥抗血管生成活性,有望用于PTK相关的癌症治疗。通过硫酸化修饰增加寡糖的负电荷,可以使其发挥更好的抗肿瘤活性,同时寡糖的聚合度对抗肿瘤活性也存在着明显的影响。Chen等[25]将聚合度为2~5的褐藻胶寡糖用于临床骨肉瘤患者的治疗,发现聚合度为5的寡糖可减缓骨肉瘤的进程,其抗肿瘤作用与改善患者抗氧化和抗炎能力有关。Yang等[26]研究发现褐藻胶寡糖通过microRNA-29b间接影响Toll样受体信号传导来抑制动脉瘤复发。
海参可以产生结构新颖的岩藻糖化硫酸软骨素,不仅具有硫酸软骨素的主链结构,同时存在不同硫酸化的侧链岩藻糖的修饰,表现出独特的生物学活性。Liu等[27]研究发现冰岛刺参 (Cucumariafrondosa) 来源的低分子量岩藻糖化硫酸软骨素LFCS能够以剂量依赖的方式显著抑制小鼠Lewis肺癌的生长和转移,LFCS通过激活LLC细胞中的caspase-3活性来增加p53/p21的表达和凋亡,从而诱导细胞周期停滞。同时,LFCS可抑制血管内皮生长因子的表达,增加组织金属蛋白酶抑制剂-1的表达,下调基质金属蛋白酶水平,抑制ERK1/2/p38 MAPK/NF-κB信号通路的激活。
海洋寡糖的活性作用靶点多,机制复杂,如抗肿瘤活性多是通过抗氧化、免疫增强等作用实现,也为构效关系的研究带来了挑战。
2.2 抗氧化及抗辐射活性
生物体过量活性氧的存在,会对生物大分子如核酸、蛋白质等造成损伤,引发肿瘤、神经退行性疾病等的发生。研究发现,海洋多糖、寡糖及其衍生物在体内及体外实验中具有抗氧化的作用。κ-卡拉胶寡糖及其过硫酸化、低乙酰化、高乙酰化及磷酸化衍生物具有明显的体外抗氧化活性,并通过抗氧化作用发挥细胞保护活性[28]。Wang等[29]通过琼胶酶降解制备了琼寡糖,研究了琼寡糖对羟基自由基、超氧阴离子自由基的清除作用以及抑制脂质过氧化反应活性,结果发现硫酸化的琼胶寡糖具有更强的活性,大分子量的琼胶寡糖活性强于低分子量的琼胶寡糖。Jin等[30]以褐藻糖胶为原料制备了葡萄糖醛酸甘露寡糖,并修饰获得硫酸化寡糖衍生物,体外清除自由基活性研究发现寡糖聚合度越大,对超氧自由基、还原能力和DPPH的清除能力越强,硫酸化程度越高,还原能力和DPPH自由基清除活性反而越低。体内实验中,Fan等[31]采用Morris水迷宫试验研究了海洋寡糖AOSC对东莨菪碱诱导的大鼠遗忘的作用,使用该寡糖30 d,评估了寡糖对大鼠的逃避潜伏期、游泳距离和具有记忆障碍的游泳时间的影响,结果表明AOSC减轻了东莨菪碱诱导的记忆障碍,进一步研究发现AOSC通过增加SOD、GSH-Px和ATP酶的活性来改善东莨菪碱引起的氧化损伤,明显减少了细胞内游离钙离子的过载,抑制了人神经母细胞瘤SH-SY5Y细胞中双氧水诱导的凋亡,表明AOSC可以通过其抗氧化活性诱导认知改善。
海洋寡糖也表现出明显的抗辐射活性。He等[32]研究发现低分子量的褐藻胶寡糖(ADO)(373~571 Da)和壳寡糖(COS)(855~1 671 Da)对紫外线照射下的白色念珠菌、大肠杆菌、枯草芽孢杆菌孢子和红细胞溶血具有抑制活性。受6.0Gy X射线照射小鼠给喂卡拉胶寡糖后,30 d存活率比照射对照组提高了75%~90%,同时,卡拉胶寡糖能加速小鼠外周血白细胞的恢复,显著提高胸腺指数和脾脏指数,激活脾脏NK细胞的杀伤活性,增强巨噬细胞的吞噬功能,对放射损伤小鼠的T细胞功能和亚型有明显调节作用[33,34]。
海洋寡糖的抗氧化及抗辐射活性也是发挥其他活性如抗肿瘤的作用方式之一,同时也是海洋寡糖用于保健品及功能食品开发的重要依据。
2.3 抑菌及抗病毒活性
研究发现海洋寡糖也具有抑菌活性。Wang等[35]制备了不同类型的寡糖,比较了寡糖对大肠杆菌、霍乱弧菌、空肠弯曲杆菌和鼠伤寒沙门氏菌与HT-29细胞粘附的抑制作用,发现抗粘附作用与寡糖的结构和浓度相关,其中,壳寡糖能显著抑制霍乱弧菌对上皮细胞的粘附。Roberts等[36]研究发现甘露糖醛酸寡糖和三氯生联合使用时可增强对口腔微生物Streptococcusmutans和Porphyromonasgingivalis的抑制作用,同时可减少细菌对牙科材料(如钛)的附着。已有研究证明,低分子量的褐藻胶寡糖能够破坏假单胞菌微菌落体的形成,并增强抗生素的功效[37];褐藻胶寡糖混合物可以提高溶菌酶抗微生物活性的生物利用度[38]。Xu等[39]研究了多聚古洛糖醛酸与不饱和古洛糖醛酸寡糖对巨噬细胞抗菌活性的影响,发现GOS可通过调节与先天免疫相关的信号传导增强巨噬细胞的抗菌活性,以五糖活性最强。
海洋寡糖及其衍生物具有硫酸根及糖醛酸等酸性基团的结构特点,与病毒表面功能蛋白作用可干扰病毒对宿主细胞的吸附,达到抗病毒的作用。海带来源的岩藻聚糖硫酸酯及硫酸岩藻寡糖具有抗甲型流感病毒的作用,糖芯片研究发现硫酸岩藻寡糖可以结合流感病毒表面神经氨酸酶,抑制其活性,硫酸岩藻寡糖的聚合度、连接方式及硫酸根含量会影响其与神经氨酸酶的亲和力[40]。酶降解制备的κ-新卡拉胶寡糖可干扰HSV-1毒株对Vero细胞的吸附[41]。Kalitnik等[42]比较了通过自由基、弱酸及酶水解获得不同分子量的κ-卡拉胶和κ/β-杂合型卡拉胶对烟草花叶病毒的抗病毒活性,发现通过弱酸水解获得的产物抗病毒活性高于通过自由基降解的产物,而酶降解制备的寡糖活性最低。Wang等[43]研究发现κ-卡拉胶寡糖(CO-1)可以显著抑制甲型流感病毒(H1N1)在MDCK细胞中的复制 (选择性指数>25.0),比较发现分子量2 kDa的寡糖比分子量3 kDa和5 kDa的活性更强,并且呈现剂量依赖性的特征,进一步研究发现CO-1不结合在MDCK的细胞表面,但在预处理后可以灭活病毒颗粒,分子量2 kDa的κ-卡拉胶寡糖不同于多糖的作用,可以进入MDCK细胞但是不干扰IAV吸附,作用机理研究表明CO-1在其内化到细胞中后可以抑制流感病毒 mRNA和蛋白质表达。同时发现κ-卡拉胶寡糖CO-1对病毒内化后在一个复制周期中病毒释放之前的IAV复制具有抗病毒作用。进一步比较研究低分子量的κ-卡拉胶寡糖及其硫酸化衍生物对甲型流感病毒的抑制作用,发现分子量和硫酸化水平是其抗流感病毒的关键因素,分子中每个二糖单元含有0.8~1.0个硫酸基团的分子量为 1~3 kDa时活性最强,κ-卡拉胶寡糖及其硫酸化衍生物还可以显著改善甲型流感病毒感染小鼠的存活率和降低肺部病毒滴度,其抗病毒作用不依赖于干扰素系统[44]。赵金华等[45]采用双氧水降解制备了低分子量岩藻糖化硫酸软骨素,发现其为gp120侵入抑制剂,具有强效抗HIV-1病毒活性,可用于预防和/或治疗艾滋病。寡糖抗病毒的作用机制不同于传统抗病毒药物,具有低毒的特点,用于病毒类传染病的预防和治疗具有很好的潜力。
2.4 对肠道微生物的影响
哺乳动物肠道微生物在宿主健康、营养、代谢和免疫稳态中发挥重要功能,随着对肠道微生物群落的遗传和代谢特征的大量研究,发现肠道微生物与宿主协同作用可促进机体健康,但也会引发肝病、炎症性肠病、结肠直肠癌、代谢综合症和肥胖相关等疾病的发生[46,47]。研究发现海洋多糖及寡糖能够改善肠道微生物的组成,发挥积极作用。琼胶寡糖可以显著降低小鼠附睾脂肪组织重量和血清非酯化脂肪酸浓度,增加盲肠内容物重量,调节小鼠肠道微生物组成,抑制小鼠肥胖的发生[48],预防高脂饮食引起的肠道生态失调,从而抑制结肠癌的发生[49]。Li等[50]从人类粪便中分离得到可以减轻高脂肪饮食诱导的代谢紊乱拟杆菌 (Bacteroidesuniformis) L8,该菌可以降解琼胶寡糖产生Gal,作为B.uniformisL8生长的底物,这可能是琼胶寡糖预防高脂饮食引起肠道代谢紊乱的原因,同时发现婴儿双歧杆菌和青春双歧杆菌可以利用琼胶三糖。褐藻胶、甘露糖醛酸寡糖和古洛糖醛酸可以被人体肠道细菌Bacteroidesovatus、Bacteroidesxylanisolvens和Bacteroidesthetaiotaomicron降解,增加短链脂肪酸 (SCFA) 的产生,其中古洛糖醛酸寡糖作用最为明显,这为褐藻胶寡糖作为特殊食品添加剂提供了理论依据[51]。卡拉胶寡糖因可能导致肠道炎症、促进肠癌发生而备受关注。李苗苗[52]从 κ-卡拉胶寡糖降解菌的角度研究了卡拉胶寡糖的致炎机理,发现接种κ-卡拉胶寡糖降解菌以及接种降解菌并喂 κ-卡拉胶寡糖的小鼠结肠炎症程度高于空白对照组和单独喂κ-卡拉胶寡糖的小鼠,提示卡拉胶寡糖的致炎可能与降解菌有关,κ-卡拉胶寡糖可能进一步加剧炎症程度。
2.5 神经保护活性
神经退行性疾病的发生会严重影响人们的生活质量,但目前还没有有效的药物进行治疗。寡糖分子量小,能跨越血脑屏障,有效穿过细胞膜发挥作用,研究发现海洋寡糖具有神经保护活性,来源于海洋的糖类药物甘露寡糖二酸GV971能够多位点、多片段、多状态地捕获β淀粉样蛋白 (Aβ),抑制Aβ纤丝形成,使已形成的纤丝解聚为无毒单体,有望成为治疗阿尔茨海默症的新型海洋寡糖药物。刘洋等[53]研究发现经过与κ-卡拉胶寡糖孵育,Aβ25-35所诱导的SH-SY5Y细胞存活率明显上升,凋亡率明显下降,说明κ-卡拉胶寡糖具有神经保护作用。Zhou等[54]研究发现,经过褐藻胶寡糖预处理,可显著抑制LPS/Aβ刺激的BV2小胶质细胞一氧化氮和前列腺素E2的产生,诱导型一氧化氮合酶、环氧合酶-2和促炎细胞因子的分泌,减弱BV2细胞中LPS激活的TLR4和NF-κB的过度表达,并通过与小胶质细胞中TLR4的相互作用促进了Aβ的吞噬,表明褐藻胶寡糖具有用于神经退行性疾病特别是阿尔茨海默病治疗的潜力。Tusi等[55]通过体内实验证实了褐藻胶寡糖对Aβ诱导神经损伤的保护作用。Wang等[56]研究了来源于褐藻昆布 (EchloniakuromeOkam) 的酸性寡糖AOSC对Aβ诱导的炎症反应以及细胞毒性的作用,结果发现AOSC可以抑制星形胶质细胞的反应性表型,阻断细胞氧化应激,减少肿瘤坏死因子TNF-α和白细胞介素IL-6的产生,并防止Ca2+的流入,表明AOSC有可能开发为阿尔兹海默症的治疗药物。
2.6 抗糖尿病活性
海洋寡糖及其衍生物也具有降血糖和抑制糖苷酶的活性,表现出抗糖尿病的活性。Hao等[57]研究发现甘露糖醛酸-铬配合物可以改善C2C12骨骼肌细胞中的胰岛素敏感性,并可以作为一种新的低毒的葡萄糖摄取刺激器,或者用作2型糖尿病患者的膳食补充或潜在药物。Hou等[58]研究发现口服给药昆布寡糖8周可以降低高脂饲料和链脲霉素诱导的2型糖尿病大鼠的血糖、甘油三酯、总胆固醇和游离脂肪酸含量,增加体重,具有抗2型糖尿病的活性。Yu等[59]研究发现壳寡糖GO2KA1可以有效抑制人和动物的餐后血糖、血浆脂联素和HbA1c水平的升高,机制研究发现GO2KA1以不同于阿卡波糖的方式抑制α-葡萄糖苷酶及葡萄糖转运蛋白SGLT1和GLUT2活性,下调PPARγ表达,抑制肠道葡萄糖消化和转运,预防高血糖症,发挥抗糖尿病活性。
2.7 抗凝血活性
海洋寡糖具有类似肝素的结构特点,表现出了明显的抗凝血活性,活性与分子量大小及硫酸根的含量及位置有关,分子量越大,硫酸基含量越高,抗凝血活性越强,同时可以避免肝素使用中的出血风险,具有很好的抗凝血药物开发前景。浓度为0.25%~8%的κ-卡拉胶寡糖能显著延长家兔的凝血时间 (clotting time,CT),对凝血酶时间 (thrombin time,TT) 和活化部分凝血酶时间 (activated partial thromboplastin time,APTT) 作用明显,说明κ-卡拉胶寡糖可能是通过内源性途径发挥抗凝血作用[60]。Sun等[61]通过H2O2氧化降解羊栖菜多糖(Saragassumfusiformepolysaccharide, SFP)制备低分子量寡糖LSFP,体外抗凝血活性实验发现LSFP和SFP可以通过内源性、外源性和常见的凝血途径发挥抗凝血活性,显著延长APTT、PT和TT,构效关系分析表明硫酸根含量、分子量及单糖中岩藻糖的含量对抗凝血活性有影响。Zhao等[62]发现从海参岩藻糖化硫酸软骨素制备的九糖以10 mg/kg的剂量可以抑制小鼠体内97%血栓的形成,避免出血风险,发挥抗凝血的活性。Zhang等[63]则在酶解天然硫酸软骨素获得硫酸软骨素四糖和六糖的基础上,化学合成了海参岩藻糖化硫酸软骨素六糖和九糖,抗凝血活性研究发现九糖能够选择性抑制FXase,半数抑制浓度与抗凝血药物低分子量肝素相当,同时可避免出血风险,有望开发为具有新作用机制的抗凝血药物。
2.8 对动植物生长的影响
海洋寡糖还表现出促进动植物生长的活性。研究发现,日粮添加0.1%卡拉胶寡糖,可抑制肉仔鸡肠中大肠杆菌、双歧杆菌和乳酸杆菌的增殖,促进小肠微绒毛生长发育,提高免疫反应和生产性能[64]。在饲料中添加褐藻胶寡糖,可通过提高血清过氧化氢酶活性和谷胱甘肽含量,有效促进断奶仔猪的抗氧化防御能力,同时,AOS可以改善血清胰岛素和胰岛素样生长因子-1的水平,升高营养物质的消化率 (粗蛋白质、灰分和脂肪),提高十二指肠和空肠粘膜中麦芽糖酶和蔗糖酶的活性,增加空肠粘膜中的Na+/葡萄糖共转运蛋白1 (SGLT1) 和二价金属转运体1 (DMT1) 的合成,有效刺激断奶仔猪的生长[65]。Jiang等[66]通过在饲料中添加0.1%的褐藻胶寡糖,研究了褐藻胶寡糖(alginate-derived oligosaccharide, ADO)对海参(Apostichopusjaponicas)体壁过氧化物酶(peroxidase,POD)、磷酸酶(phosphatase,ACP)、碱性磷酸酶 (alkaline phosphatase,AKP) 和溶菌酶(lysozyme,LSZ)活性的影响,结果发现POD、AKP和ACP活性先升高后降低,POD活性在第10 d显著增强(P<0.01),比对照组增加306%,AKP活性与对照相比均有显著性的差异,ACP和LSZ活性在第20 d和第40 d具有显著差异,体壁酶活性的变化表明褐藻胶寡糖对体液中的酶的影响高于对体壁中的酶活性的影响,褐藻胶寡糖的加入可以促进海参腔液和体壁中POD、ACP、AKP和LSZ的活性,表明ADO可以明显提高海参的非特异性免疫。κ-卡拉胶寡糖则具有增强仿刺参免疫活性的作用[67]。
褐藻胶寡糖和卡拉胶寡糖可以通过增强植物氮同化、基础代谢水平和细胞分化促进植物生长,同时卡拉胶寡糖可以诱导植物纤维素和精油含量,以及苯丙烷类化合物积累增加,进而提高对病原体的防御能力[68]。Yokose等[69]研究了褐藻胶寡糖混合物(alginate oligosaccharide mixture,AOM)对单细胞海洋微藻微拟球藻 (Nannochloropsisoculata) 生长的影响,发现AOM可以浓度依赖性的促进微拟球藻的生长,在20 mg/mL时其活性达到最强,与对照组相比,添加AOM后褐藻的生长速率几乎比对照高5倍,而且AOM还可以改善Cu2+的杀藻作用。Yamasaki等[70]研究表明AOM可以显著促进绿藻(Chlamydomonasreinhardtii)的生长,并影响其脂肪酸的组成。Hu等[71]研究了不同浓度分子量为1 445 Da的褐藻胶寡糖对玉米种子萌发的影响,在浓度为0.75‰时,α-淀粉酶和β-淀粉酶显示了最强的活性,与对照相比,处理后玉米根在3 d和7 d后分别增加了18%和34%,芽的生长在第7 d增加了46%,说明褐藻胶寡糖通过增加对种子萌发有重要作用的几种酶的活性从而增加了种子发芽的速率。已有研究发现,酶降解获得的不饱和褐藻胶寡糖相比褐藻胶能够促进培养基中胡萝卜和水稻根的生长[72]。同时褐藻糖胶寡糖能够显著促进烟草细胞培养过程中培养基碱化和过氧化氢释放,诱导烟草叶获得系统性抗性标志物水杨酸和致病相关的蛋白积累,刺激烟草对烟草花叶病毒的局部和系统抗性[73]。Luan等[74]发现通过γ-射线照射降解制备的褐藻胶寡糖能明显促进莴苣和芥菜的生长,最佳浓度为75 mg/L。海洋寡糖来源丰富,产量高,用于动植物生长调节剂,具有绿色环保及成本低的优势。
2.9 其他活性
海洋寡糖结构类型多样,作用靶点多,决定了其具有多种生物活性,除了以上在抗肿瘤、抗氧化、免疫调节等方面的研究和应用之外,也发现在其他方面具有显著的活性。卡拉胶寡糖和焦磷酸钠浸泡处理能有效抑制冷冻虾仁解冻损失率的增加,减少肌原纤维蛋白含量和Ca2+-ATPase活性的下降,对虾仁pH、明度和质构特性的保护效果显著,有利于冷冻虾仁品质的保持[75],褐藻胶及其寡糖也具有保护冷冻贮藏虾 (Litopenaeusvannamei) 品质的作用[76]。Ariyo等[77]研究发现甘露糖醛酸寡糖(oligomannuronate, OM)和古洛糖醛酸寡糖(oligoguluronate, OG)可以促进Penicilliumchrysogenum青霉素的生物合成,通过10~100 μg/mL OM的作用,在P.chrysogenumP2培养液中,青霉素G的产量最大可增加约50%,而P.chrysogenumNRRL 1951最大可增加约150%。褐藻胶寡糖还可以通过诱导IL-12产生抑制Th2发育和IgE产生,可用于预防过敏性疾病[78]。褐藻胶寡糖处理可显著减弱消化/氧化应激,减少3-硝基酪氨酸含量和超氧化物产生,下调诱导型一氧化氮合酶,NADPH氧化酶2和4-羟基壬烯醛,同时,可抑制内质网应激介导的凋亡途径,减少心肌细胞凋亡,上调抗凋亡蛋白B细胞淋巴瘤-2表达,使心脏对心肌缺血/再灌注(I/R)损伤具有抗性,预防急性阿霉素心脏毒性[79,80]。
3 展望
对于海洋来源寡糖及其衍生物的活性研究,不仅可以丰富小分子活性糖类化合物的种类,也可以进一步揭示海洋多糖活性的细微结构基础及活性作用机制,发现新的活性结构单元。但是由于海洋寡糖在生物体作用靶点多,活性作用机制复杂,一定程度影响了海洋寡糖的应用和开发速度,新的研究方法如计算机虚拟筛选,糖生物芯片等高通量研究手段用于海洋寡糖及其活性的研究,将为海洋寡糖的研究提供新的思路。随着研究的不断深入,海洋寡糖在食品、医药、农业等领域的应用也必将更加广泛。

