缺氧诱导因子-2α对乳腺癌细胞多药耐药的影响
王志慧,梁文辉,原志庆,李 娜
(1.新乡医学院基础医学院病理学教研室,河南 新乡 453003;2.新乡市中心医院体检中心,河南 新乡 453000)
乳腺癌是女性常见的发生在乳腺导管上皮的恶性肿瘤,其发病率和病死率呈逐年上升趋势,已成为严重危害妇女身心健康的重要疾病之一[1]。目前,化学治疗是失去手术治疗最佳时机的恶性肿瘤患者的首选方案,但化学治疗耐药的出现是乳腺癌治疗失败和疾病进展的主要原因。大多数实体瘤具有低氧微环境,机体内的缺氧环境是影响化学治疗和放射治疗效果的重要因素之一。目前,有关缺氧诱导化学治疗耐药的机制仍未完全明确,新近的研究结果表明,缺氧会增加肿瘤细胞对化学治疗药物的耐受[2]。作者的前期研究表明,缺氧诱导因子-2α(hypoxia inducible factor-2α,HIF-2α)的表达与多药耐药基因1的表达及乳腺癌多药耐药的发生也有关[3]。本研究进一步采用实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,qRT-PCR)和Western blot等多种方法检测HIF-2α在乳腺癌细胞中的表达,并检测缺氧状态下乳腺癌细胞对化学治疗药物的敏感性,以阐明HIF-2α在缺氧诱导乳腺癌多药耐药中的作用。
1 材料与方法
1.1主要试剂与仪器人低转移乳腺癌MCF-7细胞为本实验室保存;HIF-2α兔抗人多克隆抗体购自北京博奥森生物技术有限公司,AnnexinV-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)细胞凋亡检测试剂盒、增强化学发光试剂盒(enhanced chemiluminescence,ECL)购自上海碧云天生物有限公司,氟尿嘧啶、阿霉素和紫杉醇购自美国Pharmasia公司,CoCl2购自美国Sigma公司,引物由上海英潍捷基贸易有限公司合成,TRIzol试剂、RNA反转录试剂盒和qRT-PCR试剂盒购自大连TaKaRa公司;荧光显微镜购自日本Nikon公司,流式细胞仪购自美国BD公司,Step One荧光定量PCR仪购自美国ABI公司。
1.2细胞培养与分组将人低转移乳腺癌MCF-7细胞分为对照组、常氧组和缺氧组,各组细胞置于含体积分数10%胎牛血清、100 kU·L-1青霉素和 100 mg·L-1链霉素的高糖达尔伯克改良伊格尔培养基中,放入37 ℃、含体积分数5%CO2的恒温箱中常规培养24 h后,常氧组细胞更换含生理盐水的培养基;缺氧组细胞更换含CoCl2的培养基,CoCl2采用生理盐水稀释至终浓度为100 μmol·L-1;对照组细胞不处理。
1.3qRT-PCR检测各组细胞中HIF-2αmRNA的表达待细胞生长至70%融合时,按照TRIzol试剂说明书提取各组细胞总RNA,按照反转录试剂盒说明书体外反转录合成cDNA第1条链,使用qPCR检测各组细胞中HIF-2α mRNA的表达水平。HIF-2α上游引物序列为5′-TGAAAACGAGTCCGAAGCC-3′,下游引物序列为5′-GTGGCTGACTTGAGGTTGA-3′。PCR反应条件:94 ℃预变性30 s,94 ℃ 5 s,60 ℃ 30 s,共40个循环。以内参磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)mRNA为参照,通过公式2-ΔΔCt计算HIF-2α的相对表达量,以Ct值表示基因的起始表达量, HIF-2α mRNA表达水平的差异以变化倍率表示。
1.4Westernblot检测各组细胞中HIF-2α蛋白的表达待细胞长至70%融合时,按试剂盒要求提取各组细胞的总蛋白,总蛋白采用二喹啉甲酸(bicinchonininc acid,BCA)法进行定量。蛋白上清经十二烷基磺酸钠-聚丙烯酰胺凝胶电泳后转移至硝酸纤维素膜,脱脂牛奶室温封闭90 min,加入一抗于4 ℃孵育过夜;TBST洗涤3次,每次10 min;按照ECL试剂盒说明书进行操作,X线片曝光、显影、定影。应用Quantity One软件分析显色结果,计算内参条带与目的条带的灰度比值。
1.5细胞计数试剂盒-8(cellcountingkit-8,CCK8)检测人低转移乳腺癌MCF-7细胞对化学治疗药物的敏感性将人低转移乳腺癌MCF-7细胞在缺氧(缺氧组)和常氧(常氧组)状态下培养8 h后,参照氟尿嘧啶、阿霉素和紫杉醇3种化学治疗药物的血浆高峰浓度[4-5],分别加入相应化学治疗药物血浆高峰浓度的0.1、1和10倍,每种药物的不同浓度均设4个复孔,继续培养24 h,加入CCK-8反应液,37 ℃、体积分数5%CO2环境下培养1 h,于450 nm 处检测吸光度,计算不同化学治疗药物处理后常氧组和缺氧组人乳腺癌细胞MCF-7的存活率,以细胞存活率为纵轴,药物浓度对数为横轴作半对数图,按作图法求出3种化学治疗药物的半抑制浓度(half maximal inhibitory concentration,IC50),IC50越大,敏感性越低。细胞存活率=(实验组吸光度值-空白对照吸光度值)/(阴性对照吸光度值-空白对照吸光度值)×100%。
1.6流式细胞术检测缺氧状态下人低转移乳腺癌MCF-7细胞内化学治疗药物的蓄积和潴留常氧组和缺氧组人低转移乳腺癌MCF-7细胞按照每孔 1×105个细胞接种于6孔板,培养 24 h ,再分别于常氧和缺氧状态下继续培养8 h,每孔加入终浓度为5 mg·L-1阿霉素,继续培养1.5 h;置流式细胞仪进行检测,计算各组细胞药物的泵出率,细胞内药物的泵出率=(细胞内药物的蓄积量-细胞内药物的潴留量)/细胞内药物的蓄积量×100%。
1.7碘化丙啶(propidiumiodide,PI)染色法检测缺氧对化学治疗药物诱导细胞凋亡的影响将人低转移乳腺癌MCF-7细胞在缺氧(缺氧组)和常氧(常氧组)状态下处理8 h,加入终浓度为10倍血浆高峰浓度的阿霉素[5],继续培养24 h,收集常氧组和缺氧组细胞,加入195 μL Annexin V-FITC结合液轻轻垂悬细胞,加入5 μL Annexin V-FITC轻轻混匀,加入10 μL PI染色液,轻轻混匀,室温孵育20 min后在流式细胞仪上进行检测,计算各组细胞相应的凋亡指数,凋亡指数=(早期凋亡细胞数+晚期凋亡细胞数)/细胞总数×100%。

2 结果
2.1各组人低转移乳腺癌MCF-7细胞中HIF-2αmRNA表达比较对照组、常氧组和缺氧组人低转移乳腺癌MCF-7细胞中HIF-2α mRNA相对表达量分别为0.717±0.212、0.928±0.215、1.421±0.322,3组细胞中HIF-2α mRNA相对表达量比较差异有统计学意义(F=3.249,P<0.05);缺氧组人低转移乳腺癌MCF-7细胞中HIF-2α mRNA相对表达量高于常氧组和对照组,差异有统计学意义(P<0.05)。常氧组与对照组人低转移乳腺癌MCF-7细胞中HIF-2α mRNA相对表达量比较差异无统计学意义(P>0.05)。
2.2各组人低转移乳腺癌MCF-7细胞中HIF-2α蛋白表达比较对照组、常氧组和缺氧组乳腺癌细胞MCF-7中HIF-2α蛋白相对表达量分别为0.637±0.055、0.559±0.008、1.693±0.029,缺氧组人低转移乳腺癌MCF-7细胞中HIF-2α蛋白相对表达量显著高于常氧组和对照组,差异有统计学意义(F=2.623,P<0.05);常氧组与对照组人低转移乳腺癌MCF-7细胞中HIF-2α蛋白相对表达量比较差异无统计学意义(P>0.05);见图1。
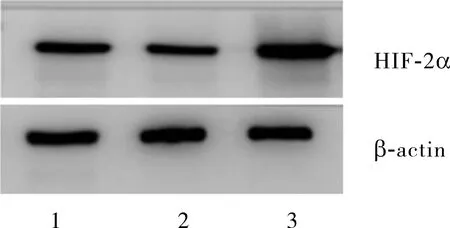
1:对照组;2:常氧组;3:缺氧组。
图1缺氧24h后各组MCF-7细胞中HIF-2α蛋白的表达情况(Westernblot)
FigExpressionofHIF-2αproteininMCF-7cellsafterhypoxiafor24hineachgroup(Westernblot)
2.3缺氧组和常氧组人低转移乳腺癌MCF-7细胞对化学治疗药物敏感性比较结果见表1。缺氧组紫杉醇、阿霉素及氟尿嘧啶的IC50显著高于常氧组,差异有统计学意义(t=5.942、16.083、18.413,P<0.05)。

表1 常氧组和缺氧组紫杉醇、阿霉素及氟尿嘧啶的IC50比较
注:与常氧组比较aP<0.05。
2.4化学治疗药物在缺氧组和常氧组人低转移乳腺癌MCF-7细胞内蓄积和潴留的比较结果见表2。与常氧组比较,缺氧组人低转移乳腺癌MCF-7细胞内阿霉素的蓄积和潴留显著降低(t=4.664、12.416,P<0.05),药物泵出率显著增高(t=3.984,P<0.05)。

表2 化学治疗药物在常氧组和缺氧组MCF-7细胞内蓄积、潴留和泵出率比较
注:与常氧组比较aP<0.05。
2.5化学治疗药物诱导缺氧组和常氧组人低转移乳腺癌MCF-7细胞凋亡的比较结果见图2。未经阿霉素诱导,常氧组和缺氧组人低转移乳腺癌MCF-7细胞凋亡指数分别为(7.30±0.42)%和(6.20±0.55)%,2组细胞凋亡指数比较差异无统计学意义(t=2.713,P>0.05)。阿霉素诱导下,缺氧组和常氧组人低转移乳腺癌MCF-7细胞凋亡指数分别为(68.50±0.93)%和(93.50±0.65)%,缺氧组人低转移乳腺癌MCF-7细胞凋亡指数低于常氧组,差异有统计学意义(t=35.062,P<0.05)。

图2 流式细胞术检测常氧和缺氧状态下阿霉素诱导人低转移乳腺癌MCF-7细胞的凋亡情况
3 讨论
乳腺癌是严重威胁妇女健康的重大疾病,近年来发病率逐年上升。乳腺癌的治疗仍以外科手术为主,对于中晚期患者,以阿霉素等为基础的化学治疗方案成为常用的辅助治疗手段;然而,化学治疗失败并导致肿瘤复发的主要原因与肿瘤细胞内在耐药或获得性耐药有关[6]。目前,对于乳腺癌的多药耐药尚未找到有效的解决办法。多药耐药的发生机制非常复杂,主要包括多药耐药相关蛋白如乳腺癌耐药蛋白和P-糖蛋白等的过度表达;另外,抗凋亡基因c-myc和Bcl-2等过度表达,细胞内酶系统如谷胺酰转肽酶和拓扑异构酶等异常以及细胞修复系统增强都有可能引起细胞发生多药耐药[7-8]。
肿瘤的多药耐药是临床新辅助化学治疗遇到的主要难题,是许多化学治疗方案失败的主要原因之一。研究发现,在缺氧条件下肿瘤细胞对阿霉素等化学治疗药物产生了不同程度的耐药性[9-10]。缺氧的喉癌细胞对紫杉醇、阿霉素、氟尿嘧啶、顺铂和吉西他滨的敏感性显著上调[11]。缺氧增加了胰腺癌细胞抵抗二氟脱氧胞嘧啶核苷诱导凋亡的能力[12]。而CoCl2诱导神经胶质瘤细胞缺氧,能够增加神经胶质瘤细胞对卡莫司汀的抵抗能力[13]。
本课题组前期对HIF-2α与乳腺癌细胞多药耐药关系的研究中得知,缺氧状态下HIF-2α表达增加,增加了细胞内多药耐药基因的表达,使乳腺癌细胞出现了以基因水平改变为基础的获得性耐药[3],但低氧微环境引起肿瘤细胞对化学治疗药物耐药的机制尚不清楚。本研究发现,CoCl2诱导人低转移乳腺癌MCF-7细胞缺氧后,显著降低了细胞对紫杉醇、阿霉素、氟尿嘧啶等药物的敏感性。Annexin V/PI染色法检测缺氧状态下化学治疗药物诱导人低转移乳腺癌MCF-7细胞的凋亡情况,结果显示,缺氧降低了化学治疗药物诱导的乳腺癌细胞凋亡。流式细胞术检测缺氧状态下人低转移乳腺癌MCF-7细胞内化学治疗药物阿霉素的蓄积和潴留情况,结果显示,在人低转移乳腺癌MCF-7细胞中药物蓄积和潴留明显降低,药物泵出率明显增高,本研究结果与相关文献报道结果一致[14-15]。这一发现为乳腺癌细胞多药耐药机制的研究提供了理论基础和未来的研究方向。
综上所述,缺氧是乳腺癌出现多药耐药的原因之一,缺氧诱导乳腺癌细胞出现多药耐药可能与缺氧状态下HIF-2α在细胞内的表达增加并能够降低化学治疗药物的潴留和蓄积有关;另外,化学治疗药物诱导的细胞凋亡减少也可能与其有关。本实验结果为临床上逆转乳腺癌细胞多药耐药、改善患者预后提供了新的思路,但其机制尚不十分清楚,有待于进一步研究。

