肺炎支原体对支气管上皮细胞黏蛋白分泌的影响
范改焕,禹香菊,赵宪文
(郑州市第九人民医院检验科,河南 郑州 450053)
肺炎支原体是呼吸道感染常见的病原体,也是儿童社区获得性肺炎的重要病原体之一[1-2]。研究显示,肺炎支原体感染是诱发慢性阻塞性肺疾病和支气管哮喘的主要因素[3],目前,肺炎支原体引起呼吸道疾病的确切机制尚不清楚。黏蛋白是一类主要由黏多糖组成的糖蛋白,在生物体中起润滑、化学屏障及细胞信号通路的作用。临床研究表明,黏蛋白过表达可诱导破坏支气管和肺实质结构,是引发支气管炎、慢性阻塞性肺疾病等的重要因素[4]。目前,关于肺炎支原体感染对支气管上皮细胞黏蛋白分泌影响的研究尚未见报道。黏蛋白5AC(mucins 5 ac,MUC5AC)和黏蛋白5B(mucins 5 b,MUC5B)是黏蛋白家族的重要成员,本研究通过探讨肺炎支原体对支气管上皮细胞MUC5AC、MUC5B分泌的影响,旨在为肺炎支原体感染导致呼吸道疾病的病理机制研究提供参考。
1 材料与方法
1.1菌株与细胞肺炎支原体标准菌株购自中国科学院细胞库,人支气管上皮细胞(human bronchial epithelial cell,HBEC)购自上海子实生物科技有限公司。
1.2主要试剂与仪器胸膜炎微生物(pleuropneumonia-like organism,PPLO)液体培养基购自上海广锐生物科技有限公司,人支气管上皮细胞培养基(human tracheo bronchial epithelial cells,BGEM)购自上海康朗生物科技有限公司,总RNA抽提试剂购自美国赛默飞世尔科技公司,反转录试剂盒购自宝生物工程(大连)有限公司,Synergy Brands(SYBR)荧光染料购于美国Sigma公司,二喹啉甲酸(bicinchoninic acid,BCA)蛋白质检测试剂盒购自上海翊圣生物科技有限公司,蛋白酶抑制剂购自瑞士罗氏公司,信息转导与转录激活因子 3 (signal transducer and activator of transcription 3,STAT3)抑制剂IX Cpd188购自北京智杰方远科技有限公司,STAT6抑制剂山柰酚购自上海宝曼生物科技有限公司,表皮生长因子受体(epidermal growth factor receptor,EGFR)抑制剂AG1478购自厦门研科生物技术有限公司,细胞裂解液购自上海邦奕生物科技有限公司,MUC5B免疫小鼠抗体、MUC5AC、叉头框蛋白A2(forkhead box protein A2,FOXA2)免疫兔抗体、Alexa Fluor 488标记山羊抗小鼠免疫球蛋白G(immunoglobulin G,IgG)、Alexa Fluor 647标记山羊抗兔IgG、IRDye 680RD标记驴抗鼠IgG均购自北京奥威亚生物技术有限公司,4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)购自杭州佐正生物科技有限公司,生长因子购自南京金斯瑞生物科技有限公司;激光共聚焦显微镜购自德国蔡司股份公司,Odyssey®红外成像系统购自美国LICOR公司,荧光定量聚合酶链式反应(fluorescence quantitative polymerase chain reaction,FQ-PCR)仪和5424R冷冻离心机购自德国艾本德公司。
1.3肺炎支原体的培养取肺炎支原体接种于PPLO液体培养基,于37 ℃生物化学培养箱中培养,肉眼观察培养液变为黄色时,更换培养基继续传代培养。以液体变黄时的最高稀释度作为颜色改变单位(colour change unit,CCU),肺炎支原体测量浓度以CCU·L-1为单位,取1×109CCU·L-1肺炎支原体进行下一步实验。
1.4HBEC培养及分组取单层贴壁生长、融合率约为60%的HBEC接种至5 mL含有生长因子的BGEM中,于37 ℃、含体积分数5%CO2的培养箱中培养,当细胞融合度>80%后,使用2.5 g·L-1胰蛋白酶消化,更换培养液继续传代培养。取对数生长期细胞,按每孔3×105个细胞接种于6孔板上,并将细胞分为2组:一组将预先培养好的肺炎支原体按照感染复数(multiplicity of infection,MOI)为50接入细胞培养孔中感染细胞,作为感染组;另一组未接种肺炎支原体,作为对照组。MOI =有感染力的支原体数/待感染细胞数。本研究中MOI由预实验确定。
1.5免疫荧光标记法检测HBEC中MUC5B和MUC5AC的表达取感染组和对照组细胞继续培养48 h,弃上清液,磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤3次,每次 5 min。40 g·L-1多聚甲醛固定30 min,PBS洗涤。分别加入MUC5B免疫小鼠抗体和MUC5AC免疫兔抗体一抗,放入 37 ℃ 生物化学培养箱中孵育 2 h,PBS洗涤3次,每次5 min。避光条件下加入Alexa Fluor 488标记山羊抗小鼠IgG和Alexa Fluor 647标记山羊抗兔IgG,避光孵育1.5 h后,PBS洗涤3次,每次5 min;加入DAPI染核30 min,PBS洗涤3次,每次5 min,加入PBS缓冲液重悬,应用激光共聚焦显微镜检测细胞中MUC5AC和MUC5B的荧光信号,采用免疫荧光标记法观察感染组和对照组细胞中MUC5AC和MUC5B的表达情况。出现绿色荧光信号为MUC5B阳性表达,红色荧光信号为MUC5AC阳性表达。
1.6FQ-PCR检测2组细胞中MUC5B、MUC5AC、叉头框蛋白A2(FOXA2)、STAT3、STAT6、EGFRmRNA表达收集感染组和对照组对数生长期细胞,参照总RNA抽提试剂说明书提取细胞总RNA,根据反转录试剂盒说明书,将提取的总RNA反转录为cDNA。反应体系为:上、下游引物各0.5 μL,cDNA 1 μL,无RNA酶水8 μL,2×SYBR 10 μL,轻弹混匀,放入冷冻离心机中1 000 r·min-1离心1 min,注意加入反应体系时均需置于冰上,2×SYBR于避光条件下加入反应体系。反应程序:95 ℃ 预变性3 min,95 ℃变性15 s,60 ℃退火20 s,72 ℃延伸10 s,共35个循环;末次延伸 5 min。每个样品设3个复孔。以磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GADPH)为内参,检测2组细胞中MUC5B、MUC5AC、FOXA2、STAT3、STAT6、EGFR的mRNA表达情况。MUC5B上游引物序列为5′-CTGAATTCGATGGTGGACAGGA-3′,下游引物序列为5′-GAACGACAGTGGTGGCCGGTGA-3′;MUC5AC上游引物序列为5′-GATGGATTGGTGAACAGA-3′,下游引物序列为5′-TTGGCTTGAGATTGGTGGGTA-3′;FOXA2上游引物序列为5′-GATGTCACCGATATACCTT-3′,下游引物序列为5′-GGTACCACCACAGAGACGCG-3′;STAT3上游引物序列为5′-CGTAACGGGTAATAGAGCACTG-3′,下游引物序列为5′-CACACCCGCGTCTTGTATAAAG-3′;STAT6上游引物序列为5′-GGACTTGAAGACACGAGGCG-3′,下游引物序列为5′-CACACTCGATCAATGTGGTGAAAG-3′;EGFR上游引物序列为5′-CTAAGAATCACACCTTGATGTAAAG-3′,下游引物序列为5′-TGCCTCATGAGTGCATGCCGTGTAG-3′;GAPDH上游引物序列为5′-GATTGAGAACGTAGCTAGGGGAA-3′,下游引物序列为5′-ATTGAGCTATATTACCGTTCCACC-3′。结果以2-ΔΔCt法进行计算。
1.7Westernblot法检测2组细胞中MUC5B、MUC5AC、FOXA2、磷酸化STAT3(phospho-STAT3,p-STAT3)、磷酸化STAT6(phospho-STAT6,p-STAT6)、磷酸化EGFR(phospho-EGFR,p-EGFR)蛋白表达收集感染组和对照组对数生长期细胞,用含有蛋白酶抑制剂的细胞裂解液处理细胞,提取细胞总蛋白。使用BCA蛋白浓度检测试剂盒检测提取蛋白浓度。利用聚丙烯酰胺凝胶电泳分离目的蛋白,转膜,牛血清白蛋白封膜,4 ℃过夜,PBS洗涤。分别加入PBS稀释的MUC5B、MUC5AC、FOXA2、STAT3、STAT6、EGFR抗体一抗(稀释比例1200),4 ℃孵育过夜,PBS洗涤。分别加入稀释后的IRDye 680RD标记驴抗鼠IgG(稀释比例110 000),室温孵育2 h,PBS洗涤。利用Odyssey®红外成像系统对膜进行扫描,Image-Pro Plus分析2组细胞中MUC5B、MUC5AC、FOXA2、p-STAT3、p-STAT6、p-EGFR蛋白表达情况。p-STAT3、p-STAT6、p-EGFR分别为STAT3、STAT6和EGFR的磷酸化形式。
1.8Westernblot法检测IXCpd188、山柰酚、AG1478预处理后细胞中MUC5B、MUC5AC、FOXA2蛋白表达取对数生长期HBEC,分别加入STAT3、STAT6、EGFR的抑制剂 IX Cpd188、山柰酚、AG1478各10 μmol,孵育2 h,将细胞按“1.4项”中方法接种肺炎支原体。同时取“1.4项”中对数生长期的感染组和对照组细胞,分别加入PBS进行预处理,继续培养16 h后,收集细胞,采用Western blot法检测各组细胞中MUC5B、MUC5AC、FOXA2的表达情况。

2 结果
2.1感染组与对照组细胞中MUC5B、MUC5AC、FOXA2表达水平比较结果见表1和图1、图2。感染组细胞中MUC5B和MUC5AC荧光信号较对照组明显增强。FQ-PCR结果显示,感染组细胞中MUC5B、MUC5AC mRNA相对表达量显著高于对照组(P<0.05),FOXA2 mRNA相对表达量显著低于对照组(P<0.05)。Western bolt结果显示,感染组细胞中MUC5B和MUC5AC蛋白相对表达量显著高于对照组(P<0.05),FOXA2蛋白相对表达量显著低于对照组(P<0.05)。

表1 2组HBEC中MUC5B、MUC5AC及FOXA2 mRNA及蛋白相对表达量比较

图1 2组HBEC中MUC5B和MUC5AC表达情况(免疫荧光法,×100)

图2 2组HBEC中MUC5B、MUC5AC和FOXA2蛋白的表达(Western blot)
2.2感染组与对照组细胞中STAT3、STAT6和EGFR的mRNA及p-STAT3、p-STAT6和p-EGFR蛋白表达比较结果见图3和表2。感染组细
胞中STAT3、STAT6和EGFR mRNA相对表达量显著高于对照组(P<0.05);感染组细胞中p-STAT3、p-STAT6和p-EGFR蛋白相对表达量高于对照组(P<0.05)。
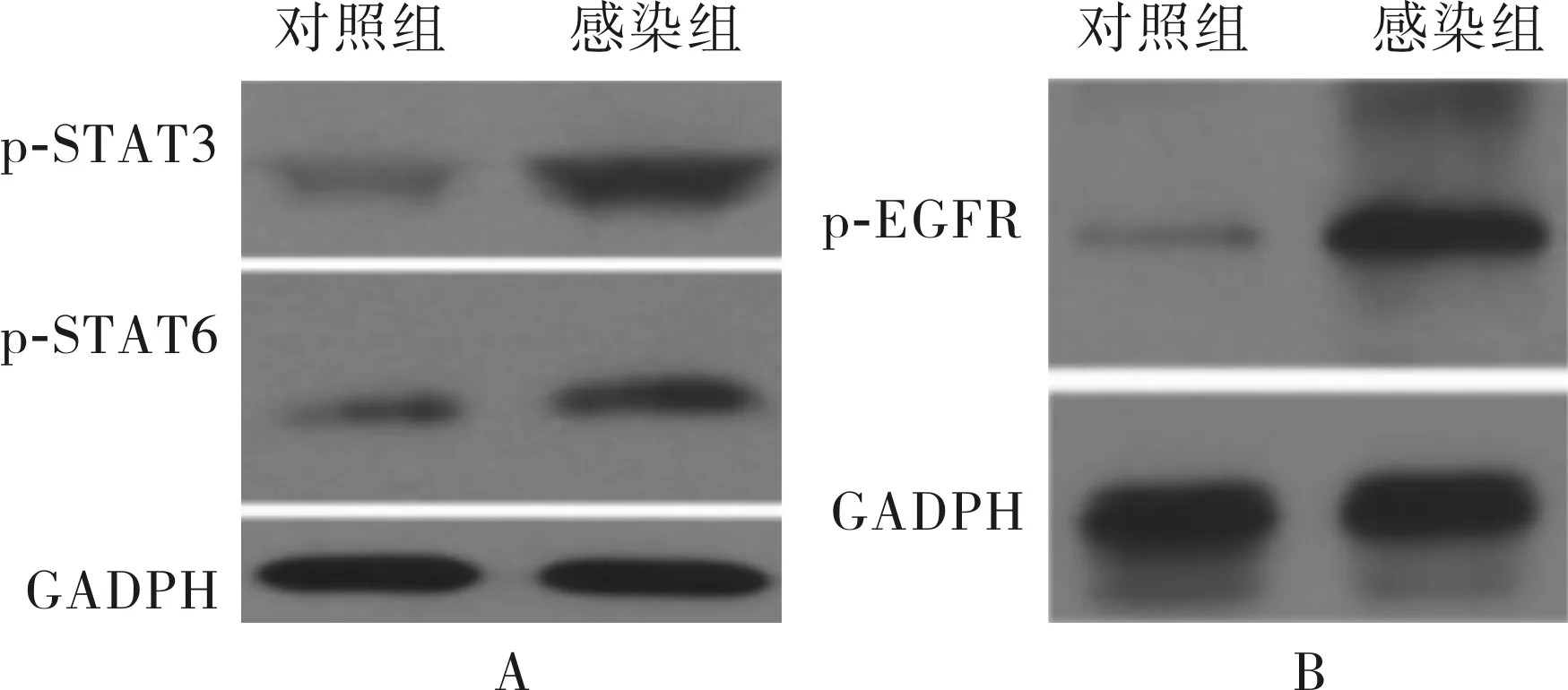
A:p-STAT3、p-STAT6蛋白相对表达量;B:p-EGFR蛋白相对表达量。
2.3IXCpd188、山柰酚、AG1478预处理后各组细胞中FOXA2、MUC5B和MUC5AC蛋白表达水平比较结果见表3和图4、图5。感染组及IX Cpd188、山柰酚、AG1478预处理组细胞中FOXA2蛋白相对表达量均显著低于对照组(P<0.05),而IX Cpd188、山柰酚、AG1478预处理组细胞中FOXA2蛋白相对表达量均显著高于感染组(P<0.05)。感染组及IX Cpd188、山柰酚、AG1478预处理组细胞中MUC5B蛋白相对表达量显著高于对照组(P<0.05);与感染组比较,IX Cpd188、山柰酚、AG1478预处理细胞中MUC5B、MUC5AC蛋白相对表达量均显著降低(P<0.05)。

表2 2组HBEC中STAT3、STAT6、EGFR mRNA及p-STAT3、p-STAT6、p-EGF蛋白相对表达量比较

表3 STAT3、STAT6和EGFR抑制后HBEC中MUC5B、MUC5AC、FOXA2蛋白表达水平
注:与对照组比较aP<0.05;与感染组比较bP<0.05。
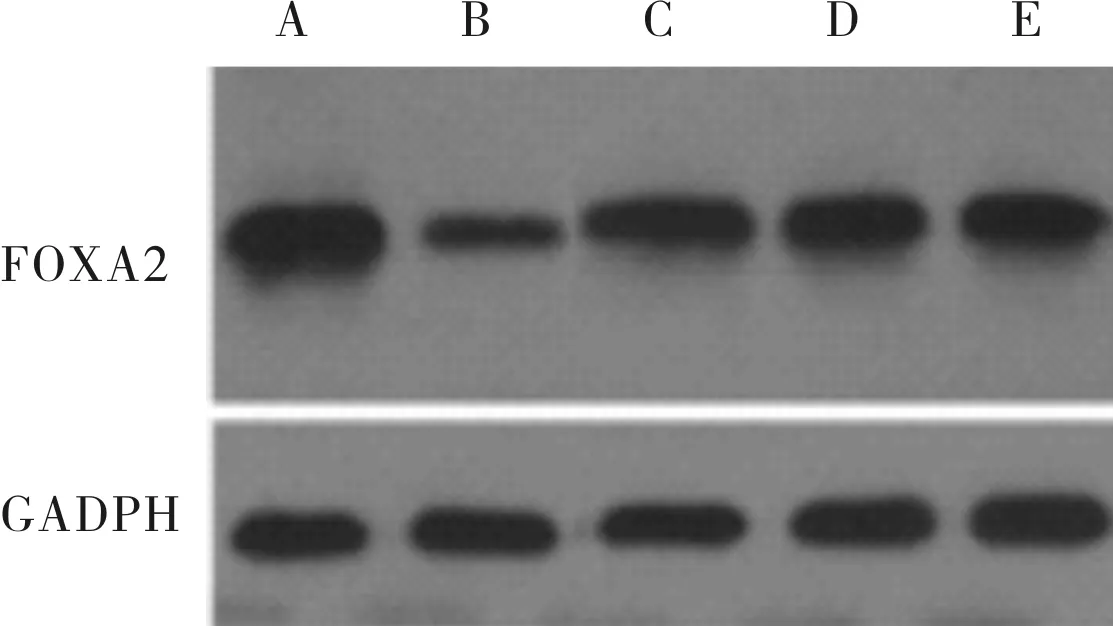
A:对照组;B:感染组;C:IX Cpd188预处理组;D:山柰酚预处理组;E:AG1478预处理组。
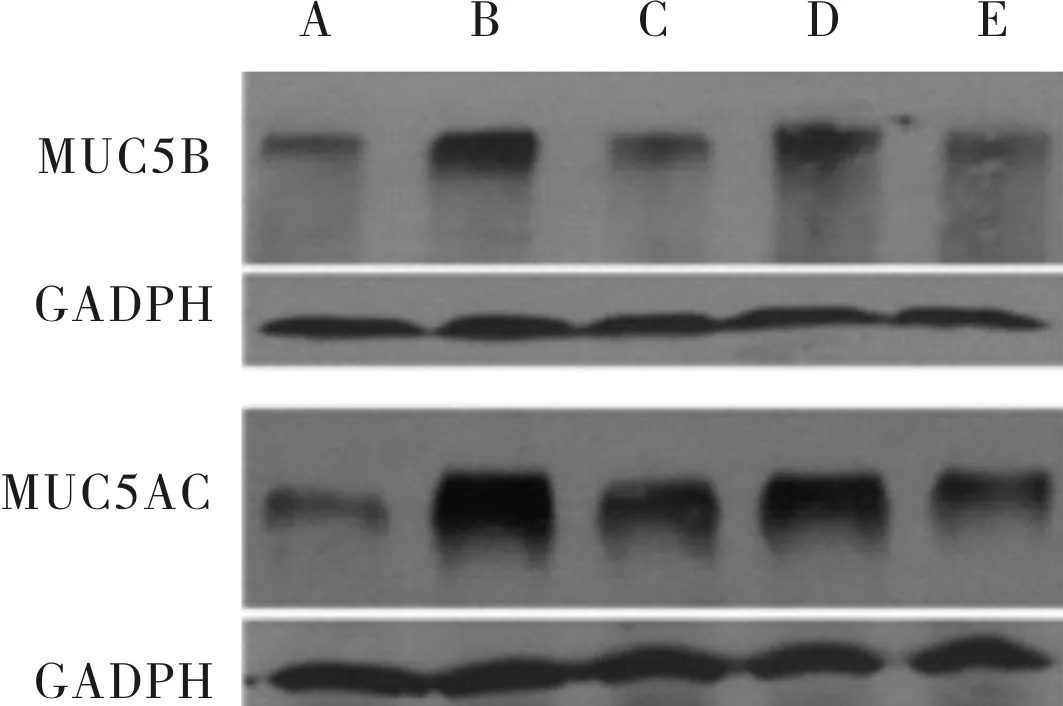
A:对照组;B:感染组;C:IX Cpd188预处理组;D:山柰酚预处理组;E:AG1478预处理组。
3 讨论
肺炎支原体属无细胞壁原核微生物[5],可存活于无生命培养基中。研究发现,肺炎支原体不仅可引起呼吸道炎症,还可导致脑炎、贫血、哮喘等疾病[6]。据报道,支气管肺炎及支气管哮喘患者发病期间支气管上皮细胞黏蛋白分泌异常增加[7-8]。黏蛋白是呼吸道黏液的重要组成部分,其构成中包括丰富的丝氨酸和苏氨酸,通过羟基侧链连接形成寡糖,通过二硫键进行连接,构成聚合体,使呼吸道黏液具有黏着特点[9-10]。研究表明,病原体、粉尘、化学物质等刺激呼吸道均可引起呼吸道黏液分泌增多[11-12]。目前,已知的黏蛋白有20多种,根据其结构差别可大致分为分泌型和膜结合型,其中MUC5B和MUC5AC属于上皮细胞中主要的分泌型黏蛋白[13-14]。检测肺炎支原体感染后HBEC中MUC5B和MUC5AC的表达,探讨其可能影响机制,对阐明肺炎支原体感染引起支气管疾病的病理机制具有重要意义。
FOXA2是一种转录因子,其能够通过绑定DNA调节靶基因的表达,在多种内脏器官的分化和发育中发挥重要作用[15]。 研究表明,支气管哮喘和支气管扩张等疾病与FOXA2表达量呈负相关,FOXA2表达增加能抑制MUC5AC表达而缓解支气管上皮细胞反应[16]。因此,推测肺炎支原体引起支气管上皮细胞中MUC5B和MUC5AC过表达的同时,会抑制FOXA2的表达。本研究结果显示,感染组细胞中FOXA2 mRNA和蛋白表达量显著低于对照组,提示感染组支气管上皮细胞中FOXA2转录和翻译水平均受到抑制。有研究显示,c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)-STAT6-FOXA2信号通路对黏蛋白具有调节作用,STAT3、STAT6表达下调可促进FOXA2的表达,导致 MUC5AC启动子受到抑制[17-18]。本研究结果显示,感染组中STAT3和STAT6的表达量显著高于对照组。另外,肺炎支原体脂质膜相关蛋白具有活化STAT3的作用,而活化的STAT3具有促进黏蛋白分泌的作用[19-20]。因此,推测肺炎支原体感染HBEC可引起STAT3和STAT6表达升高,FOXA2表达降低,促进黏蛋白分泌,从而导致呼吸道疾病发生。
EGFR是一种跨膜蛋白,可与配体结合激活多种信号通路,促进特异基因进行转录[21-22],包括JAK激酶-STAT3信号途径和STAT3活化。有报道称,EGFR对鼻黏膜上皮细胞中MUC5AC的表达具有调节作用[23]。文道林等[24]研究发现,支原体巨噬细胞活化脂肽-2可通过EGFR及基质金属蛋白酶9表达量增加诱导呼吸道上皮细胞分泌MUC5AC。本研究对各组细胞中EGFR的表达量进行检测,结果显示,与对照组相比,感染组细胞中EGFR表达量显著上升,与MUC5B和MUC5AC表达量一致。有研究表明,肺炎支原体感染的支气管上皮细胞中STAT3表达量上升是受到EGFR表达量影响的结果[24]。为进一步证明STAT3、STAT6、EGFR通过FOXA2调节黏蛋白的分泌作用,本研究分别利用STAT3、STAT6、EGFR的抑制剂IX Cpd188、山柰酚、 AG1478对感染肺炎支原体的支气管上皮细胞进行预处理,利用Western blot法检测FOXA2的表达情况,结果显示,经抑制剂预处理的支气管上皮细胞中FOXA2的表达量较未处理的感染肺炎支原体的支气管上皮细胞均显著上升,而MUC5B和MUC5AC表达量显著下调,这说明抑制STAT3、STAT6、EGFR表达能够抑制肺炎支原体感染引起的支气管上皮细胞黏蛋白分泌增加。
本研究利用肺炎支原体感染人支气管上皮细胞,分析肺炎支原体对支气管上皮细胞黏蛋白的影响,荧光显微镜观察显示,感染组细胞中的MUC5B和MUC5AC荧光信号较对照组明显增强。为进一步确认,本研究又通过Western blot和FQ-PCR对MUC5B和MUC5AC在支气管上皮细胞中的表达进行检测,结果显示,感染组细胞中MUC5B、MUC5AC mRNA和蛋白表达量均显著高于对照组,与荧光显微镜观察结果一致。本研究结果证明,肺炎支原体感染会导致支气管上皮细胞中黏蛋白异常增加。
综上所述,本研究证实肺炎支原体感染可能通过促进STAT3、STAT6、EGFR表达上调,抑制FOXA2表达,从而导致支气管上皮细胞黏蛋白MUC5B和MUC5AC表达升高,即通过STAT / EGFR-FOXA2信号通路促进支气管上皮细胞黏蛋白分泌,引发呼吸道相关疾病。肺炎支原体致病机制极其复杂,且黏蛋白分泌的具体调节机制尚不清楚,因此,肺炎支原体调节STAT3、STAT6、EGFR表达的具体机制还有待进一步探索。

