miRNA-505-3p在原发性高血压发病机制中的作用
成 力,陈文江,姚 峰,李小庆
(1.陆军军医大学附属第二医院心血管内科,重庆 400037;2.重庆医科大学附属第二医院心血管内科,重庆 400010;3.广东医科大学附属医院心血管内科,广东 湛江 524000)
近年来,我国心血管疾病患病率持续上升,据有关调查报告显示,目前,我国心血管疾病患者约2.9 亿,其中高血压患者2.7 亿,且我国每年因高血压而死亡的人数高达200万[1-2]。由此可见,高血压已成为我国重大的公共卫生问题。原发性高血压(essential hypertension,EH)是最常见的慢性非传染性疾病,也是心血管疾病的重要危险因素之一,其发病机制与遗传(单基因遗传与基因多态性)、环境(包括高盐饮食、吸烟、应激等)、神经机制(交感神经兴奋)、激素机制(肾素-血管紧张素-醛固酮系统)、肾脏机制、血管机制(内皮细胞功能障碍、钙化、炎症)和胰岛素抵抗等有关[3-6]。研究发现,微小RNA(microRNA,miRNA)与EH的发病机制有关[7-8],miR-296-5p、 miR-let-7e、miR-23b、miR-130a、miR-191、miR-451、miR-1246、miR-26a、miRNA-150等[9-13]可能参与EH的发病机制。有研究发现,miRNA-505-3p可能通过影响血管内皮细胞的迁移及血管形成而参与EH的发病,但其结果仍存在一定的争议。因此,本研究旨在探讨miRNA-505-3p与EH的发病机制的关系,为EH的防治提供理论依据。
1 材料与方法
1.1标本来源选择2014年5~8月于陆军军医大学附属第二医院心血管内科收治的EH患者作为研究对象,病例纳入标准:年龄>18 岁,并符合EH诊断标准[14];排除标准:恶性高血压、严重肝肾功能不全、恶性肿瘤及妊娠或哺乳期妇女。该研究共纳入EH患者60例,男35例,女25例;年龄40~70(61.55±1.17)岁;既往史:吸烟史30例,冠状动脉粥样硬化性心脏病史21例,糖尿病15例,心房颤动11例;血压:收缩压140~186(167.6±8.4)mmHg(1 mmHg=0.133 kPa),舒张压65~110(95.7±10.8)mmHg;血清肌酐(92.46±19.24)μmol·L-1,血糖(5.493±0.203)mmol·L-1,总胆固醇(4.358±0.183)mmol·L-1,三酰甘油(1.437±0.087)mmol·L-1,高密度脂蛋白(1.355±0.088)mmol·L-1,低密度脂蛋白(2.956±0.143)mmol·L-1。另选择同时期陆军军医大学附属第二医院心血管内科收治的非EH患者作为对照,病例纳入标准:年龄> 18 岁,收缩压<140 mmHg,舒张压<90 mmHg;排除标准:严重肝肾功能不全、恶性肿瘤及妊娠或哺乳期妇女。该研究共纳入非EH患者60例,男40例,女20例;年龄38~70(58.28±1.64)岁;既往史:吸烟史25例,冠状动脉粥样硬化性心脏病史18例,糖尿病10例,心房颤动8例;血压:收缩压90~138(105.6±3.1)mmHg,舒张压50~88(78.5±6.8)mmHg;血清肌酐(79.99±3.21)μmol·L-1,血糖(5.689±0.231)mmol·L-1,总胆固醇(4.647±0.179)mmol·L-1,三酰甘油(1.281±0.071)mmol·L-1,高密度脂蛋白(1.325±0.055)mmol·L-1,低密度脂蛋白(2.572±0.154)mmol·L-1。EH患者与非EH患者的性别、年龄、既往史、血清肌酐、血糖及血脂水平比较差异均无统计学意义(P>0.05),具有可比性。所有入选者于入院后6 h内采集静脉血2 mL,4 ℃下3 000 r·min-1离心10 min,分离血浆,-80 ℃下保存备用。
1.2细胞、试剂与仪器人主动脉平滑肌细胞(human aortic smooth muscle cells,HASMC)购自美国Sciencell公司,平滑肌细胞培养基(smooth muscle cell medium,SMCM)、miRcute miRNA提取分离试剂盒、miRcute增强型miRNA荧光定量检测试剂盒购自天根生化科技(北京)有限公司,TRIzol总RNA抽提试剂、反转录试剂盒、实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)试剂盒、细胞计数试剂盒-8(cell counting kit-8,CCK-8)、胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)一抗(稀释比例1600)和二抗(稀释比例12 000)、内参β-actin(稀释比例11 000)购自苏州碧云天生物技术公司,has-miRNA-505-3p的micrON®miRNA mimic和mimic control、转染试剂(ribo FECTTMCP transfection kit)购自广州锐博生物科技有限公司,酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒购自深圳柏万森生物科技有限公司;PCR扩增仪购自德国Eppendor公司,LightCycler480II全自动荧光定量PCR仪购自瑞士Roche公司。
1.3实验方法
1.3.1实时荧光定量PCR检测EH患者与非EH患者血浆miRNA-505-3p表达入选人群血浆的miRNA提取采用miRcute miRNA提取分离试剂盒,提取的miRNA经过其配套miRcute miRNA cDNA第1链合成试剂盒反转录为cDNA,然后配合其miRcute miRNA SYBR Green荧光定量检测试剂盒及试剂盒中的下游引物进行荧光定量验证。miRNA-505-3p上游引物序列为5′-GCGAGCACCGTCAACACTTG-3′,下游引物序列为5′-TGCAGGGTCTGACTTATT-3′;内参U6上游引物序列为5′-CTCGCTTCGGCAGCACA-3′,下游引物序列为5′-AACGCTTCACGAATTTGCGT-3′。上机条件:94 ℃变性2 min,94 ℃变性20 s,60 ℃退火、延伸34 s;共30个循环。采用2-ΔCt相对定量方法进行数据分析:ΔCt(实验组)=Ct(实验组目标基因)-Ct(实验组内参基因);ΔCt(对照组)=Ct(对照组目标基因)-Ct(对照组内参)。
1.3.2miRNA-505-3p生物信息学预测和分析采用targetScan、picTar、RNA22、PITA和miRanda生物信息学在线软件预测miRNA-505-3p的靶基因,初步了解其生物学功能。在靶基因预测时,将至少有上述4个在线软件预测得到一致结果的靶基因作为候选基因,达到条件的靶基因主要有36个,包括IGF-1、IGF-1R、MAP3K3、BCL11B、MAP2K4、LRRFIP1、CPEB2、COL3A1、NHEJ1、SON、ZNF292、PBX3、CMIP、SPTY2D1、EYA1、FMR1、CADM1、VAPA、C12orf23、ATP2B1等。从预测结果可知,miRNA-505-3p可能主要调控IGF-1靶基因。因此,本研究将IGF-1作为候选基因进行进一步验证。
1.3.3ELISA法检测EH患者与非EH患者血浆IGF-1水平将所获取的患者血浆按照IGF-1的ELISA试剂盒说明书对血浆中的IGF-1进行检测,观察其表达情况,ELISA标准曲线R2值大于0.99。
1.3.4细胞培养、转染及分组其培养采用配套专用培养基SMCM进行培养、传代,于培养箱(37 ℃,含体积分数5%CO2和20%O2)中进行培养,采用第4~8代细胞进行实验,本实验主要采用96孔板和6孔板进行实验。设置mimic组(转染miRNA-505-3p mimic序列)、mimic对照组(转染mimic对照序列)和空白对照组(不进行转染),转染步骤:于6孔板接种细胞,当细胞融合度达到50%~70%时,先同步化6 h,将转染试剂与转染序列进行混合并加入,然后将6孔板置于37 ℃、含体积分数5%CO2的培养箱中培养 72 h,然后收集细胞及细胞培养液,用于后续实验。
1.3.5实时荧光定量PCR检测3组HASMC中miRNA-505-3p表达细胞转染后的miRNA提取采用miRcute miRNA提取分离试剂盒,提取的miRNA经过其配套miRcute miRNA cDNA第1链合成试剂盒反转录合成cDNA,然后配合其miRcute miRNA SYBR Green荧光定量检测试剂盒及试剂盒中的下游引物进行荧光定量验证。miRNA-505-3p上游引物序列为5′-GCGAGCACCGTCAACACTTG-3′,下游引物序列为5′-TGCAGGGTCTGACTTATT-3′;内参U6上游引物序列为5′-CTCGCTTCGGCAGCACA-3′,下游引物序列为5′-AACGCTTCACGAATTTGCGT-3′。所有实验方法均按照试剂盒说明书进行,上机条件:94 ℃ 变性2 min;PCR循环中模板94 ℃变性20 s;60 ℃退火、延伸34 s;共30个循环。本研究采用2-ΔCt相对定量方法进行数据分析:ΔCt(实验组)=Ct(实验组目标基因)-Ct(实验组内参基因);ΔCt(对照组)=Ct(对照组目标基因)-Ct(对照组内参)。
1.3.6实时荧光定量PCR检测3组HASMC中IGF-1mRNA表达用TRIzol总RNA抽提试剂按照说明书提取RNA(RNA吸光度值A260/A280在1.7~2.1)后按照反转录试剂盒说明书将所提取RNA进行反转录,然后将反转录所获取的cDNA模板按照实时荧光定量PCR试剂盒说明书进行荧光定量,其中,95 ℃预变性30 s,95 ℃扩增、延伸15 s,60 ℃退火30 s,共40个循环,以磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)作为内参。IGF-1上游引物序列为:GCTGGTGGATGCTCTTCAGT,下游引物序列为:TGTTGGTAGATGGGGGCTGA;GAPDH的上游引物序列为:TGCCCCCATGTTTGTGATG,下游引物序列为:TGTGGTCATGAGCCCTTCC。本研究采用2-ΔCt相对定量方法进行数据分析:ΔCt(实验组)=Ct(实验组目标基因)-Ct(实验组内参基因);ΔCt(对照组)=Ct(对照组目标基因)-Ct(对照组内参)。
1.3.7CCK-8检测3组HASMC活性将细胞接种于96孔板并转染,当细胞融合度达到30%~50%时先同步化6 h后再进行转染,转染后于37 ℃、含体积分数5%CO2的培养箱中培养24 h,每孔加入10 μL CCK-8溶液,在细胞培养箱内继续孵育2 h,然后在450 nm处测定吸光度。
1.3.8Westernblot法检测3组HASMC中IGF-1蛋白表达提取转染后72 h的3组细胞总蛋白,采用二喹啉甲酸法测量其蛋白浓度,继而进行蛋白电泳、转膜、IGF-1一抗(稀释比例1600)孵育、二抗孵育(稀释比例12 000)、杂交、显影、曝光,内参选用β-actin(稀释比例11 000)。结果分析用Image J图像分析软件计算条带灰度值,并以目的条带灰度值/内参条带灰度值进行统计分析。

2 结果
2.1EH患者与非EH患者血浆中miRNA-505-3p相对表达量比较EH患者与非EH患者血浆miRNA-505-3p相对表达量分别为0.156 5±0.025 9、0.007 9±0.001 4,EH患者血浆miRNA-505-3p相对表达量显著高于非EH患者,差异有统计学意义(t=6.880,P<0.01)。
2.2血浆miRNA-505-3p作为EH标志物的ROC曲线分析EH患者和非EH患者血浆miRNA-505-3p的ROC曲线分析结果见图1。ROC曲线下面积为0.988 1,95%可信区间为0.972 4~0.999 0(P<0.01)。

图1 血浆miRNA-505-3p作为EH标志物的 ROC
2.3EH患者与非EH患者血浆中IGF-1水平比较EH患者和非EH患者血浆中IGF-1水平分别为(1 338.03±96.92)、(620.90±23.19)ng·L-1,EH患者血浆中IGF-1水平显著高于非EH患者,差异有统计学意义(t=7.101,P<0.01)。
2.43组HASMC活性比较mimic组、mimic对照组和空白对照组HASMC活性分别为0.679 7±0.032 8、0.471 0±0.024 5和空白对照组0.525 2±0.035 3;mimic组HASMC活性显著高于mimic对照组和空白对照组,差异均有统计学意义(t=6.201、4.610,P<0.05);mimic对照组与空白对照组HASMC活性比较差异无统计学意义(t=1.432,P>0.05)。
2.53组HASMC中miRNA-505-3p及IGF-1mRNA表达水平比较mimic组、mimic对照组和空白对照组HASMC中miRNA-505-3p相对表达量分别为0.693 3±0.022 9、0.020 6±0.000 8、0.023 8±0.001 1;mimic组HASMC中miRNA-505-3p相对表达量显著高于mimic对照组和空白对照组,差异有统计学意义(t=7.991、5.840,P<0.01);mimic对照组与空白对照组HASMC中miRNA-505-3p相对表达量比较差异无统计学意义(t=0.323,P>0.05)。mimic组、mimic对照组和空白对照组HASMC中IGF-1 mRNA相对表达量分别为0.238 6±0.013 3、0.082 4±0.004 0、0.079 7±0.004 7;mimic组HASMC中IGF-1 mRNA相对表达量显著高于mimic对照组和空白对照组,差异有统计学意义(t=16.903、18.240,P<0.01);mimic对照组与空白对照组HASMC中IGF-1 mRNA相对表达量比较差异无统计学意义(t=0.295,P>0.05)。
2.63组HASMC中IGF-1蛋白表达水平比较结果见图2。mimic组、mimic对照组和空白对照组HASMC中IGF-1蛋白相对表达量分别为0.602 0±0.017 3、0.040 3±0.006 2、0.051 6±0.001 0;mimic 组HASMC中IGF-1蛋白相对表达量显著高于mimic对照组和空白对照组,差异有统计学意义(t=29.026、31.557,P<0.01);mimic对照组与空白对照组HASMC中IGF-1蛋白相对表达量比较差异无统计学意义(t=0.516,P>0.05)。
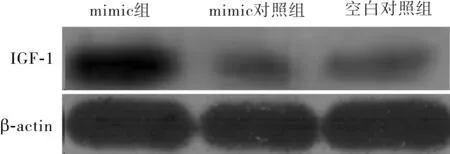
图2 3组HASMC中IGF-1蛋白表达(Western blot)
3 讨论
EH已经成为严重危害人类健康的疾病,目前,通过生活方式干预和药物治疗,其防治已经取得了显著效果;然而,由于患者依从性等问题,探讨EH的发病机制及诊断和治疗方法仍然很重要[15]。miRNA是一类由18~25个核苷酸组成的非编码单链小分子RNA,具有表达时序性、序列严格保守性、组织器官表达量相对特异性等特点,在细胞分化、生物发育及疾病发生、发展过程中发挥巨大作用[7,10,16]。近年来研究发现,血液、尿液等体液中含有循环miRNA(circulating miRNA,cmiRNA),其可以作为新的疾病标志物。由于cmiRNA具有方便获取、易于研究等特点,其在最近几年逐渐成为疾病标志物及发病机制研究的热点[8,17-19]。miRNA-505-3p为miRNA的一种,其在肿瘤及心血管疾病中起重要作用[9]。本研究结果显示,EH患者血浆miRNA-505-3p相对表达量显著高于非EH患者,血浆miRNA-505-3p的ROC下面积为 0.988 1,95%可信区间为0.972 4~0.999 0;提示血浆miRNA-505-3p可以作为EH的生物标志物。虽然,EH的诊断和治疗较为简单,但是,高血压种类较多,血浆miRNA-505-3p检测可能对难治性高血压和特殊类型高血压的诊断和治疗具有重大意义。
目前,miRNA和EH关系的研究逐渐成为热点,而且研究重点逐渐发展到miRNA对其相应靶基因的调控水平[23-24]。本研究通过生物信息学软件预测发现,miRNA-505-3p的靶基因可能主要为IGF-1,并调控其相关信号通路。本研究结果显示,EH患者血浆中IGF-1水平显著高于非EH患者,提示miRNA-505-3p与IGF-1可能存在调控关系。HASMC转染实验结果显示,mimic组HASMC中miRNA-505-3p相对表达量显著高于mimic对照组和空白对照组,mimic对照组与空白对照组HASMC中miRNA-505-3p和IGF-1 mRNA相对表达量比较差异无统计学意义;提示miRNA-505-3p对IGF-1存在调控作用。
EH的病理生理过程主要涉及动脉中膜平滑肌细胞的增殖、迁移和炎症因子分泌等[25]。本研究结果显示,mimic组HASMC活性显著高于mimic对照组和空白对照组,mimic对照组与空白对照组HASMC活性比较差异无统计学意义;提示miRNA-505-3p可能与EH的发病机制有关。
综上所述,EH患者血浆中miRNA-505-3p表达上调,miRNA-505-3p可能通过调控IGF-1及其相关信号通路参与EH的发病机制,并且可以作为EH的生物标志物。然而,由于本研究的样本量较小,其具体机制还有待后续大样本实验来验证。miRNA与EH发病机制的研究为EH的防治开启了新方向,从而可能开辟新途径解决此类疾病临床诊治困难问题,但是还需要相关实验继续证明。

