干扰维生素D3上调蛋白1通过调控Shh影响高糖诱导的肾小管上皮细胞凋亡*
张明霞, 刘伦志, 向海燕, 谭千林
(湖北民族学院附属民大医院肾内科, 湖北 恩施 445000)
研究显示糖尿病的发病率呈现逐年上升的趋势,而糖尿病肾病作为一种并发症,严重威胁着人类的生命健康。在中国,糖尿病肾病已经成为引起肾衰竭的第二大原因,肾小球损伤和系膜细胞增生等是其主要的病理特点,而肾小球细胞损伤与肾组织功能异常有密切关系[1-3]。糖尿病肾病患者的肾组织中,肾小管上皮细胞大量凋亡,高糖(high glucose,HG)环境下的肾小管上皮细胞更容易发生凋亡[4]。维生素D3上调蛋白1(vitamin D3 up-regulated protein 1,VDUP-1)可以调控细胞的分化、增殖和凋亡等过程,是细胞维持内环境稳定的关键调控蛋白,其对自然杀伤细胞和气道上皮细胞等具有重要作用,VDUP-1还参与糖尿病、哮喘、乳腺癌和心绞痛等疾病的发生[5-8]。近年来的研究显示,糖尿病肾病肾组织中VDUP-1表达水平异常升高,并且在肾小管细胞中表达,与肾组织氧化损伤有关,可能参与糖尿病肾病发生,目前对于其在糖尿病肾病肾小管细胞凋亡中的作用及机制尚不清楚[9-10]。音猬因子(Sonic hedgehog, Shh)信号通路调控细胞凋亡,其关键调控蛋白Patched 1(Ptch1)、 Smoothened (Smo)、锌指蛋白Gli2和Shh在糖尿病肾病小鼠肾组织中表达下降,与肾小管上皮细胞凋亡有关,其参与多种基因调控肾小管上皮细胞凋亡过程[11]。为了明确VDUP-1对高糖环境下的肾小管上皮细胞凋亡的影响以及其是否通过Shh信号通路发挥作用,本研究通过体外细胞实验,运用RNA干扰技术下调VDUP-1的表达,为阐明糖尿病条件下的肾小管上皮细胞凋亡发生机制提供实验依据。
材 料 和 方 法
1 材料
人近端肾小管上皮细胞系HK-2购自于武汉细胞库;重组人Shh蛋白购自ACROBiosystems;VDUP-1 小干扰RNA (small interfering RNA, siRNA)和si-RNA control由山东维真生物公司构建;抗Smo和Shh单克隆抗体购自Abcam;抗Gli2和抗Ptch1单克隆抗体购自Proteintech;抗VDUP-1单克隆抗体购自Santa Cruz;辣根过氧化物酶标记的IgG购自CTS;ECL发光试剂盒Thermo;二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒购自索莱宝;caspase-3活性检测试剂盒和caspase-9活性检测试剂盒购自碧云天生物技术研究所;逆转录试剂盒、荧光定量PCR试剂盒购自TaKaRa;肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)含量检测试剂盒购自上海晶抗生物工程有限公司。VDUP-1 siRNA 的正义链为GAAACAAAUAUGAGUACAATT-3’,反义链为5’-UUGUACUCAUAUUUCUUUCCA-3’。siRNA control的正义链为5’-UUCUCCGAACGUGUCACGUTT-3’,反义链为5’-ACGUGACACGUUCGGCGAATT-3’。
2 方法
2.1实验分组 HK-2细胞培养于含10%胎牛血清、100 mg/L链霉素和1×105U/L青霉素的DMEM培养基(含5.5 mmol/L葡萄糖),用0.25%的胰蛋白酶消化传代,在37 ℃、5% CO2的培养箱中培养。HK-2细胞分为正常对照(normal)组、HG组、VDUP-1 siRNA组、siRNA control组、Shh组、VDUP-1 siRNA+HG组、Shh+HG组和VDUP-1 siRNA+Shh+HG组,其中:(1)normal组细胞为不做转染的HK-2细胞,在含有5.5 mmol/L葡萄糖的细胞培养液中培养;(2)HG组细胞为不做转染的HK-2细胞,在含有40 mmol/L葡萄糖的细胞培养液中培养;(3)VDUP-1 siRNA组细胞为转染VDUP-1 siRNA的HK-2细胞,在含有5.5 mmol/L葡萄糖的细胞培养液中培养;(4)siRNA control组细胞为转染siRNA阴性对照的HK-2细胞,在含有5.5 mmol/L葡萄糖的细胞培养液中培养;(5)Shh组细胞为不做转染的HK-2细胞,在含有5.5 mmol/L葡萄糖和48 μg/L重组Shh的细胞培养液中培养;(6)VDUP-1 siRNA+HG组细胞为转染VDUP-1 siRNA的HK-2细胞,在含有40 mmol/L葡萄糖的细胞培养液中培养;(7)Shh+HG组细胞为不做转染的HK-2细胞在含有40 mmol/L葡萄糖和48 μg/L重组Shh的细胞培养液中培养;(8)VDUP-1 siRNA+Shh+HG组细胞为转染VDUP-1 siRNA的HK-2细胞,在含40 mmol/L葡萄糖和48 μg/L重组Shh的细胞培养液中培养。HK-2在实验开始前12 h用不含血清的细胞培养液同步化处理。
2.2Real-time PCR检测高糖作用后细胞中VDUP-1表达 Normal组和HG组的细胞按照2.1中方法处理以后,培养48 h。将培养液吸除,用冰预冷的生理盐水洗涤后,加入1 mL的TRIzol,吹打裂解细胞。室温静置5 min,加入200 μL氯仿,旋涡混合15 s,在室温环境中放置5 min,4 ℃、12 000×g离心20 min,上层溶液为RNA水相层,吸取上层溶液,与500 μL的异丙醇混合后,在室温环境下静置10 min,4 ℃、12 000×g离心20 min,把上清吸除后,在沉淀中加入75%的乙醇溶液,洗涤3次。干燥后,用DEPC水溶解,检测A260/A280的比值介于1.8~2.0。逆转录合成cDNA, real-time PCR测定VDUP-1的mRNA水平,GAPDH为内参照。反应程序为: 95 ℃ 2 min; 95 ℃ 15 s、60 ℃ 60 s,共40个循环。VDUP-1的上游引物为5’-CCGTTAGGATCCTGGCTTGC-3’,下游引物为5’-GGCGCCTTGTACTCATATTTGTTTC-3’;GAPDH的上游引物为5’-CGGAGTCAACGGATTTGGTCGTAT-3’,下游引物为5’-AGCCTTCTCCATGGTGGTGAAGAC-3’。
2.3Western blot检测高糖作用后细胞中VDUP-1的表达 Normal组和HG组的细胞按照2.1中方法处理以后,培养48 h。将细胞培养液吸除后,加入提前冰预冷的PBS洗涤2次,加入细胞裂解液,混合后,放在冰上静置1 h,用细胞刮刀将细胞刮下,继续冰浴20 min。将液体转移到EP管中,在4 ℃、12 000×g离心20 min,把蛋白上清液吸取到另一EP管中。细胞蛋白浓度测定用BCA法,步骤参照BCA蛋白定量试剂盒。把蛋白样品与上样缓冲液混合变性后,加入到凝胶样品孔中后,在浓缩胶中用60 V电泳,在分离胶中用120 V电泳。取出凝胶,放在转移缓冲液中静置15 min,把PVDF膜放在甲醇溶液中浸泡10 min。4 ℃,120 mA转膜60 min,放在5%脱脂奶粉中孵育2 h。与抗VDUP-1 I抗(1∶600)在4 ℃孵育过夜以后,与辣根过氧化物酶标记IgG(1 ∶2 000)在室温孵育90 min,ECL发光试剂盒发光,在Odyssey FC显影,用LabWorks 4.5对蛋白进行定量,以GAPDH为内参照。
2.4细胞转染 将HK-2细胞以每孔2×105个细胞接种到6孔细胞板中,培养约24 h,细胞融合度约为70%。Solution A:取0.5 μg的VDUP-1 siRNA和siRNA control分别与100 μL的siRNA transfection medium混合;Solution B:转染前取4 μL的siRNA transfection reagent与100 μL的siRNA transfection medium混合。把Solution A和Solution B混合后,放在室温条件下孵育30 min,加入到细胞中,放在37 ℃孵育6 h。更换细胞培养液,继续培养48 h,RT-PCR和Western blot测定抑制效果,步骤同2.2和2.3。
2.5流式细胞术检测细胞凋亡 将normal组、HG组和VDUP-1 siRNA+HG组的细胞按照2.1中方法处理以后,培养48 h。将细胞培养液吸除以后,用0.25%胰蛋白酶消化后,1 000×g离心10 min,收集细胞。加入500 μL的结合缓冲液,混合均匀后,依次加入5 μL的Annexin V-FITC和5 μL的碘化丙啶(propidium iodide,PI)混合后,放在避光条件下孵育20 min,立即用流式细胞仪检测。
2.6Caspase-3和caspase-9活性的检测 将normal组、HG组和VDUP-1 siRNA+HG组的细胞按照2.1中方法处理以后,培养48 h。胰蛋白酶消化后,收集各组细胞,用PBS洗涤2次后,2 000×g离心10 min,吸除上清液,每组收集3×106个细胞,加入60 μL的Lysis Buffer混匀后,放在-20 ℃孵育20 min,4 ℃、12 000×g离心20 min,BCA法测定蛋白浓度,把蛋白浓度调整为1.8 g/L,吸取50 μL的蛋白上清,加入50 μL的2×reaction buffer(每50 μL的2×reaction buffer中加入0.5 μL的DTT),混匀后,加入5 μL的caspase-3底物和caspase-9 底物,放在37 ℃孵育4 h,用酶标仪检测A405,以A405表示caspase-3和caspase-9活性。
2.7TNF-α含量的检测 将normal组、HG组和VDUP-1 siRNA+HG组的细胞按照2.1中方法处理以后,培养48 h。收集培养液上清,用ELISA法测定培养液上清中TNF-α含量,步骤参照试剂盒说明书。
2.8外源性的Shh对高糖诱导的肾小管上皮细胞凋亡的影响 将normal组、HG组和VDUP-1 siRNA+HG组的细胞按照2.1中方法处理以后,培养48 h,Western blot检测细胞中Ptch1、Smo、Gli2和Shh水平,步骤同2.3。同时用Western blot法检测normal组和Shh组细胞培养48 h后,监测细胞中Ptch1、Smo、Gli2的蛋白水平,步骤同2.3。VDUP-1 siRNA+HG组、Shh+HG组和VDUP-1 siRNA+Shh+HG组的细胞按照2.1中方法处理后,培养48 h,流式细胞术检测细胞凋亡,试剂盒检测caspase-3和caspase-9活性,ELISA检测培养液上清中TNF-α水平,步骤同2.5、2.6和2.7。抗Ptch1的 I 抗以1 ∶600稀释,抗Smo的I抗以1∶800稀释,抗Gli2的I抗以1∶500稀释,抗Shh的I抗以1∶800稀释。
3 统计学处理
所有实验数据采用SPSS 21.0软件进行分析,计量资料用均数±标准差(mean±SD)表示,两组数据采用独立样本t检验,多组差异比较采用单因素方差分析,组间比较用Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结 果
1 高糖作用后细胞中VDUP-1的表达
与normal组比较,HG组的细胞中VDUP-1的mRNA和蛋白水平均明显升高(P<0.05),说明高糖作用后的肾小管上皮细胞中的VDUP-1水平升高,见图1。
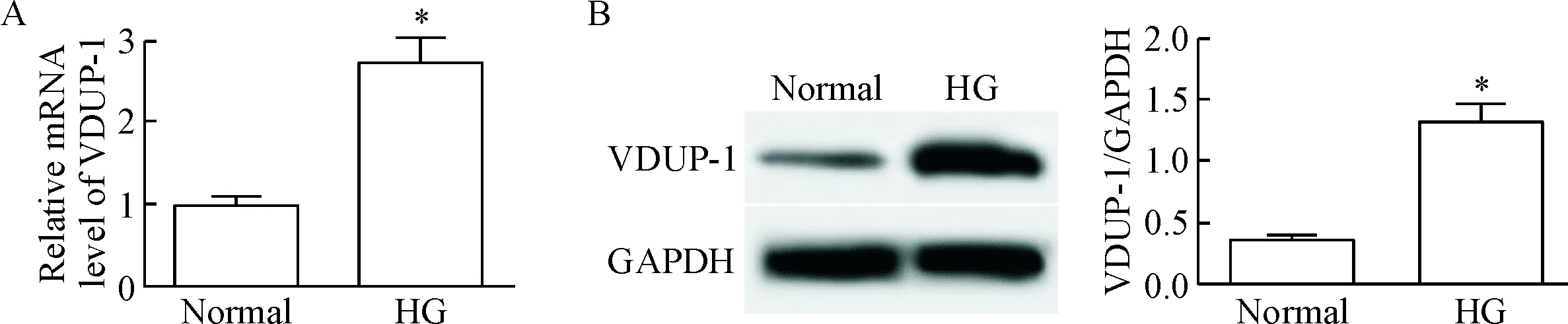
Figure 1. Up-regulation of VDUP-1 expression at mRNA (A) and protein (B) levels in the renal tubular epithelial cells induced by high glucose (HG). Mean±SD. n=3. *P<0.05 vs normal group.
2 转染后细胞中VDUP-1水平的变化
VDUP-1 siRNA组细胞中VDUP-1 的mRNA和蛋白水平均明显低于normal组(P<0.05);而siRNA control组细胞中VDUP-1的mRNA和蛋白水平与normal组相比差异没有统计学显著性,说明VDUP-1 siRNA可以下调肾小管上皮细胞中的VDUP-1水平,见图2。
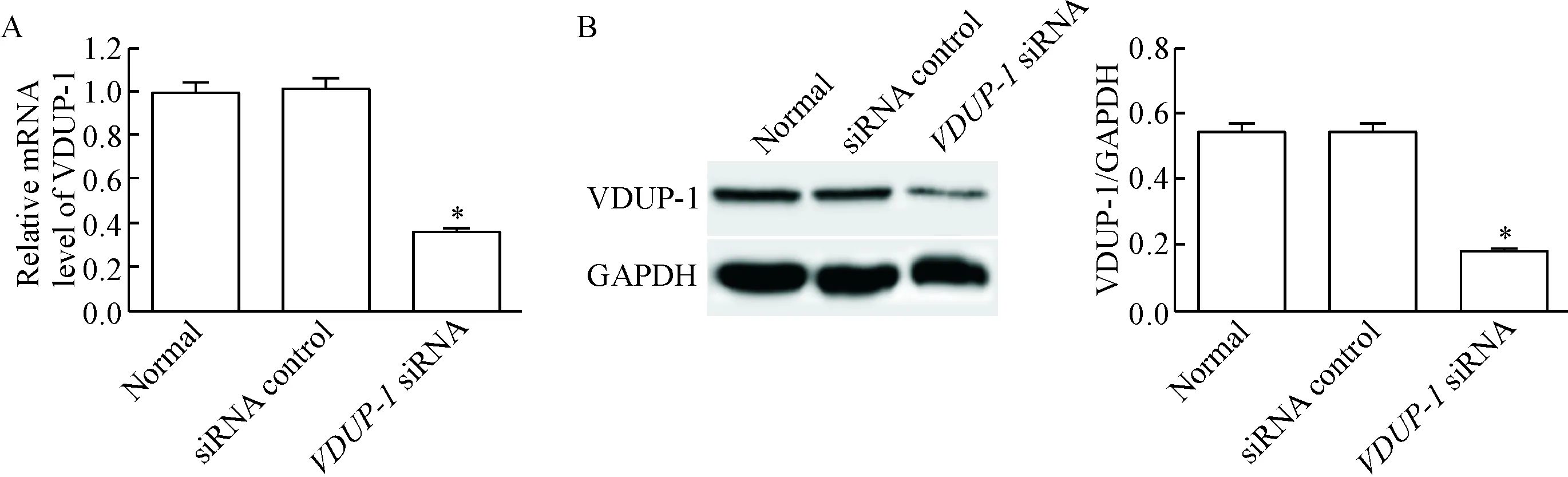
Figure 2. The expression of VDUP-1 at mRNA (A) and protein (B) levels in transfected cells. Mean±SD. n=3. *P<0.05 vs normal group.
3 VDUP-1表达下调对高糖诱导的细胞凋亡及TNF-α分泌的影响
与normal组相比,HG组和VDUP-1 siRNA+HG组的细胞凋亡率、caspase-3和caspase-9活性及TNF-α含量均明显升高(P<0.05);与HG组相比,VDUP-1 siRNA+HG组的细胞凋亡率、caspase-3和caspase-9活性及TNF-α含量明显降低(P<0.05),见图3。这表明VDUP-1表达下调抑制高糖诱导的肾小管上皮细胞凋亡,并抑制细胞分泌TNF-α。
4 VDUP-1表达下调对高糖环境下细胞中Ptch1、Smo、Gli2和Shh蛋白表达的影响
与normal组相比,HG组和VDUP-1 siRNA+HG组的细胞中Ptch1、Smo、Gli2和Shh的蛋白水平均明显降低(P<0.05);与HG组相比,VDUP-1 siRNA+HG组的细胞中Ptch1、Smo、Gli2和Shh的蛋白水平明显升高(P<0.05),见图4。这表明高糖抑制肾小管上皮细胞中Shh信号通路激活,而VDUP-1表达下调可以部分减弱高糖的这一作用。
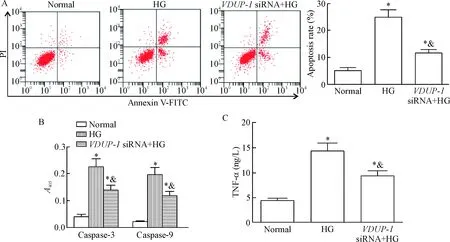
Figure 3.The effects of down-regulation of VDUP-1 expression on the apoptosis and TNF-α release of the HK-2 cells induced by high glucose (HG). A: the apoptosis of the cells detected by flow cytometry; B: the changes of the caspase-3 and caspase-9 activities; C: the content of TNF-α in the cell culture supernatant. Mean±SD. n=3. *P<0.05 vs normal group; & P<0.05 vs HG group.
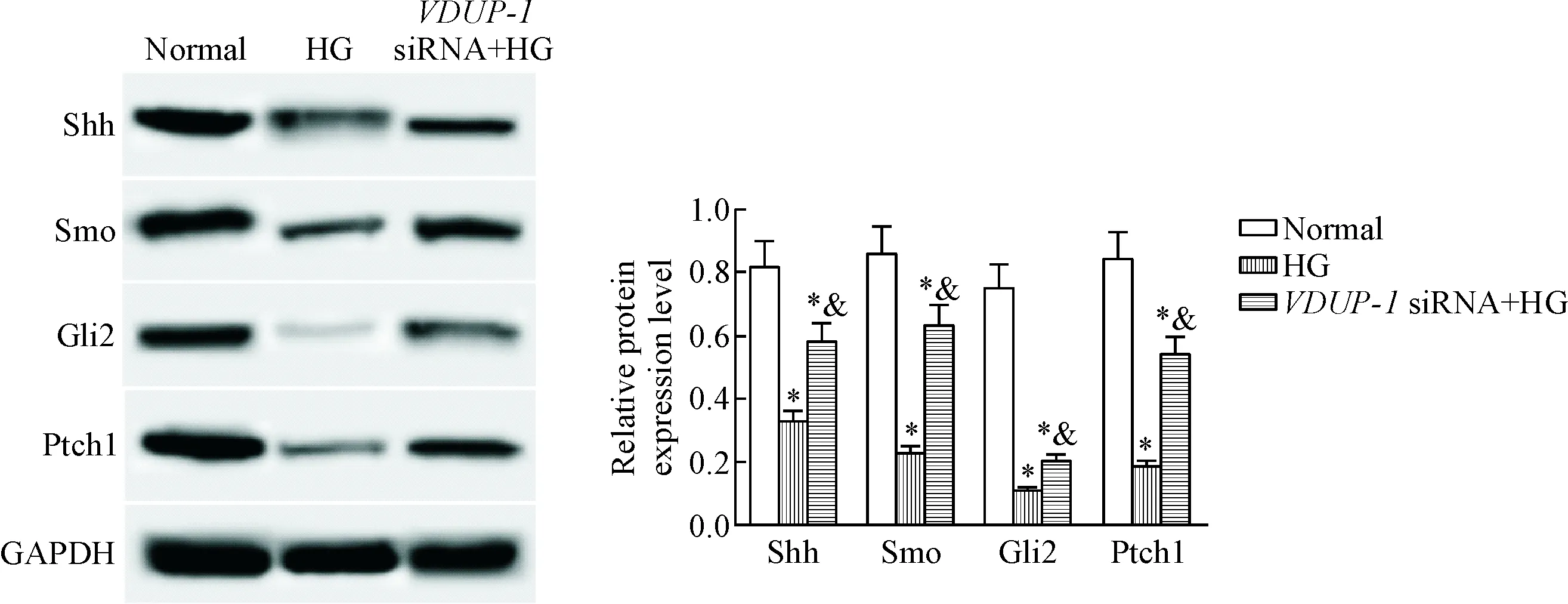
Figure 4.The effects of VDUP-1 down-regulation on the protein levels of Ptch1, Smo, Gli2 and Shh in the HK-2 cells cultured in high glucose (HG) environment. Mean±SD. n=3. * P<0.05 vs normal group; & P<0.05 vs HG group.
5 外源性Shh对细胞中Shh信号通路影响
与normal组比较,Shh组细胞中Ptch1、Smo和Gli2的蛋白水平均明显升高(P<0.05),见图5。这表明外源性Shh可以促进肾小管上皮细胞中Shh信号通路的激活。
6 外源性Shh对高糖诱导的肾小管上皮细胞凋亡及分泌TNF-α影响
VDUP-1 siRNA+Shh+HG组的细胞凋亡率、caspase-3和caspase-9活性及TNF-α含量均明显低于VDUP-1 siRNA+HG组和Shh+HG组(P<0.05),见图6。这表明外源性Shh与VDUP-1表达下调具有协同作用,都能够抑制高糖环境下的肾小管上皮细胞凋亡,抑制细胞分泌TNF-α。
讨 论
糖尿病肾病以肾小球病变和肾小管间质病变为主要病理特征,肾小管间质病变占据了肾脏面积的90%,肾小管上皮细胞凋亡是肾小球病变的主要原因之一[12-15]。VDUP-1最初被发现于HL-60白血病细胞中,其cDNA约为2.9 kb,编码的蛋白质大小为56 kD;该蛋白含有2个PxxP抑制结构域和2个PPxY序列,属于α-抑制蛋白家族成员,能够调控蛋白与蛋白之间的相互作用;敲除VDUP-1基因后,小鼠出现低血糖、肝脏脂肪变性、出血等症状; VDUP-1表达水平与高血糖和肥胖等有关,参与机体内血糖平衡[16-20]。研究报道显示,高血糖状态下,VDUP-1在肾小管上皮细胞中表达上调,参与糖尿病肾病发生过程[9, 21]。
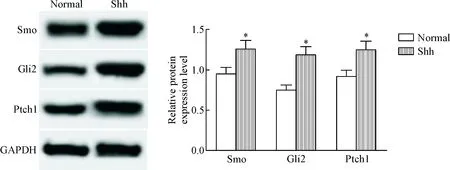
Figure 5.The effects of exogenous Shh on Shh signaling pathway in the HK-2 cells. Mean±SD. n=3. *P<0.05 vs normal group.
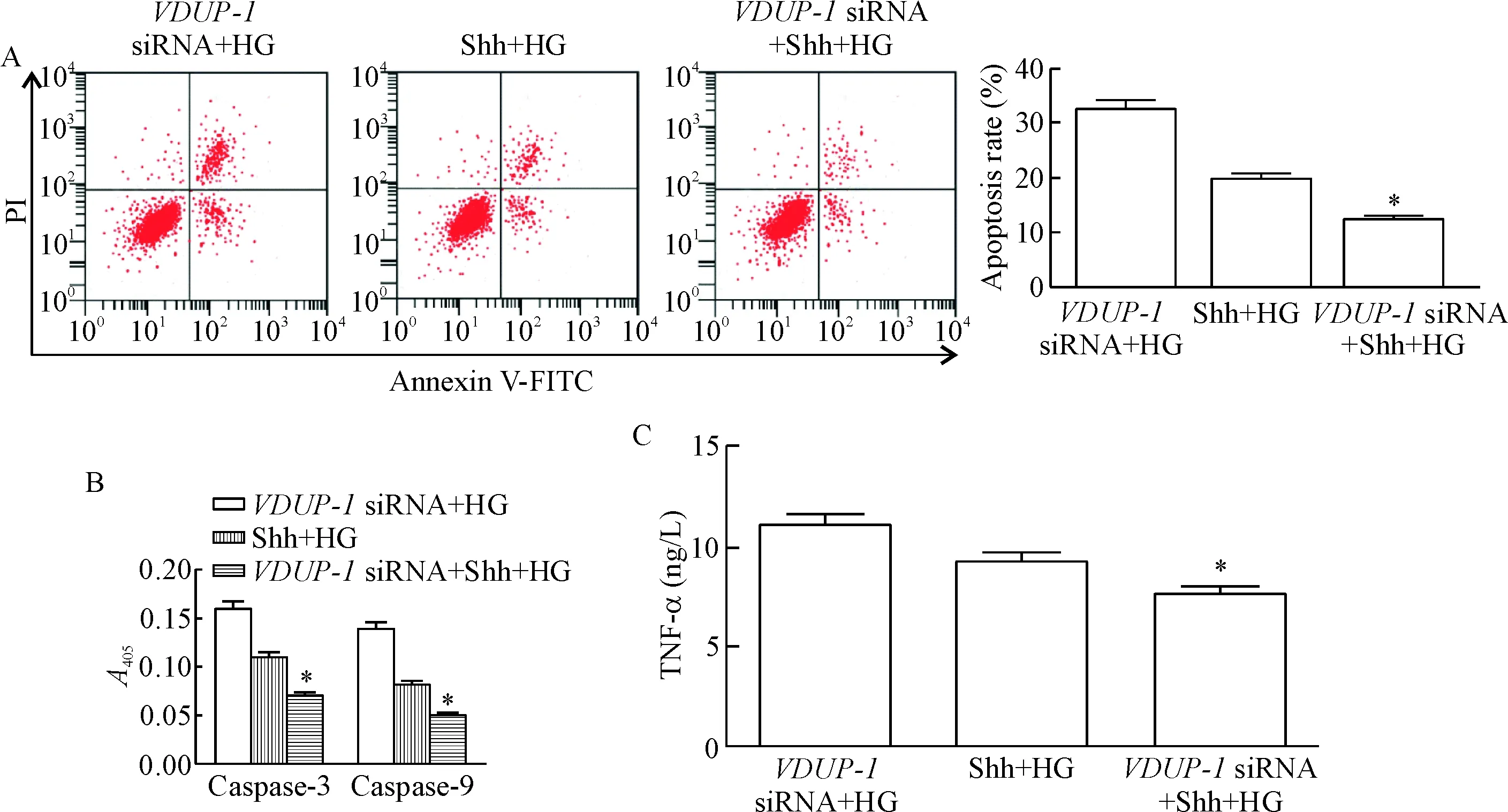
Figure 6.The effects of exogenous Shh and VDUP-1 down-regulation on the apoptosis and TNF-α release of renal tubular epithelial cells induced by high glucose (HG). A: the apoptosis of the cells detected by flow cytometry; B: the changes of the caspase-3 and caspase-9 activities; C: the content of TNF-α in the cell culture supernatant. Mean±SD. n=3. *P<0.05 vs VDUP-1 siRNA+HG group and Shh+HG group.
细胞凋亡与细胞内多种因子的调控有关。Caspase是细胞线粒体凋亡的关键蛋白酶,其中caspase-9是caspase级联反应的起始因子,是caspase“瀑布式”反应的激活因子,其活化后可以激活线粒体凋亡途径;caspase-9通常以酶原的形式存在,在凋亡、因子等的刺激下,形成二聚体,激活下游的caspase-3,活化的caspase-3能够抑制抗凋亡蛋白、DNA修复因子等功能的发挥,诱导细胞凋亡发生[22-29]。糖尿病肾病大鼠肾组织中caspase-3和caspase-9的活化水平升高,与肾小管上皮细胞的凋亡有关[30-31]。
本研究中,用高糖刺激肾小管上皮细胞后,肾小管上皮细胞中VDUP-1 mRNA和蛋白水平均明显升高,同时肾小管上皮凋亡水平升高,细胞中caspase-3和caspase-9活化水平升高,提示高糖诱导肾小管上皮细胞凋亡,并且促进细胞中VDUP-1表达,这与上述研究报道相符合。用细胞转染的方法下调肾小管上皮细胞中VDUP-1表达并用高糖刺激后的细胞凋亡率下降,细胞中caspase-3和caspase-9活性降低,提示抑制VDUP-1表达可以抑制高糖诱导的肾小管上皮细胞凋亡。
Shh是一个保守的信号通路,与多个组织和器官的形成有关。Hh配体可以与存在于细胞膜上的受体Ptch结合后,与Smo识别;而Smo是一种跨膜蛋白,可以激活细胞内的信号通路,使存在于细胞浆内的转录因子Gli活化以后,进入细胞核内,调控靶基因的转录[32-38]。在肾组织发育成熟以后,Shh信号通路激活水平降低,而在缺血、缺氧等条件下,肾组织中的Shh信号通路被活化,但是在糖尿病肾病发生后,肾组织中的Shh信号通路被抑制[39-40]。本研究表明,高糖作用后的肾小管上皮细胞中Ptch1、Smo、Gli2和Shh蛋白水平下降,Shh信号通路激活受到抑制;用外源性Shh处理肾小管上皮细胞后,细胞中的Shh信号通路被激活,并且外源性Shh处理VDUP-1表达下调后的肾小管上皮细胞并经高糖刺激后,细胞凋亡率下降更多,说明二者具有协同作用,干扰VDUP-1通过促进Shh信号通路激活而抑制高糖诱导的肾小管上皮细胞凋亡。
以上实验结果表明,VDUP-1在高糖环境中的肾小管上皮细胞中表达水平升高,干扰VDUP-1表达可以通过影响Shh信号通路降低高糖诱导的肾小管上皮细胞凋亡水平。VDUP-1参与糖尿病状态下的肾小管上皮细胞凋亡,为以后研究糖尿病肾病肾小管上皮细胞凋亡发生机制提供了科学依据,为寻找有效靶点治疗糖尿病肾病提供了新思路。

