PTEN对缺氧复氧心肌H9c2细胞凋亡、氧化损伤及免疫炎症因子水平的影响*
燕林贞, 燕钦栋, 张顺祥, 丁小青, 李 康
(1山东省东营市广饶县人民医院心内科, 山东 东营 257300; 2山东省东营市东城医院心内科, 山东 东营 257091)
心肌梗死是一种常见的心血管系统疾病,临床上对于心肌梗死的研究已经有近百年的历史,虽然取得了一定的成效,但其发病机制仍在探索之中。目前临床上常见的治疗方法为经皮冠状动脉介入治疗,这种治疗方法虽然具有一定的成效,但往往会造成缺血再灌注损伤,加重心肌损伤,使患者出现心力衰竭和心律失常等症状。心肌细胞凋亡和氧化损伤等都与缺血再灌注损伤有关[1-2]。第10号染色体缺失的磷酸酶及张力蛋白同源物(phosphatase and tensin homolog deleted on chromosome 10,PTEN)具有双磷酸酶活性,在细胞生长和凋亡等过程中具有重要作用,参与胚胎发育,与动脉粥样硬化、糖尿病心肌病、肿瘤、脑血管疾病和心肌缺血再灌注等疾病发生有关[3-5]。研究显示,PTEN在缺血再灌注大鼠心肌组织中表达上调,可能与心肌细胞凋亡有关[6]。本研究构建体外心肌细胞缺氧复氧 (anoxia/reoxygenation,A/R)损伤模型,通过小干扰RNA(small interfering RNA, siRNA)下调心肌细胞中PTEN的水平,探讨PTEN在缺氧复氧心肌细胞凋亡和氧化损伤中的作用,为研究心肌缺血再灌注发生机制奠定基础。
材 料 和 方 法
1 材料
H9c2细胞购自中科院上海细胞库。Lipofectamine 2000购自Thermo Fisher Scientific;胰蛋白酶、DMEM培养基和超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒购自Sigma;胎牛血清购自杭州四季青;PTENsiRNA1、PTENsiRNA2和siRNA control购自上海西宝生物科技有限公司;抗PTEN多克隆抗体、抗cleaved caspase-3多克隆抗体、抗Bax多克隆抗体和抗FasL多克隆抗体购自Abcam;丙二醛(malondialedhyde,MDA)活性检测试剂盒购自上海信帆生物;乳酸脱氢酶(lactate dehydrogenase,LDH)活性检测试剂盒购自于碧云天;肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)含量检测试剂盒和白细胞介素6(interleukin-6,IL-6)ELISA检测试剂盒购自于上海晶抗;白细胞介素1β(interleukin-1β,IL-1β)ELISA检测试剂盒购自于上海纪宁。
2 方法
2.1缺氧复氧细胞模型的建立 H9c2细胞培养用含有10% 胎牛血清的DMEM培养液培养,观察细胞密度超过80%以后,用含有0.05%的胰蛋白酶消化传代。缺氧复氧模型构建方法如下:H9c2细胞培养于37 ℃、 5% CO2和95%空气的培养箱中,细胞密度超过80%以后,将原培养液吸除,加入等量不含血清的DMEM培养基,在37 ℃、 5% CO2、95%N2的缺氧培养箱中孵育4 h。把原来的培养液吸除后,加入10% 胎牛血清的DMEM培养基,放在37 ℃、 5% CO2、95%空气的培养箱中培养6 h,即为缺氧复氧心肌细胞模型[7]。
2.2细胞分组 H9c2细胞分为:H9c2组、H9c2+A/R组、阴性对照转染(normal control,NC)组、NC+A/R组、siRNA1+A/R组和siRNA2+A/R组。H9c2组为H9c2细胞不经缺氧复氧处理,不经细胞转染;H9c2+A/R组为H9c2细胞经缺氧复氧处理,不经细胞转染;NC组为H9c2细胞转染siRNA control,不经缺氧复氧处理;NC+A/R组为H9c2细胞转染siRNA control,经缺氧复氧处理;siRNA1+A/R组为H9c2细胞转染PTENsiRNA1,经缺氧复氧处理;siRNA2+A/R组为H9c2细胞转染PTENsiRNA2,经缺氧复氧处理。各组细胞转染后培养24 h,进行缺氧复氧处理。
2.3细胞转染 把H9c2细胞种植到6孔板中,每孔添加1×105个细胞,培养至细胞密度为50%时进行细胞转染。把Lipofectamine 2000同Opti-MEM混匀后,在室温环境下孵育5 min。取PTENsiRNA1、PTENsiRNA2和siRNA control分别与Opti-MEM混合。将上述2种混合物在室温中孵育20 min,添加到细胞中,孵育6 h后,更换新鲜细胞培养液。
2.4RT-PCR实验 取各组心肌细胞,按照TRIzol法提取细胞中的RNA,紫外分光光度计测定A260和A280值,测定RNA的质量。反转录合成cDNA,用RT-PCR检测PTEN水平,内参照β-actin的上游引物为5’-CCTCAAGATTGTCAGCAAT-3’,下游引物为5’-CCATCCACAGTCTTCTGAGT-3’;PTEN上游引物为5’-TCATGGTGCTGGTGGCTCTG-3’,下游引物为5’-TGTGCTGGGGTTGGCTATTT-3’。反应程序为:94 ℃预变性3 min; 94 ℃变性30 s, 58 ℃退火30 s, 72 ℃延伸45 s, 40个循环。
2.5Western blot实验 取各组心肌细胞,提取细胞总蛋白,BCA法对蛋白进行定量检测,配制分离胶(10%)和浓缩胶(5%)。按照每孔中添加20 μL的蛋白样品,把蛋白与上样缓冲液混匀后,在100 ℃煮沸5 min。80 V条件下电泳,溴酚蓝达到分离胶的边缘时,把电压调整到120 V,关闭电泳。3 mA/cm2转膜2 h。与5%脱脂奶粉在室温反应2 h,按1∶1 000稀释抗β-actin抗体,按1∶600稀释抗PTEN、cleaved caspase-3、Bax和FasL抗体,4 ℃孵育过夜后,放在1∶3 000稀释的 II 抗中在室温结合2 h。ECL化学发光,曝光30 s,用Image-Pro Plus分析蛋白含量,用目的蛋白/β-actin表示蛋白含量。
2.6MTT法检测细胞活力 将NC、NC+A/R和siRNA2+A/R组细胞种植到96孔板中,按照2.2中处理后,每组设置5个复孔,每个孔中加入100 μL的细胞悬浮液,缺氧复氧处理后,把原来的培养液吸除以后,加入PBS把细胞漂洗3次,每孔中依次加入20 μL的MTT溶液,孵育4 h以后,停止培养。将原来的培养液吸除以后,依次在每孔中添加150 μL的二甲基亚砜溶液,在避光条件下孵育10 min,放置到酶标仪上测定吸光度(A)值,以不加入细胞的孔调零。细胞相对活力(%)=待测孔A/对照孔A×100%。
2.7流式细胞术检测细胞凋亡 将NC、NC+A/R和siRNA2+A/R各组细胞分组处理后,用PBS洗涤3次,胰蛋白酶消化,收集细胞,在细胞中添加500 μL的Binding Buffer混合后,在细胞中添加Annexin V-FITC 5 μL,再添加5 μL的PI,放置于室温环境中避光反应10 min。立即用流式细胞仪检测细胞凋亡水平。
2.8LDH、SOD和MDA水平的检测 将NC、NC+A/R和siRNA2+A/R各组细胞按照2.2中处理后,收集细胞和培养液上清,用试剂盒进行检测。用黄嘌呤氧化法测定细胞中SOD活性,用硫代巴比妥酸法测定MDA活性,用二硝基苯肼法测定培养液上清中LDH活性。
2.9TNF-α、IL-1β和IL-6水平的检测 将NC、NC+A/R和siRNA2+A/R各组细胞按照2.2中处理后,收集细胞培养液上清,用ELISA测定细胞培养液上清中TNF-α、IL-1β和IL-6水平,步骤参照试剂盒说明书。
3 统计学处理
所有实验数据采用SPSS 21.0软件进行分析,计量资料用均数±标准差(mean±SD)表示,两组数据采用独立样本t检验,多组差异比较采用单因素方差分析,组间比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 缺氧复氧后心肌细胞中PTEN的表达水平
H9c2细胞经缺氧复氧处理后细胞中PTEN的mRNA和蛋白水平明显高于正常培养的H9c2细胞(P<0.05),见图1。这提示PTEN在缺氧复氧心肌细胞中表达上调。
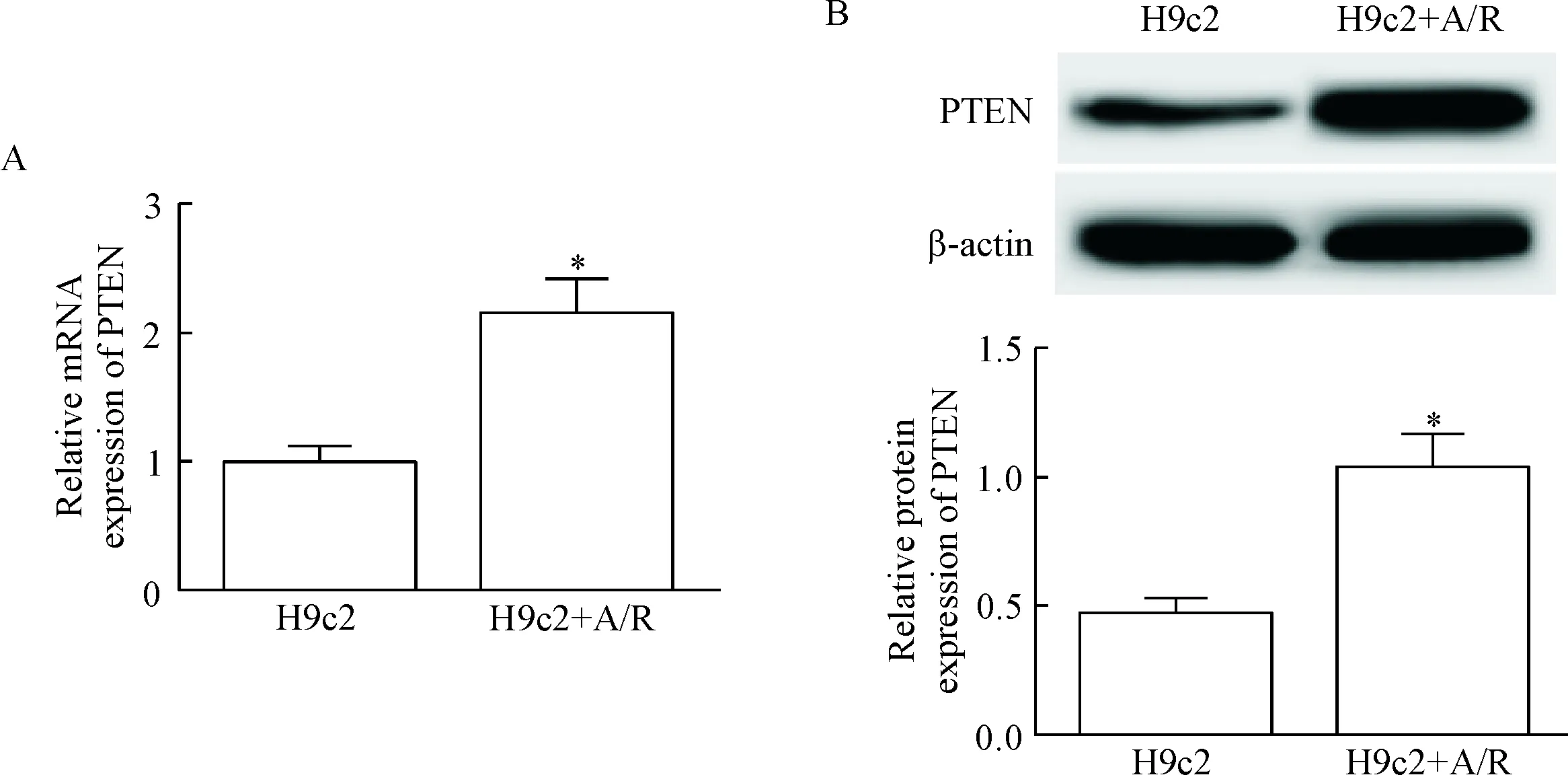
Figure 1.The mRNA (A) and protein (B) expression levels of PTEN in the H9c2 cells after anoxia/reoxygenation (A/R). Mean±SD. n=3. *P<0.05 vs H9c2 group.
2 细胞转染后经缺氧复氧处理后细胞中PTEN水平的变化
siRNA1+A/R组和siRNA2+A/R组细胞中PTEN的mRNA和蛋白水平明显低于NC+A/R组(P<0.05);其中siRNA2+A/R组细胞中PTEN的mRNA和蛋白水平明显低于siRNA1+A/R组(P<0.05),因此后续选用转染PTENsiRNA2的心肌细胞继续研究,见图2。
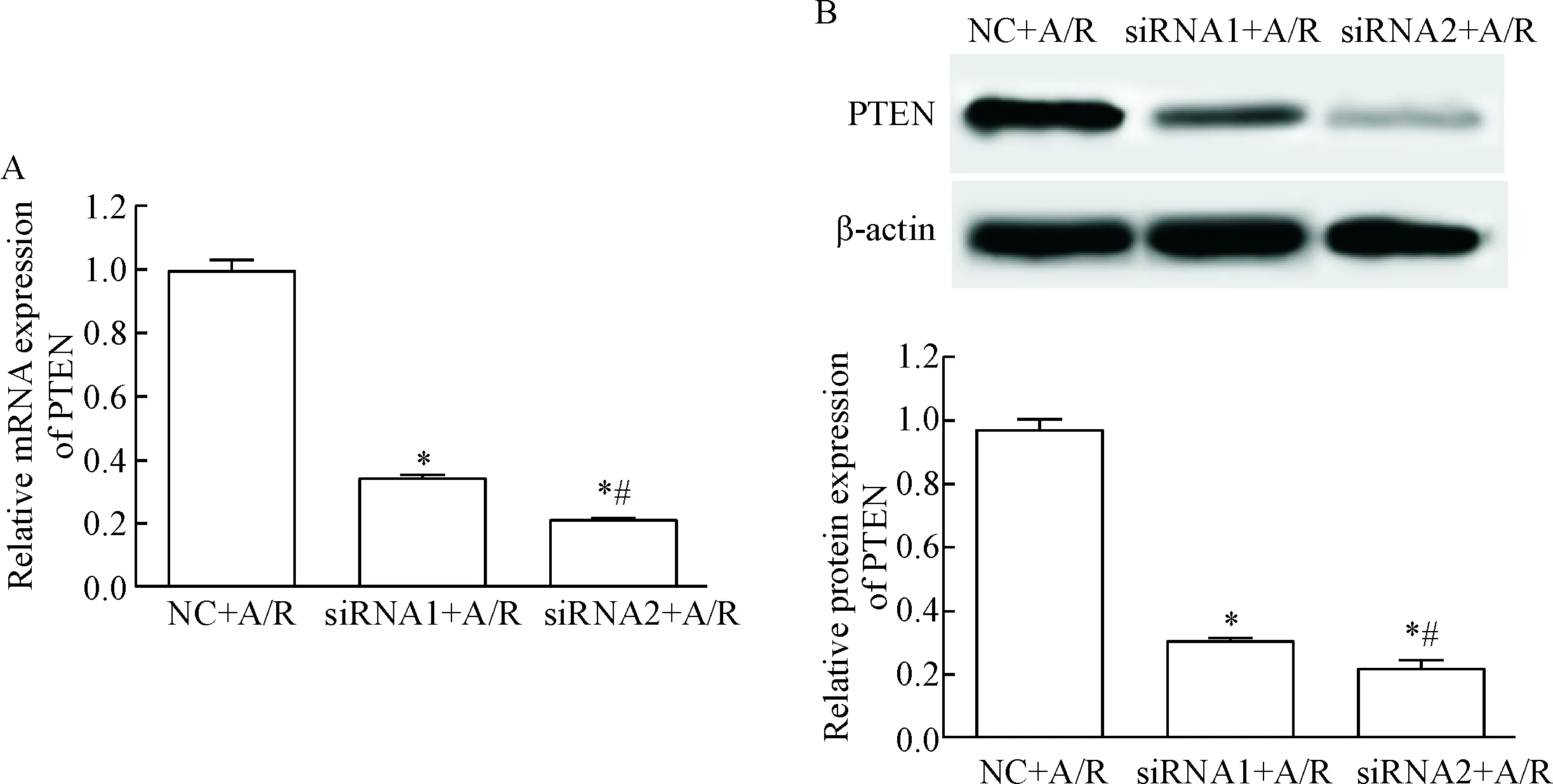
Figure 2.The expression of PTEN at mRNA (A) and protein (B) levels in the transfected H9c2 cells treated with anoxia/reoxyge-nation (A/R). Mean±SD. n=3. *P<0.05 vs NC+A/R group; #P<0.05 vs siRNA1+A/R group.
3 PTEN表达下调对缺氧复氧处理的H9c2细胞凋亡和细胞活力的影响
NC+A/R组细胞凋亡率明显高于NC组,而细胞活力明显低于NC组(P<0.05);siRNA2+A/R组细胞凋亡率明显低于NC+A/R组,而细胞活力明显高于NC+A/R组(P<0.05),见图3。这说明缺氧复氧诱导心肌细胞凋亡,抑制心肌细胞活力,而下调PTEN可以减少心肌细胞凋亡,提高细胞活力。
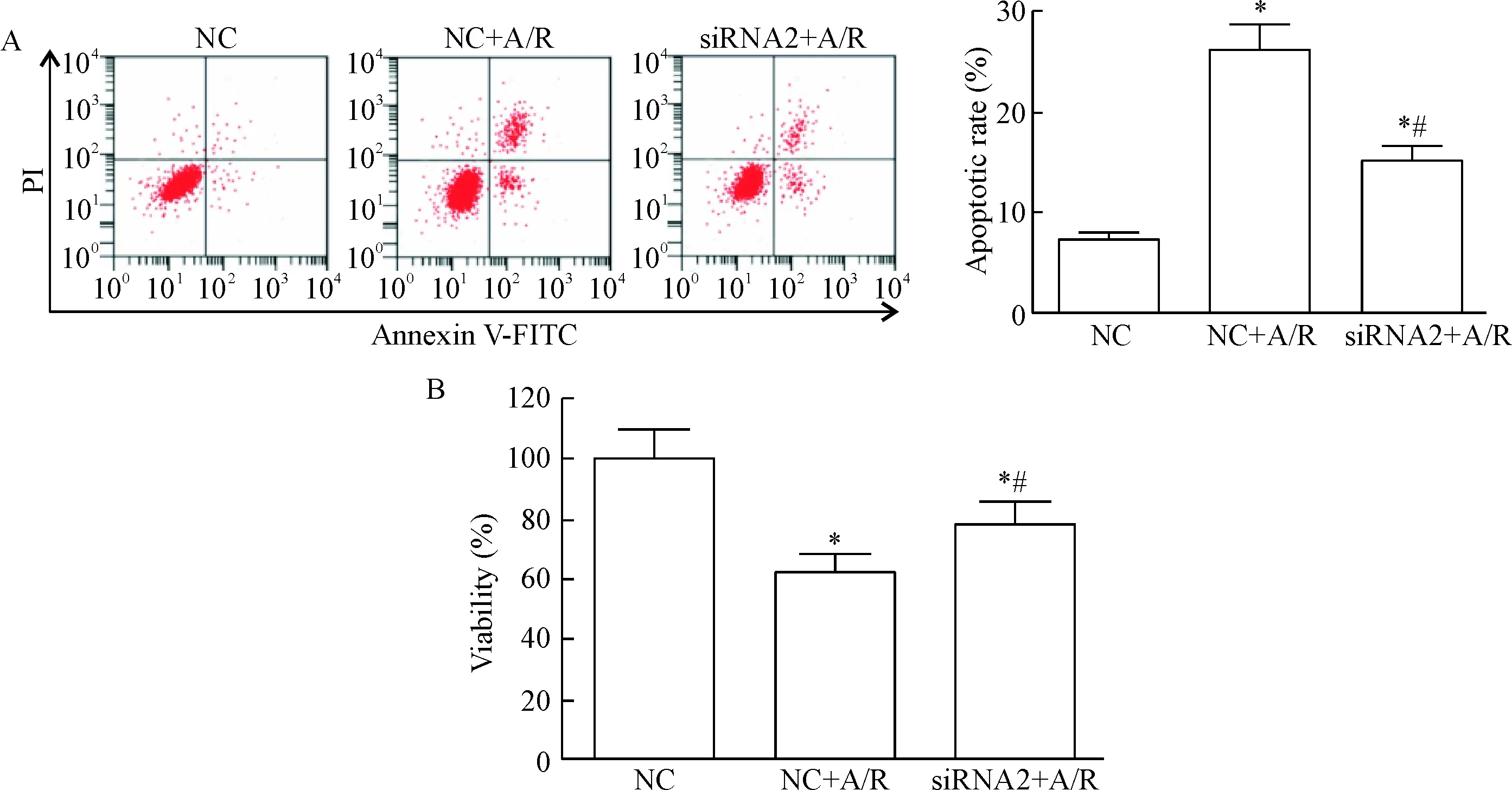
Figure 3.The effect of down-regulation of PTEN expression on the apoptosis (A) and viability (B) of H9c2 cells induced by anoxia/reoxygenation (A/R). Mean±SD. n=3. *P<0.05 vs NC group; #P<0.05 vs NC+A/R group.
4 PTEN表达下调对缺氧复氧处理的H9c2细胞MDA含量、SOD水平和LDH漏出水平的影响
NC+A/R组细胞中MDA含量和培养液上清中LDH水平明显高于NC组,而细胞中SOD活性明显低于NC组(P<0.05);siRNA2+A/R组细胞中MDA含量和培养液上清中LDH水平明显低于NC+A/R组,而细胞中SOD活性明显高于NC+A/R组(P<0.05),见表1。这提示缺氧复氧诱导心肌细胞氧化损伤,而下调PTEN可以降低缺氧复氧诱导的心肌细胞氧化损伤。

表1 PTEN表达下调后经缺氧复氧的H9c2细胞中MDA含量、SOD活性和培养液上清中LDH水平的变化
*P<0.05vsNC group;#P<0.05vsNC+A/R group.
5 PTEN表达下调对缺氧复氧处理的H9c2细胞分泌TNF-α、IL-1β和IL-6的影响
NC+A/R组细胞培养液上清中TNF-α、IL-1β和IL-6水平明显高于NC组(P<0.05);siRNA2+A/R组细胞培养液上清中TNF-α、IL-1β和IL-6水平明显低于NC+A/R组(P<0.05),见表2。这说明缺氧复氧诱导心肌细胞分泌TNF-α、IL-1β和IL-6,而下调PTEN可以抑制缺氧复氧诱导的心肌细胞分泌TNF-α、IL-1β和IL-6。

表2 PTEN表达下调后经缺氧复氧的H9c2细胞培养液上清中TNF-α、IL-1β和IL-6水平的影响
*P<0.05vsNC group;#P<0.05vsNC+A/R group.
6 PTEN表达下调对缺氧复氧处理的H9c2细胞中cleaved caspase-3、Bax和FasL蛋白水平的影响
NC+A/R组细胞中cleaved caspase-3、Bax和FasL的蛋白水平明显高于NC组(P<0.05);siRNA2+A/R组细胞中cleaved caspase-3、Bax和FasL的蛋白水平明显低于NC+A/R组(P<0.05),见图4及表3。这提示缺氧复氧诱导心肌细胞中cleaved caspase-3、Bax和FasL蛋白水平升高,而下调PTEN可以抑制缺氧复氧诱导的心肌细胞cleaved caspase-3、Bax和FasL蛋白水平的上调。
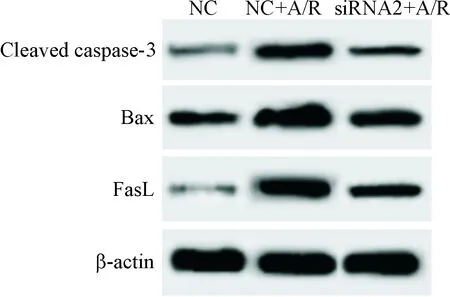
Figure 4.The images of Western blot for determining the protein levels of cleaved caspase-3, Bax and FasL in the H9c2 cells treated with anoxia/reoxygenation (A/R) after down-regulation of PTEN expression.

表3 PTEN表达下调后经缺氧复氧处理H9c2细胞中cleaved caspase-3、Bax和FasL蛋白水平的变化
*P<0.05vsNC group;#P<0.05vsNC+A/R group.
讨 论
PTEN基因定位在染色体10q23.3上,由8个内含子及9个外显子组成,全长为200 kb,其编码的蛋白具有磷酸酶活性和蛋白脂酶活性,主要的功能结构域位于N端,PTEN可以调控相关靶基因的转录活性,影响细胞的生长[8-13]。研究显示,PTEN在心血管系统疾病发生中具有重要作用,可以通过调控细胞的增殖和分化等影响心肌重构[14-16]。PTEN对于细胞的生长具有负调控作用,通过下调心肌细胞中PTEN表达可以增加参附注射液抗糖尿病心肌病效果,抑制PTEN后的心肌细胞经高糖作用后细胞凋亡率有所降低[17-18]。有报道表明,PTEN不仅参与心肌细胞的凋亡,还与心肌细胞脂质过氧化有关,在维持心肌组织结构等方面具有重要作用[19-20]。Ruan等[21]的研究表明,PTEN能够阻碍抗凋亡信号的传导,下调其表达可能是一种潜在的保护心肌缺血再灌注损伤的途径。
心肌细胞凋亡过度是缺血再灌注损伤发生的重要病理学变化,受到多种凋亡蛋白的调控[22]。Caspase-3是caspase蛋白家族的成员,是细胞凋亡的执行因子,其在正常情况下以无活性的酶原存在,在受到细胞内相关因子刺激后可以活化促进细胞凋亡发生[23]。Bax是Bcl-2蛋白家族的成员,其表达上调后发挥促凋亡作用[24]。FasL是一种与细胞凋亡有关的膜表面分子,与细胞凋亡的发生有关[25]。本研究构建了心肌细胞缺氧复氧模型,发现PTEN在缺氧复氧心肌细胞中表达上调,并且心肌细胞增殖活性降低,细胞凋亡率升高,细胞中caspase-3活化水平升高,Bax和FasL表达水平升高。通过小RNA干扰技术下调PTEN后发现,下调PTEN后的心肌细胞经过缺氧复氧处理后,细胞增殖活性有所升高,细胞凋亡水平下降,抑制PTEN可以降低缺氧复氧心肌细胞凋亡水平,增加细胞增殖活性,PTEN表达下调抑制缺氧复氧诱导的心肌细胞凋亡。
正常的心肌细胞以有氧代谢为主,当发生缺氧后,心肌细胞膜通透性发生改变,存在于细胞内的LDH外漏,测定细胞外LDH的水平可以间接反映细胞损伤程度[26]。MDA是脂质过氧化的产物,氧化损伤发生后导致细胞内MDA水平异常升高[27]。SOD可以清除细胞内的超氧阴离子,在维持氧化平衡、抵抗氧化损伤中具有重要作用[28]。研究显示,心肌缺血再灌注损伤与心肌组织氧化损伤有关[29]。本研究表明,缺氧复氧后心肌细胞SOD水平下降,MDA水平升高,细胞培养液中LDH水平也升高,心肌细胞发生氧化损伤,而下调PTEN后可以部分缓解上述作用,减少氧化损伤发挥保护心肌细胞的作用。
除了心肌细胞过度凋亡、心肌组织氧化损伤之外,心肌缺血再灌注的发生还与心肌组织炎症有关,TNF-α、IL-1β和IL-6可以促进类似于瀑布式的炎症反应,造成心肌组织损伤[30]。本研究表明,缺氧复氧后心肌细胞分泌的TNF-α、IL-1β和IL-6水平升高,而下调PTEN后可以减少细胞分泌的TNF-α、IL-1β和IL-6,减少炎症因子的释放。
PTEN在缺氧复氧心肌细胞中表达异常升高,下调其表达后可以降低缺氧复氧诱导的心肌细胞凋亡和氧化损伤,抑制炎症因子TNF-α、IL-1β和IL-6的分泌,发挥保护心肌细胞的作用,这对于以后研究PTEN在原代缺氧复氧心肌细胞及缺血再灌注损伤中的作用奠定了基础。

