lncRNA PCAT1表达下调抑制口腔鳞状细胞癌细胞的增殖、生长、侵袭、迁移及上皮-间充质转化*
李艳莉, 邓金勇, 王金龄, 何升腾
(1海南省第三人民医院口腔科, 2三亚市人民医院口腔科, 海南 三亚 572000)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是头颈部的最常见肿瘤之一,约占口腔肿瘤的90%[1]。 在美国,OSCC每年新发病例约4万例,每年死亡8 000例,5年生存率约为50%[2]。 尽管手术治疗和化疗已被用于OSCC的治疗,但缺乏早期发现OSCC标志物和现有药物治疗对部分病人没有效果仍然是OSCC治疗的一大挑战 。 另外,OSCC发生及发展的分子机制尚不清楚。长链非编码RNA(long non-coding RNA,lncRNA)是大于200 bp且不具有蛋白编码能力的转录物,lncRNA在细胞染色质重塑、转录、转录后处理、细胞内运输等功能起着重要的作用[3-4]。此外,许多研究还显示lncRNA的表达失调与各种类型肿瘤的进展有关。最新的研究发现lncRNA PCAT1的上调与多种肿瘤的发生发展有着密切的联系,包括前列腺癌、肝癌、膀胱癌、乳腺癌等[5-8],但PCAT1在OSCC中的作用尚未有报道。本研究通过一系列体外实验研究了 PCAT1对OSCC细胞增殖、生长、侵袭、迁移及上皮-间充质转化(epithelial-mesenchymal transition,EMT)的作用,并探讨其潜在的机制。
材 料 和 方 法
1 主要材料
正常人口腔黏膜角质细胞(normal human oral keratinocyte,NHOK)及OSCC细胞系SCC-25、Tca8113和TSCCa购于ATCC;DMEM/F12培养液和胎牛血清购于Thermo Fisher Scientific;PCAT1小干扰RNA(PCAT1 small interfence, PCAT1 siRNA;序列为5’-GCACCTTGTTAGCTACATAAA-3’)、阴性对照干扰RNA(control siRNA;序列为5’-GACAGCTTATATGACCACTTA-3’)及实时荧光定量PCR 的引物均购于广州瑞博生物科技有限公司; TRIzol试剂、cDNA Synthesis Kit 和Lipofectamine 2000购于Invitrogen;实时荧光定量PCR试剂盒购于TaKaRa;Western blot相关抗体购于Abcam;CCK-8试剂盒购于北京碧云天公司。
2 主要方法
2.1组织来源 本实验所用的20对口腔癌临床组织来自海南省第三人民医院病理科,所有组织标本经病理医生确诊。本研究经过海南省第三人民医院伦理委员会批准,所有患者知情同意。
2.2细胞培养与细胞转染 NHOK及OSCC细胞系(SCC-25、Tca8113及TSCCa)用含10%胎牛血清的DMEM/F12培养液,于37 ℃、5% CO2的湿润培养箱中培养。当6孔板里每孔细胞数量达2×105时,用不含双抗的培养液培养, 当细胞融合率达80%时采用Lipofectamine 2000试剂盒进行转染, 转染后24 h收集细胞进行相关实验。
2.3RT-qPCR 使用TRIzol试剂从OSCC肿瘤组织和细胞中分离总RNA,并逆转录为cDNA。 在RNA逆转录后, 使用SYBR Premix Ex Taq在采用荧光定量PCR 仪扩增检测相关基因的表达水平。GAPDH作为内参照。采用2-ΔΔCt方法分析结果,每组设3个复孔,实验重复3次,引物序列见表1。

表1 RT-qPCR引物序列
2.4CCK-8实验 取对数生长期的细胞以每孔1×104接种在96孔板中预培养24 h,然后将细胞分别转染control siRNA和PCAT1 siRNA,于转染完成后0 h、24 h、48 h和72 h分别加 入 CCK-8试剂,37 ℃孵育3 h ,酶联免疫检测仪于450 nm波长处检测吸光度(A)值。
2.5集落形成实验 将转染后的细胞以每孔500个细胞接种于6孔板中。14 d后,细胞用甲醇固定,用0.1%结晶紫染色, 显微镜下计数可见集落。
2.6细胞侵袭以及迁移实验 将无血清培养基中的转染的OSCC细胞(1×105)加入预先包被Matrigel(用于侵袭实验;无Matrigel用于细胞迁移试验)的插入孔(8 μm孔径)。 同时,将500 μL含有10% 胎牛血清的DMEM 加入下腔 室中。 孵育48 h后,取出插入孔,弃去孔中培养液,利用PBS浸洗3次。将小室利用甲醇固定30 min,适当风干,0.1%结晶紫染色20 min,用棉签轻轻擦掉上层未侵袭和迁移细胞,用PBS洗3次,最后显微镜下随机选取5个视野观察细胞,计数。
2.7Western blot实验 使用蛋白提取试剂盒进行总蛋白提取,通过SDS-PAGE凝胶电泳分离,然后将分离的蛋白转移到PVDF膜。 将PVDF膜 分别与不同的 I 抗(ZEB1 1 ∶1 500, N-cadherin 1∶1 000, vi-mentin, E-cadherin 1∶1 000, β-actin 1∶ 2 000)于4 ℃孵育过夜,PBS洗涤3次,每次15 min,然后与辣根过氧化物酶结合的II抗室温孵育1 h。利用TBST洗涤3次后进行曝光显影,用凝胶成像仪测量各显色条带的灰度值。
3 统计学处理
所有统计分析均使用SPSS 16.0和GraphPad Prism 6.0软件进行。数据以均数±标准差(mean±SD)表示。组间比较使用独立样品t检验或单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学显著性。
结 果
1 PCAT1 在OSCC表达上调
通过RT-qPCR检测了OSCC组织以及癌旁正常组织中的 PCAT1 的表达水平,实验结果显示,与癌旁正常口腔组织相比,PCAT1在OSCC 组织中表达上调(P<0.05),见图1A;RT-qPCR检测了不同OSCC细胞系以及正常口腔细胞黏膜角质细胞中的PCAT1的表达水平,实验结果显示,与NHOK组相比,PCAT1在3种不同的OSCC细胞系(SCC-25、Tca8113及TSCCa)中的表达都上调(P<0.05),见图1B。为了进一步研究PCAT1表达水平对 OSCC细胞行为的影响,将Tca8113和TSCCa细胞分别转染PCAT1 siRNA和control siRNA,RT-qPCR结果显示,与control组相比,转染了PCAT1 siRNA的Tca8113细胞及 TSCCa细胞PCAT1的表达水平都显著降低(P<0.05),见图1C、D。
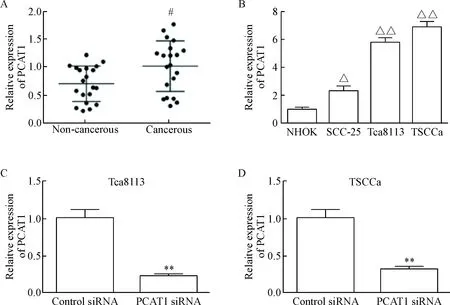
Figure 1. The expression of PCAT1 in the OSCC tissues and cells was up-regulated. A: the expression of PCAT1 in OSCC tissues and adjacent noncancerous tissues was detected by RT-qPCR; B: the expression of PCAT1 in normal human oral keratinocytes (NHOK) and OSCC cells was detected by RT-qPCR; C: the expression of PCAT1 in Tca8113 cells transfected with control siRNA and PCAT1 siRNA was detected by RT-qPCR; D: the expression of PCAT1 in TSCCa cells transfected with control siRNA and PCAT1 siRNA was detected by RT-qPCR. Mean±SD. n=3.#P<0.05 vs non-cancerous group; △P<0.05, △△ P<0.01 vs NHOK group; * P<0.05, ** P<0.01 vs control group.
2 PCAT1 沉默对OSCC细胞增殖的影响
通过CCK-8和集落形成实验分别检测OSCC细胞的增殖。CCK-8实验结果显示,PCAT1 siRNA的转染可显著抑制Tca8113和TSCCa细胞的活力(P<0.05),见图2A、B。集落形成实验结果显示,沉默Tca8113和TSCCa细胞中PCAT1表达可以减少Tca8113及TSCCa细胞的集落形成数量(P<0.05),见图2C、D。
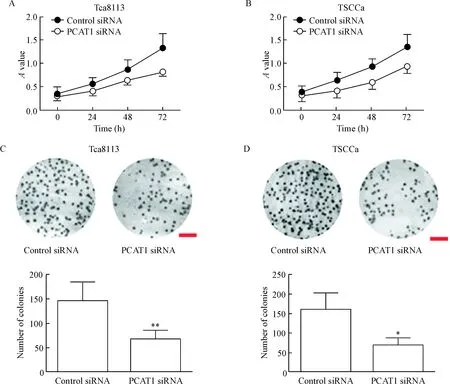
Figure 2.Silencing of PCAT1 inhibited OSCC cell proliferation. A: the viability of Tca8113 cells transfected with control siRNA or PCAT1 siRNA was measured by CCK-8 assay; B: the viability of TSCCa cells transfected with control siRNA or PCAT1 siRNA was measured by CCK-8 assay; C: the growth of Tca8113 cells transfected with control siRNA or PCAT1 siRNA was detect by colony formation assay; D: the growth of TSCCa cells transfected with control siRNA or PCAT1 siRNA was detected by colony formation assay. The scale bar=5 mm. Mean±SD. n=3.*P<0.05, ** P<0.01 vs control siRNA group.
3 PCAT1沉默对OSCC细胞的侵袭和迁移的影响
通过细胞侵袭及迁移实验分别检测OSCC细胞的侵袭及迁移能力。细胞侵袭实验结果显示, PCAT1 siRNA的转染能够抑制Tca8113及TSCCa细胞的侵袭数量(P<0.05),见图3A、B。细胞迁移实验结果显示,沉默Tca8113及TSCCa细胞的PCAT1表达可以抑制Tca8113及TSCCa细胞的迁移数量(P<0.05),见图3C、D。
4 PCAT1沉默对OSCC细胞上皮间质转化的影响
通过光学显微镜观察沉默PCAT1对 OSCC细胞的形态影响,结果显示转染PCAT1 siRNA的OSCC细胞一部分由纺锤形变成不规则多边形或圆形, 但变化不是非常明显,见图4A、B。通过检测EMT相关基因的表达水平来探讨PCAT1沉默对OSCC细胞 EMT的影响,RT-qPCR 结果显示PCAT1 siRNA的转染能够抑制Tsa8113及TSCCa细胞中的ZEB1、 N-cadherin和vimentin的mRNA表达,同时提高E-cadherin的表达水平(P<0.05),见图4C、D。 进一步的Western blot 结果显示PCAT1 siRNA的转染能够降低Tca8113及TSCCa细胞中的ZEB1、 N-cadherin和vimentin 的蛋白水平,同时提高E-cadherin的蛋白水平(P<0.05),见图4E、F。
讨 论
基因组学和转录组学的快速发展突出了非编码RNA在人类肿瘤中的重要作用。 lncRNA是长度超过200个核苷酸且没有蛋白质翻译功能的RNA分子。 据报道,lncRNA在多种细胞过程中起重要作用,如细胞生长、细胞凋亡、迁移,侵袭和自噬[9]。虽然已经报道了多种lncRNA调节肿瘤发生和转移,但是lncRNA在OSCC中的功能作用仍然很大程度上是未知的。本研究发现PCAT1在OSCC 细胞中表达上调,沉默PCAT1在 OSCC的表达能够抑制OSCC细胞的增殖、生长、侵袭及迁移,并且抑制OSCC的EMT。
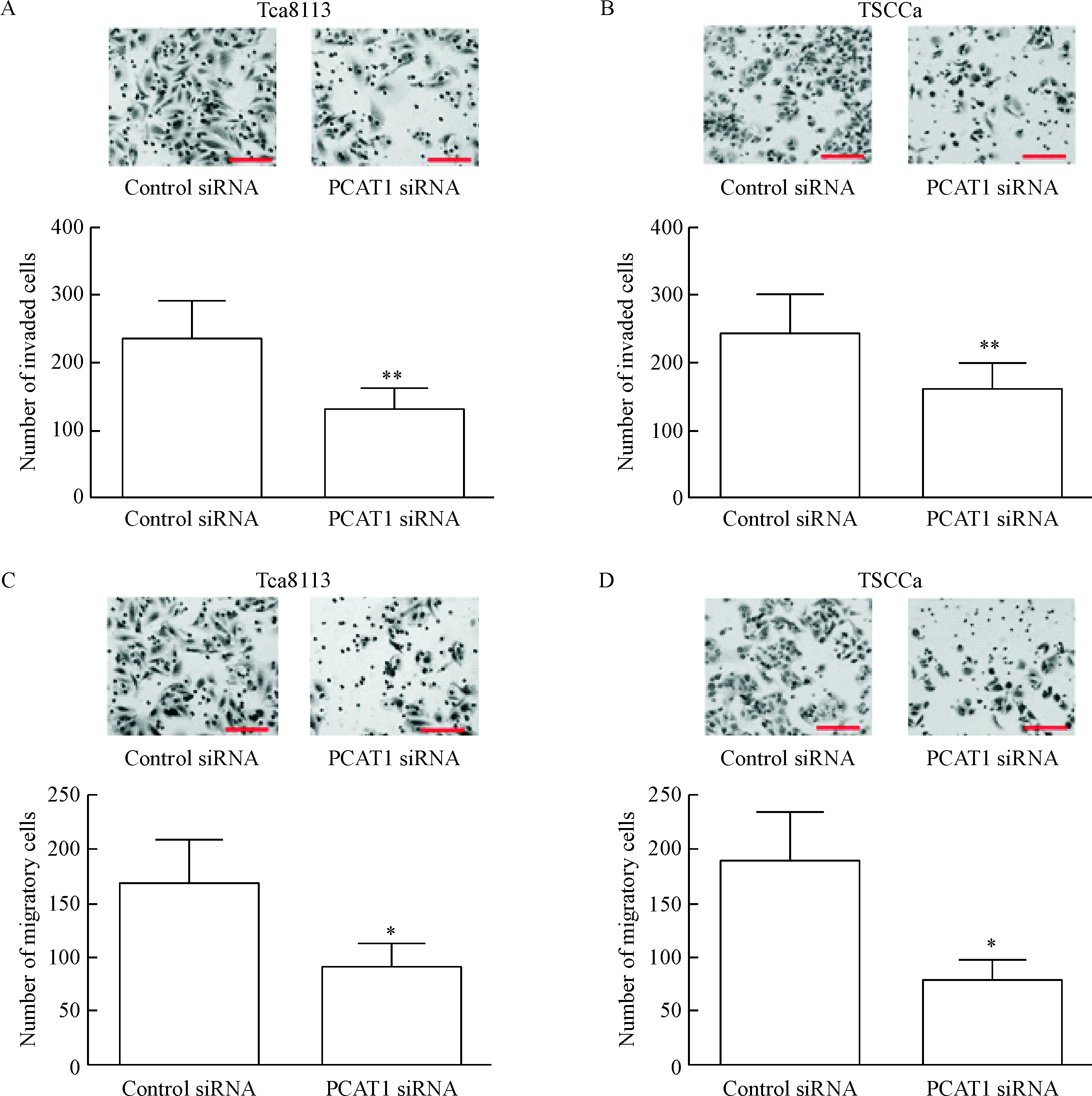
Figure 3.Silencing of PCAT1 inhibited OSCC cell invasion and migration. A: the invasion of Tca8113 cells transfected with control siRNA or PCAT1 siRNA was determined by cell invasion assay; B: the invasion of TSCCa cells transfected with control siRNA or PCAT1 siRNA was determined by cell invasion assay; C: the migration of Tca8113 cells transfected with control siRNA or PCAT1 siRNA was determined by cell migration assay; D: the migration of TSCCa cells transfected with control siRNA or PCAT1 siRNA was determined by cell migration assay. Mean±SD. n=3.* P<0.05, ** P<0.01 vs control siRNA group.
研究发现不同的lncRNAs通过不同的分子机制来调控OSCC的发生以及发展。Fang等[10]研究发现 lncRNA UCA1通过抑制miR-184的表达来促进OSCC细胞的增殖和顺铂耐药性。Liu等[11]发现lncRNA MEG3通过调控WNT/β-catenin信号通路抑制OSCC细胞的增殖和转移 。也有研究发现lncRNA HOTAIR通过招募EZH2以及抑制E-cadherin 促进OSCC细胞侵袭和转移[12]。最近研究发现lncRNA PCAT1 在多种肿瘤组织 (包括前列腺癌、肝癌、膀胱癌以及乳腺癌)中表达上调, PCAT1表达上调可以促进包括肝癌、前列腺癌细胞的增殖以及迁移[5-8]。Zhang等[13]研究发现PCAT1通过靶向调节miR-129-5p-HMGB1信号通路促进肝癌细胞的侵袭以及转移。Xu等[8]发现 PCAT1 能够通过靶向miR-145-5p来调控FSCN1基因从而促进前列腺癌的发展。Bi等[14]研究发现PCAT1过表达能够通过调控CDKN1A基因促进胃癌细胞的增殖以及转移。Huang等[15]发现PCAT1可以通过抑制p21的表达水平从而促进骨肉瘤的发生。 研究的结果与之前的研究一致的发现PCAT1沉默能够抑制OSCC细胞的增殖、生长、侵袭及迁移,提示PCAT1对OSCC的发生以及发展可能起到促进作用。
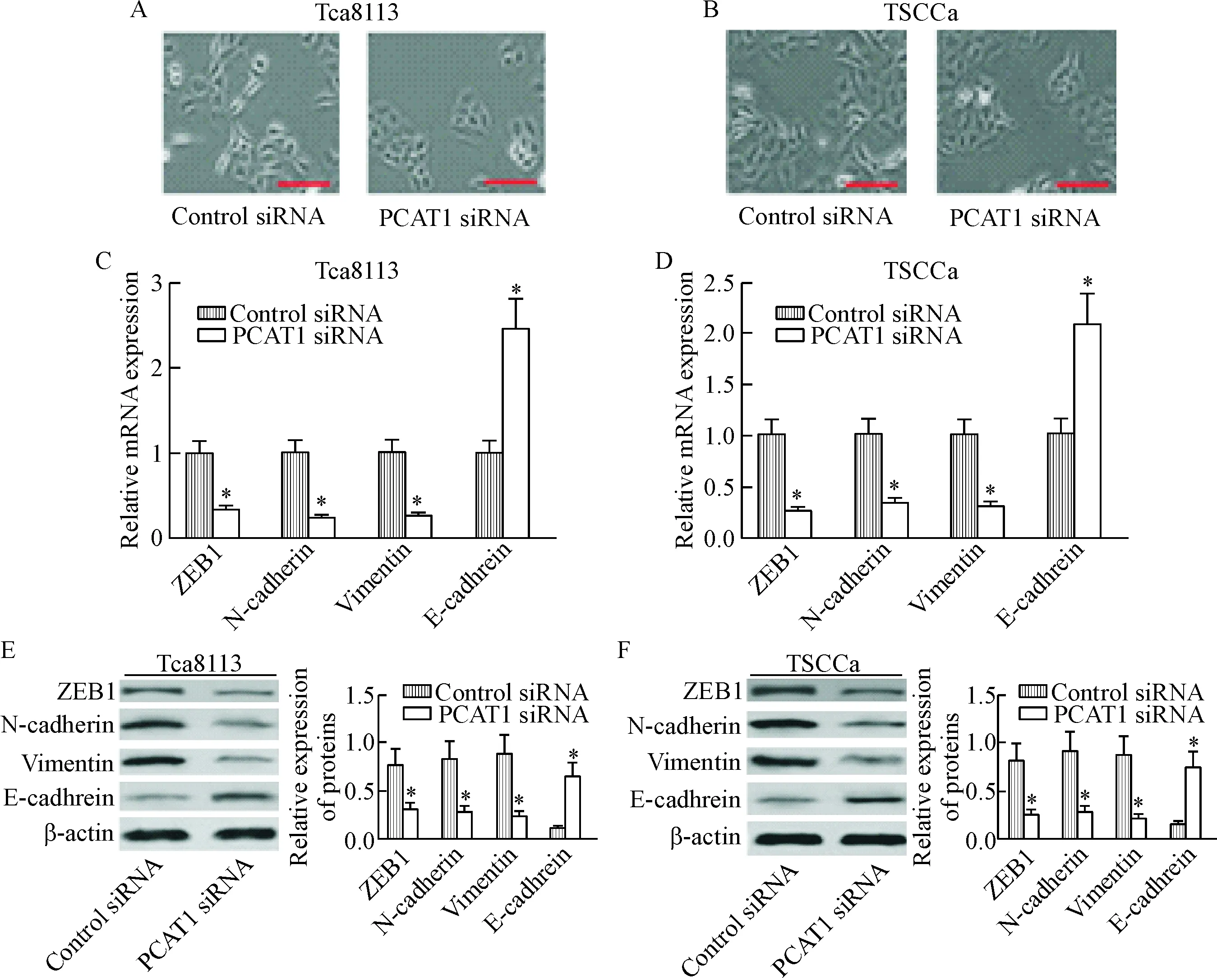
Figure 4.Silencing of PCAT1 inhibited EMT in OSCC cells. A and B: the morphological changes of Tca8133 and TSCCa cells transfected with control siRNA or PCAT1 siRNA was examined by light microscopy (the scale bar=100 μm); C: the mRNA expression of ZEB1, N-cadherin, vimentin and E-cadherin in Tca8113 cells transfected with control siRNA or PCAT1 siRNA was determined by RT-qPCR; D: the mRNA expression of ZEB1, N-cadherin, vimentin and E-cadherin in TSCCa cells transfected with control siRNA or PCAT1 siRNA was determined by RT-qPCR; E: the protein levels of ZEB1, N-cadherin, vimentin and E-cadherin in Tca8113 cells transfected with control siRNA or PCAT1 siRNA was determined by Western blot; F: the protein levels of ZEB1, N-cadherin, vimentin and E-cadherin in TSCCa cells transfected with control siRNA or PCAT1 siRNA was determined by Western blot. Mean±SD. n=3. *P<0.05 vs control siRNA group.
肿瘤转移是导致大多数癌症患者死亡的主要原因。作为恶性肿瘤的主要标志,转移是一个复杂的过程。EMT是促成肿瘤转移的最常见的细胞转移事件之一, 在EMT 的过程中促进细胞间接触的蛋白质如E-cadherin的表达下调,而间充质标志物,如vimentin和N-cadherin的表达上调[16-17]。Li等[18]研究发现lncRNA AC132217.4表达上调可以促进OSCC细胞的增殖以及EMT。也有研究发现lncRNA MALAT1通过诱导上皮间质转变换来促进OSCC细胞的生长和转移[19]。本研究进一步实验发现PCAT1沉默能够抑制OSCC细胞N-cadherin和vimentin的表达,同时促进E-cadherin的表达,提示PCAT1沉默能够抑制OSCC 细胞的EMT。
综上所述本研究的结果提示沉默PCAT1能够抑制OSCC细胞的增殖、生长及转移,PCAT1对OSCC细胞转移的作用可能与调控EMT有关。本研究仅仅从细胞层面研究了PCAT1对OSCC的作用,将来有必要进一步从体内实验以及临床研究来进一步确定PCAT1在OSCC的发生发展中的重要作用。

