左卡尼汀对糖尿病肾病大鼠的肾脏保护机制研究*
夏天皓, 金吉哲, 郑海兰, 朴尚国, 李锦姬, 李 灿
(延边大学附属医院肾病学科, 吉林 延吉 133000)
糖尿病(diabetes mellitus,DM)是导致终末期肾脏病(end-stage renal disease,ESRD)的重要原因。临床上尽管严格控制DM患者的血糖和代谢异常,但由于DM步入ESRD的患者比例仍高达40%[1-2]。糖尿病肾病(diabetic nephropathy,DN)是DM最常见且严重的一种微血管并发症,需昂贵的肾脏替代治疗维持生命,如透析和肾移植。因此,减少DN的发生不仅能改善DM患者的生活质量,亦可降低整个社会的负担。DN以肾小球炎症反应、系膜细胞增生和进行性肾小球硬化为典型的病理改变,最终导致蛋白尿和肾功能衰竭[3]。DN的发病机制极其复杂,由多种因素相互作用所致,其中包括炎症介质、致纤因子、氧化应激和细胞凋亡等[4-5]。
左卡尼汀(L-carnitine,LC)是一种季铵盐化合物,是长链脂肪酸进入线粒体基质内被氧化分解、为周围组织提供能量的重要铺助因子之一。LC可抑制氧自由基的产生,防止线粒体内脂肪酸β氧化损伤,修复组织氧化的脂质代谢[6]。有文献证实LC是清除氧自由基和 H2O2的清道夫[7-8]。由于LC具有抗氧化属性,常被用来防治胰岛素抵抗、糖尿病足细胞损伤及糖尿病所致血管内皮功能障碍[9-11]。我们曾报道LC可防治环孢素A导致的大鼠胰腺和肾脏损伤[12],类似的肾保护作用在缺血再灌注损伤[13]、造影剂肾病[14]、高血压性肾纤维化[15]、顺铂相关性肾病[16]和阿霉素相关肾病综合症[17]中均得到证实。本实验利用链脲佐菌素(streptozotocin,STZ)诱导的DN大鼠模型为研究对象,探讨LC对DN的肾脏保护机制。
材 料 和 方 法
1 实验动物、试剂和仪器
1.1实验动物 健康雄性SD大鼠(Charles River Technology),体重240~260 g,合格证编号为SPF2017005202,恒温恒湿饲养。
1.2试剂 LC(Sigma);STZ(Sigma-Aldrich);抗单核细胞趋化蛋白1(monocyte chemotactic protein 1,MCP-1)、Toll样受体2(Toll-like receptor-2,TLR-2)、Bcl-2、核因子κB(nuclear factor-κB,NF-κB)、NF-κB抑制蛋白(inhibitor of NF-κB,IκB)和WT-1抗体(Santa Cruz);抗ED-1 单克隆抗体(Serotec);抗转化生长因子β1(transforming growth factor-β1,TGF-β1)抗体(R&D Systems);抗TGF-β 诱导基因h3产物(TGF-β-induced gene h3 product,βig-h3)抗体(Proteintech);抗active caspase-3抗体(Millipore)。
1.3仪器 全自动生化分析仪(Coulter Electro-nics);彩色图像自动分析仪和数字化显微镜分析仪(Olympus);1200EX型透射电镜(JEOL);LKB-V型超薄切片机(LKB)。
2 动物分组与药物治疗
SD大鼠随机分为6组(n=8):(1)正常对照(control)组:正常大鼠静脉给予生理盐水(1 mL·kg-1·d-1);(2)LC50组:正常大鼠静脉给予LC (50 mg·kg-1·d-1);(3) LC200组:正常大鼠静脉给予LC (200 mg·kg-1·d-1);(4) DN组:DN大鼠静脉给予生理盐水(1 mL·kg-1·d-1);(5) DN+LC50组:DN大鼠静脉给予LC (50 mg·kg-1·d-1);(6) DN+LC200组:DN大鼠静脉给予LC (200 mg·kg-1·d-1)。
采用一次性腹腔注射STZ(65 mg/kg)诱导糖尿病模型,大鼠尾尖血测血糖值≥16.7 mmoL/L视为造模成功。造模2周后糖尿病大鼠给予LC治疗,共12周,在0、4、8、12周分别处死大鼠,收集血液、尿液和肾组织标本以备进一步检测。LC剂量选择基于以往报道[12]。该动物实验得到韩国加图立大学动物伦理委员会批准(CUMC-2016-0101-01)。
3 实验方法
3.1生化检测 定期测量各组大鼠的体重,分别在0、4、8和12周检测空腹血糖及24 h尿蛋白排泄率,12周处死各组大鼠,用全自动生化分析仪测定血肌酐(serum creatinine,SCr)。
3.2肾脏的病理组织学检查 各组大鼠肾组织由过碘酸-赖氨酸-多聚甲醛液固定,石蜡包埋后切片,行PAS染色,采用彩色图像自动分析仪高倍镜视野下分析肾小球硬化指数(glomerulosclerosis index,GSI)。每个标本至少观察40个非重叠肾小球并取平均数。
3.3免疫组织化学染色 石蜡包埋切片置二甲苯脱蜡,梯度乙醇脱水,37 ℃、0.3%过氧化氢/甲醛处理30 min后,PBS液洗 3 次。置微波炉中加热行波炉抗原修复(98 ℃、5 min)。室温下非免疫性血清封闭液20 min。在 4 ℃下滴加抗ED-1和 WT-1单克隆抗体孵育12~16 h。PBS 液洗3次后滴加 II 抗,室温孵育2 h。以DAB为底物显色,呈棕黄色为止。自来水流水洗涤,复染苏木素,常规树脂封片。染色程度用数字化显微镜分析仪的Polygon程序算出每0.5 mm×0.5 mm染色面积的百分比。
3.4电镜观察 取各组大鼠肾皮质组织在二甲胂酸钠溶液配制的戊二醛固定48 h,PBS冲洗3次,1% 锇酸固定2 h,双蒸水冲洗,常规脱水、环氧树脂定向包埋,先行半薄切片,甲苯胺蓝染色,光镜定位后行超薄切片,厚50~70 nm,醋酸铀和枸橼酸铅双染色,透射电镜观察。
3.5Western blot法测定蛋白水平 肾组织用蛋白质裂解液[10 mmoL/L Tris-HCl (pH 7.6)、150 mmol/L NaCl、1% sodium deoxycholate、1% Triton X-100、0.1% sodium dodecyl sulfate、1% aprotinin、2 mmol/L Na3VO4、1 mg/L leupeptin和1 mmol/L PMSF]制成匀浆,室温下离心(1 500 r/min)后,取上清液测定蛋白浓度(Bio-Rad),取20 μg标本行SDS-PAGE; 电转膜(90 V)2 h后,4 ℃下置抗MCP-1抗体于非脂牛乳中以1 ∶1 000浓度孵育12~16 h,室温下缓冲液洗3次,加辣根过氧化物酶标记的驴抗兔IgG(Amersham)孵育1 h;室温下缓冲液洗3次,增强发光(ECLTM,Amersham)和曝光。以对照组为标准(100%)测定条带的吸光度值,以β-actin为内参照。同样方法分别测定TLR-2、TGF-β1、βig-h3、Bcl-2、active caspase-3、NF-κB和IκB的蛋白水平。
4 统计学处理
采用SPSS 19.0软件进行统计学处理。计量资料以均数±标准差(mean±SD)表示。组间比较采用单因素方差分析(one-way ANOVA)和Bonferroni校正t检验,以P<0.05为差异有统计学意义。
结 果
1 LC对生化指标的影响
与control组相比,DN组大鼠体重下降,血糖升高, 24 h尿蛋白排泄率增加, SCr上升(P<0.05);与DN组相比,LC治疗除对血糖水平无明显作用外,均使上述指标逆转(P<0.05),见图1。
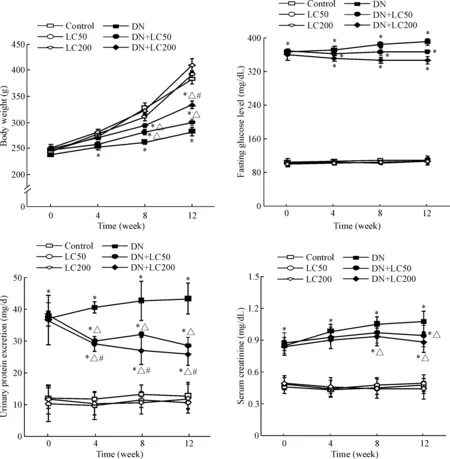
Figure 1.Basic parameters during the treatment period. Mean±SD. n=8. *P<0.05 vs control group; △P<0.05 vs DN group; #P<0.05 vs DN+LC50 group.
2 LC对肾组织病理学的影响
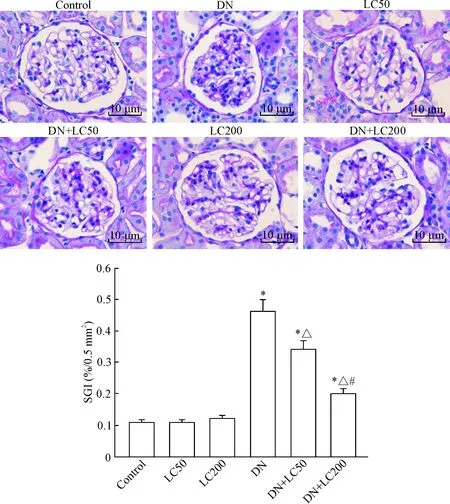
DN组大鼠肾小球系膜细胞和基质增生、基底膜增厚、肾小球硬化,LC治疗可明显改善肾小球硬化;半定量计分系统分析发现DN组GSI明显升高(与control组相比,P<0.05),低剂量LC治疗可明显减少GSI(P<0.05),而高剂量LC进一步减少GSI(P<0.05),见图2。免疫组织化学方法检测WT-1水平以观察足细胞损伤程度,与对照组相比,DN组肾小球内WT-1阳性细胞数显著减少(P<0.05),LC治疗有效地增加了WT-1阳性细胞数,呈剂量依赖性(P<0.05),见图3。电镜下观察发现DN组大鼠足突融合、增宽甚至消失,足细胞数明显减少,基底膜弥漫性增厚;LC治疗有效地保护了足细胞结构的完整性,见图4。
3 LC对炎症反应的影响
免疫组化结果示,正常肾小球偶见ED-1阳性细胞,而DN组ED-1阳性细胞数明显增多(P<0.05);LC随治疗剂量的递增肾小球ED-1阳性细胞数显著减少(P<0.05),见图5。Western blot法检测MCP-1和TLR-2表达,发现LC明显抑制MCP-1 和TLR-2蛋白的表达,呈剂量递减型(P<0.05),见图6。以上结果表明,LC对STZ诱导的DN具有抗炎作用。
4 LC对致纤因子表达的影响
TGF-β1在诸多肾脏疾病的硬化和纤维化中扮演着重要角色。本研究采用Western blot检测TGF-β1和βig-h3的表达,结果显示与control组相比,DN组的TGF-β1及βig-h3蛋白表达明显增加(P<0.05);LC在50 mg·kg-1·d-1的剂量时显著下调TGF-β1和βig-h3的表达,而在200 mg/kg/d的剂量时LC进一步下调它们的表达(P<0.05);直线回归分析提示肾小球硬化程度与TGF-β1(r=0.812,P<0.01)和βig-h3的表达(r=0.889,P<0.01)均呈正相关,见图7。
5 LC对NF-κB的作用
与control组相比,DN组NF-κB表达明显上调,IκB则明显下调;LC治疗抑制NF-κB表达(P<0.05),反之上调IκB的表达(P<0.05),此作用亦呈剂量依赖性,见图8。
6 LC对细胞凋亡的影响
抑凋亡蛋白Bcl-2的表达在DN组中明显减少(P<0.05),而活性caspase-3的蛋白水平明显增加(P<0.05),说明细胞凋亡参与了DN的发病;LC逆转DN 对Bcl-2和caspase-3蛋白水平的影响,有利于细胞生存,此作用在高剂量LC组尤为显著(P<0.05),见图9。
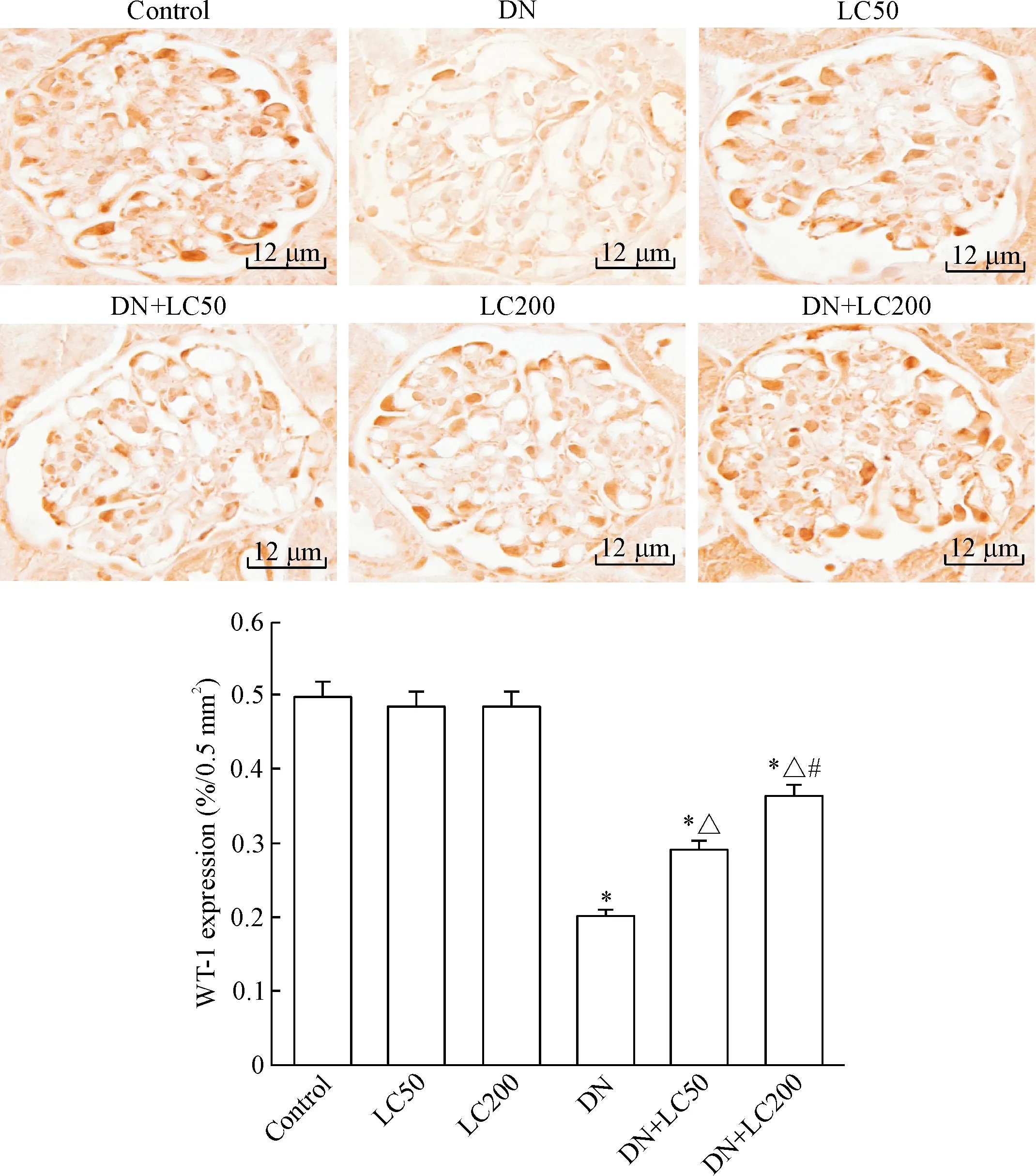
Figure 3.The representative photomicrographs of immunohistochemistry for determining the WT-1 expression in the renal tissues and semiquantitative analysis (×400). Mean±SD. n=8. *P<0.05 vs control group; △P<0.05 vs DN group; #P<0.05 vs DN+LC50 group.
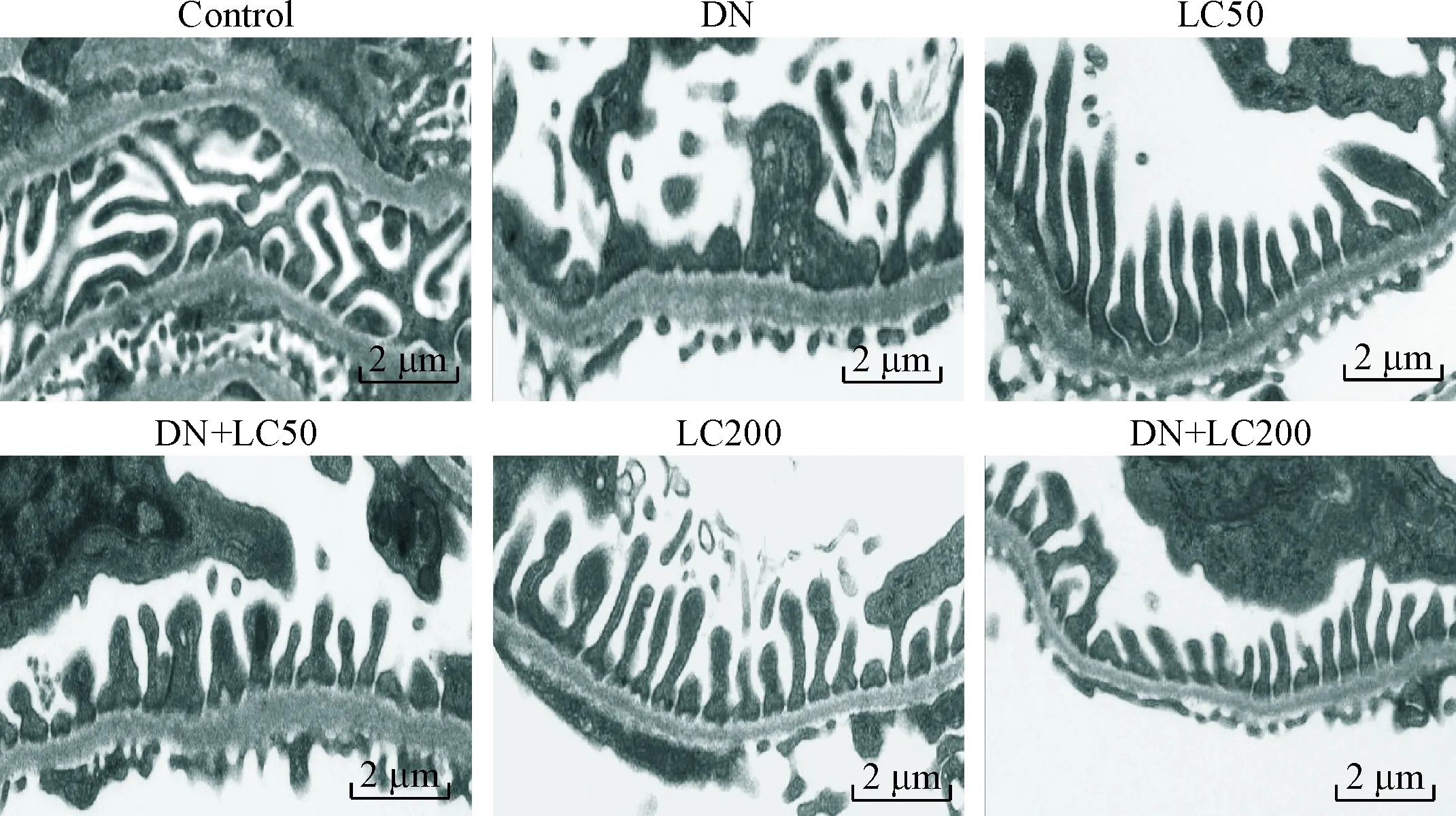
Figure 4.The representative photomicrographs of transmission electron microscopy for podocytes.
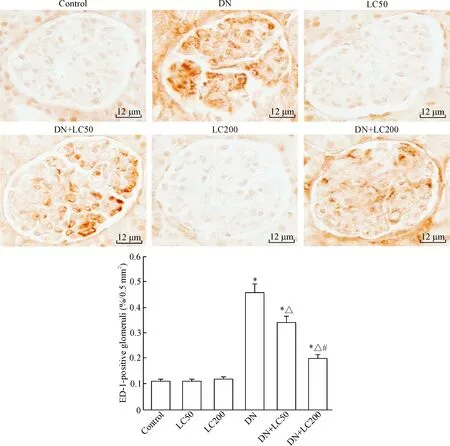
Figure 5.The representative photomicrographs of immunohistochemistry for determining the ED-1 expression in the renal tissues and semiquantitative analysis (×400). Mean±SD. n=8. *P<0.05 vs control group; △ P<0.05 vs DN group; # P<0.05 vs DN+LC50 group.
讨 论
LC 在环孢素A肾损伤和造影剂肾病中抑制MCP-1、TNF-α和IL-1 等炎性介质表达、减少巨噬细胞浸润、下调TGF-β1表达、防止细胞外基质沉积,表明在肾脏疾病中,LC具有抗炎、抗纤维化功能[12, 14]。本研究利用STZ诱导的大鼠DN模型,结果发现LC下调炎性介质MCP-1和TLR-2的表达,继之减少炎性细胞(ED-1阳性细胞)的浸润。此外,LC下调致纤因子TGF-β1的表达,随剂量依赖递减。这些分子水平上的变化伴随着蛋白尿的减少、肾功能的改善、肾小球硬化的减少。此结果与Shakeri等[18]在血液透析患者及Zambrano等[15]在高血压相关肾损伤动物模型中LC所发挥的肾脏保护作用机制相一致,表明LC在STZ诱导的大鼠DN模型中通过抑制MCP-1、TLR-2和TGF-β1的表达,从而减少肾脏炎症反应和硬化。
βig-h3是细胞外基质成分之一,与其它不同的基质成分或固有细胞相互连接构成各种器官或组织系统的构架包括肾脏,然而,对其确切的病理生理学作用尚不明确。但有证据显示,在慢性环孢素A肾毒性模型和DN中,βig-h3 和TGF-β1表达上调与小管间质纤维化及肾小球硬化密切相关[19]。因此,βig-h3 代表着TGF-β1的生物学活性,被认为是肾脏组织损伤程度的标志物[20]。在本研究中,我们发现DN肾脏中βig-h3表达明显增加接近2.5倍,伴随着TGF-β1的高表达,LC即使在低剂量下也显著抑制βig-h3和TGF-β1蛋白的表达,直线回归相关分析表明肾小球硬化程度与βig-h3(r=0.889,P<0.01)和TGF-β1(r=0.812,P<0.01) 紧密相关。综上我们推断LC减少DN的肾小球硬化与βig-h3紧密相关。
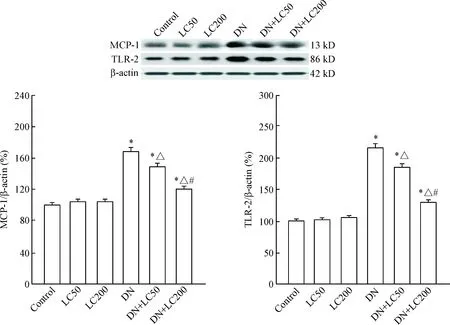
Figure 6.The protein expression levels of MCP-1 and TLR-2 were detected by Western blot. Mean±SD. n=8. *P<0.05 vs control group; △ P<0.05 vs DN group; # P<0.05 vs DN+LC50 group.
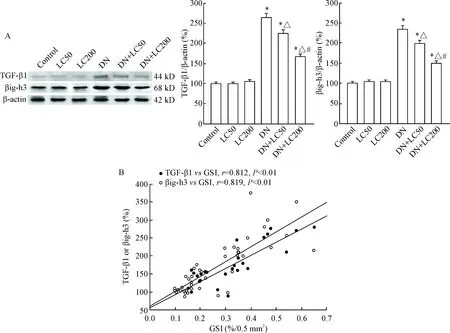
Figure 7.The protein expression levels of TGF-β1 and βig-h3 were detected by Western blot (A) and Pearson correlation analysis between GSI and TGF-B1 or βig-h3 (B). Mean±SD. n=8. *P<0.05 vs control group; △ P<0.05 vs DN group; # P<0.05 vs DN+LC50 group.
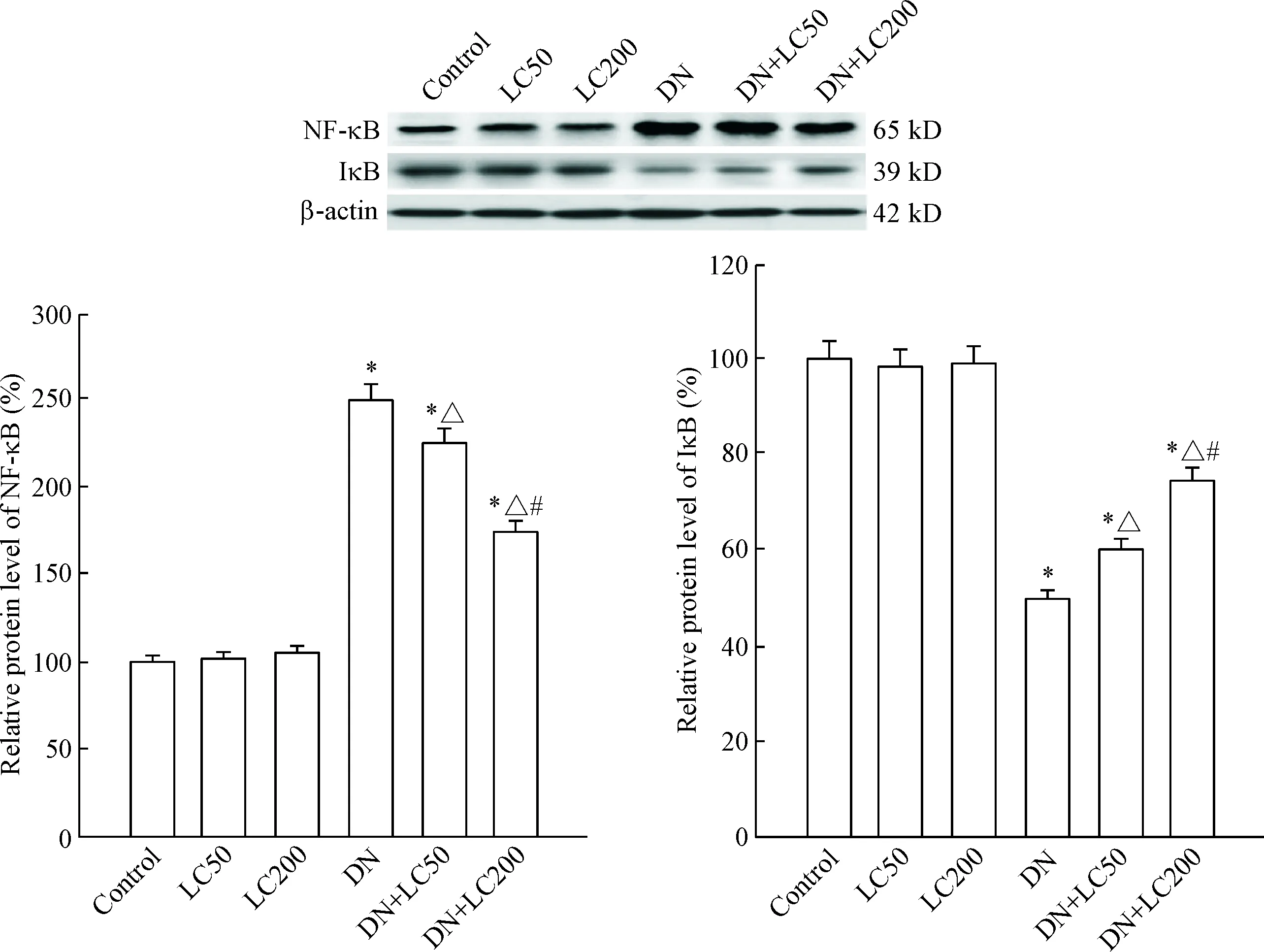
Figure 8.The protein expression of NF-κB and IκB was detected by Western blot. Mean±SD. n=8. *P<0.05 vs control group; △ P<0.05 vs DN group; # P<0.05 vs DN+LC50 group.
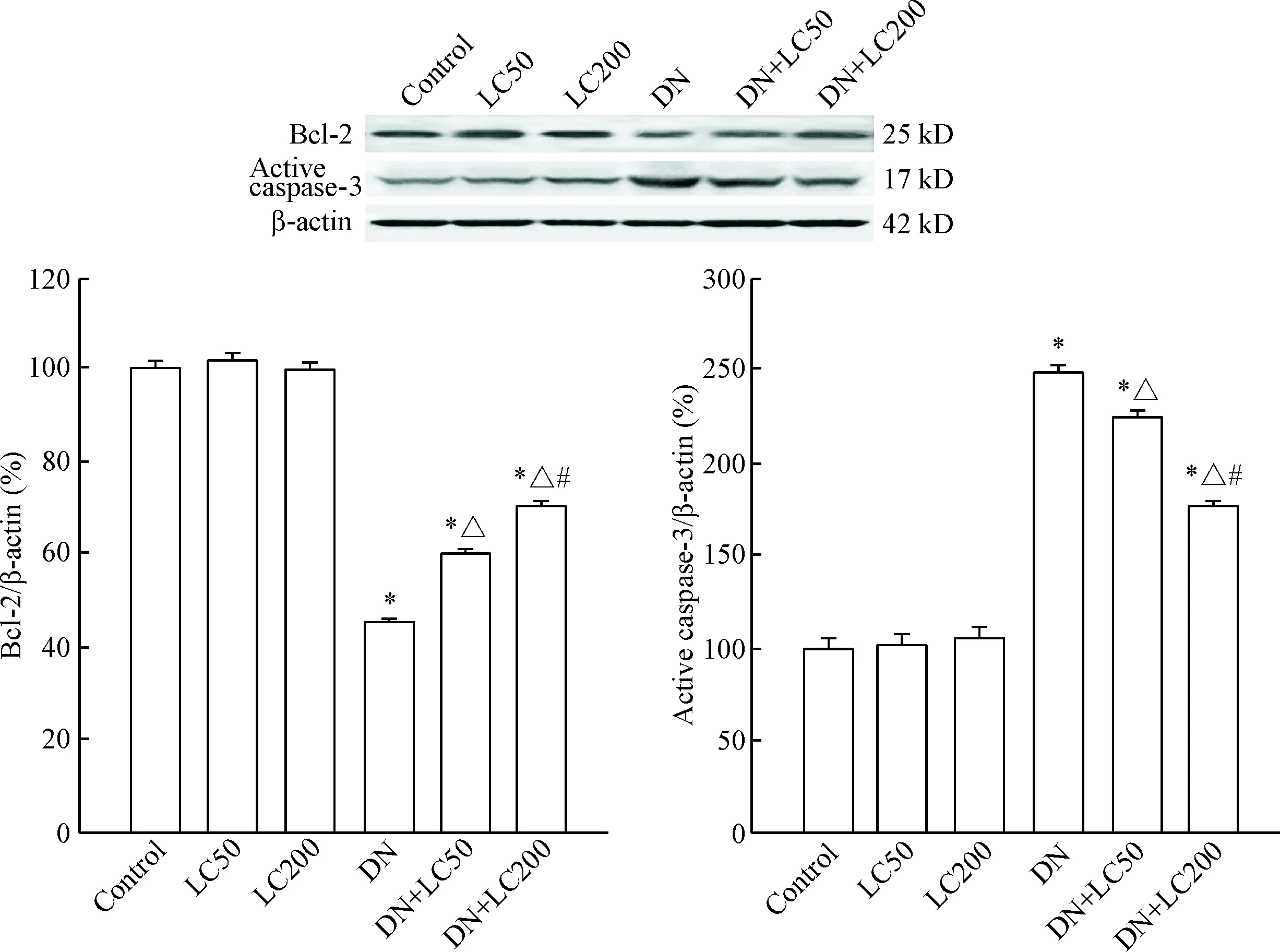
Figure 9.The protein expression of Bcl-2 and active caspase-3 was detected by Western blot.Mean±SD. n=8. * P<0.05 vs control group; △ P<0.05 vs DN group; #P<0.05 vs DN+LC50 group.
足细胞损伤是DN的主要特征之一,足细胞数目减少导致足突之间裂孔膜增宽是出现蛋白尿的重要原因[21]。在诸多细胞死亡的程序中(包括细胞凋亡和细胞自噬),细胞凋亡是导致DN足细胞数目减少的主要机制。研究发现,高浓度葡萄糖刺激体外培养的小鼠足细胞可诱发细胞凋亡。在Akita和db/dbDM小鼠中约有1/3足细胞发生凋亡,而这种现象先于足细胞数目减少且与蛋白尿的发生密切相关[22-23]。以往报道证实LC改善过氧化氢介导的人肾小管上皮HK-2 细胞凋亡,缓解庆大霉素诱导的肾小管上皮NRK-52E细胞凋亡[24-25]。本研究结果显示,LC治疗可调节细胞凋亡相关蛋白表达,即上调肾脏组织Bcl-2表达,抑制caspase-3活化,从而抑制足细胞凋亡,保持肾小球足细胞数量。免疫组织化学染色和电镜方法进一步确认LC治疗组增加足细胞(WT-1阳性细胞)的数目和完整性。
NF-κB被各种生理性及非生理性刺激所激活,调控诸多促炎症介质和促纤维化因子的转录和表达,在各种肾脏疾病的发生发展中扮演着关键性作用。众所周知,高糖状态可直接或间接地激活NF-κB信号通路,使足细胞及系膜细胞的MCP-1和TGF-β1过度表达,引起肾组织内一系列炎症反应,最终导致肾小球硬化及肾小管间质纤维化[26-27]。在造影剂肾病和卡铂所致肾损伤模型中,LC抑制 NF-κB活性,减少肾脏炎症反应及各种肾固有细胞凋亡,从而起到肾脏保护作用[14, 28]。在本实验中,LC下调DN大鼠肾NF-κB蛋白表达,相反激活IκB。因此,在STZ诱导的DM动物模型中,LC通过干预NF-κB信号通路起到抗炎和抗硬化作用。
临床常用LC治疗遗传性或血液透析相关的卡尼汀(肉毒碱)缺乏症。LC 具有抗炎和抗氧化应激作用,譬如LC 改善透析患者的血管内皮损伤、急性心肌梗死病人的室性心律失常和心绞痛发作、糖尿病人的周围神经病变、非酒精性肝脏脂肪变性[29-31]。根据以上效能结合本实验结果,我们推测,对DM患者尽管没有肾脏病变,早期使用LC 也可以获得意想不到的益处。总之,在 STZ 诱导的 DN 大鼠模型中,LC 减少蛋白尿,改善肾功能,具有肾脏保护作用,这将为临床上使用常用药防治 DN 提供有力的分子理论基础。

