槲皮苷通过抑制PI3K/AKT信号通路诱导胃癌SGC7901细胞凋亡*
陈龙云, 柳 叶
(湖北中医药大学 1基础医学院, 2检验学院, 湖北 武汉 430065)
胃癌是常见的消化道恶性肿瘤,病因复杂,在我国各种恶性肿瘤发病率中居第2位,据统计全球胃癌术后5年总生存率仅为10%~15%[1]。药物化疗是治疗肿瘤的3大手段之一,但大部分化疗药物毒副作用较强,对机体正常细胞伤害较大。天然抗癌化合物在过去几十年中对癌症的治疗做出了巨大贡献,因此对于天然抗癌化合物的发掘以及研究则十分重要。槲皮苷(quercitrin)即槲皮素-3-O-鼠李糖苷,是一种黄酮类单体化合物,广泛存在于植物中。有研究表明,槲皮苷具有降血脂、降血糖、抗氧化和抗病毒等作用[2]。近年来,越来越多的研究将槲皮苷药理活性研究延伸到肿瘤领域,比如Cincin等[3]研究发现,槲皮苷具有抑制结肠癌细胞增殖并促进其凋亡的作用;李玉英等[4]研究报道称,苦荞来源的异槲皮苷可诱导胃癌细胞发生凋亡,并抑制细胞增殖和迁移。然而有关其具体作用机制尚不明确。PI3K/AKT信号通路是参与细胞多重生命活动的关键细胞信号通路,在肿瘤的发展进程中起着重要作用。据报道,在很多肿瘤中(包括胃癌)均发现PI3K/AKT信号通路的过度激活[5-7]。因此,本研究拟采用PI3K/AKT激动剂胰岛素样生长因子1(insulin-like growth factor-1,IGF-1)干预PI3K/AKT信号通路,以探讨槲皮苷对人胃癌细胞SGC7901凋亡影响的分子机制。
材 料 和 方 法
1 材料与仪器
人胃癌细胞株SGC7901细胞购自中国科学院上海细胞生物学研究所。槲皮苷(纯度≥98%)购自阿拉丁试剂(上海)有限公司;IGF-1购自PeproTech;MTT和二甲基亚砜(dimethyl sulfoxide, DMSO)购自Sigma;DMEM培养基和胎牛血清(fetal bovine serum,FBS)购自Gibco;Annexin V-FITC/PI细胞凋亡检测试剂盒和细胞周期检测试剂盒均购自南京凯基生物科技发展有限公司;兔抗人cleaved caspase-3 多克隆抗体、兔抗人PI3K单克隆抗体和兔抗人AKT多克隆抗体购自Cell signaling technology;羊抗人p-PI3K (Tyr508) 多克隆抗体购自Santa;鼠抗人p-AKT(Ser473)多克隆抗体购自武汉三鹰生物技术有限公司;兔抗人GAPDH多克隆抗体购自杭州贤至生物有限公司。SDS-PAGE电泳仪(北京六一仪器厂);5415R台式冷冻离心机(Eppendorf);FACSCalibur流式细胞仪(BD);Multiskan MK3酶标仪(Thermo Fisher Scientific)。
2 方法
2.1细胞培养及分组 人胃癌细胞株SGC7901在含10%的胎牛血清、100 mg/L链霉素和1×105U/L青霉素的DMEM培养液中生长,并置于37 ℃、5% CO2、相对饱和湿度的孵育箱中培养,待单层细胞生长至90%左右的密度时,使用0.25%的胰酶消化传代。根据实验需求分为:(1)对照组(control组,不加药处理);(2)槲皮苷组(quercitrin组,200 μmol/L槲皮苷处理);(3)IGF-1组(100 μg/L IGF-1处理);(4)槲皮苷+IGF-1组(quercitrin+IGF-1组,200 μmol/L槲皮苷+100 μg/L IGF-1 共处理),处理时间为48 h。
2.2MTT法检测细胞存活率 取对数生长期的SGC7901细胞,调整细胞密度为1×108/L,接种于96孔板,37 ℃培养过夜。采用不同浓度的槲皮苷(0 μmol/L、25 μmol/L、50 μmol/L、100 μmol/L、200 μmol/L和400 μmol/L)处理细胞24 h、48 h和72 h;用不同浓度的IGF-1(0 μg/L、25 μg/L、50 μg/L、100 μg/L、150 μg/L和200 μg/L)处理SGC7901细胞48 h。加药培养结束后,在避光条件下每孔分别加入10 μL MTT,37 ℃培养4 h,然后吸出培养基,加入150 μL DMSO振荡10 min,待紫色甲臜颗粒充分溶解后,置于酶标仪上测波长为568 nm处的吸光度(A)值,取均值计算细胞相对活力,细胞相对活力(%)=(实验组A值-空白组A值)/(对照组A值-空白组A值)×100%,并采用SPSS 16.0软件Probit回归模型计算槲皮苷对SGC7901细胞的半数抑制浓度(half maximal inhibitory concentration,IC50)。
2.3AnnexinⅤ/PI双染流式细胞术检测细胞凋亡 取对数生长期的SGC7901细胞,以每孔1×104个接种于6孔板中,细胞分组加药处理48 h后,用0.25%胰酶(不含EDTA)消化细胞,消化结束后收集细胞,1 500 r/min 离心5 min 去上清;用预冷的PBS将细胞洗涤2次,调整细胞浓度为1×108/L,经离心、洗涤后加入500 μL孵育缓冲液悬细胞,加5 μL Annexin V-FITC混匀,再加5 μL PI充分混匀,避光孵育15 min,上流式细胞仪进行检测,实验重复3次。
2.4Western blot 检测蛋白表达 细胞分组加药处理48 h后,弃掉细胞培养基收集细胞,用预冷的1×PBS洗涤细胞2次,移至1.5 mL EP管中,4 ℃、13 000 r/min离心1 min,弃上清留细胞沉淀。按比例加入RIPA蛋白裂解缓冲液,冰上裂解30 min;每隔10 min将裂解液涡旋振荡1次;4 ℃、13 000 r/min,离心20 min,收集上清,然后通过BCA法测上清液中蛋白浓度。取25 μg 蛋白进行SDS-PAGE,待目的蛋白充分分离后停止电泳,取出凝胶用蒸馏水适当漂洗后转印于PVDF膜。转膜结束,将膜泡于含50 g/L脱脂奶粉的TBST中封闭1 h,分别加入抗cleaved caspase-3 多克隆抗体(1∶1 000)、兔抗人PI3K单克隆抗体(1∶1 000)、兔抗人AKT多克隆抗体(1∶1 000),羊抗人p-PI3K (Tyr 508) 多克隆抗体(1∶2 000)、鼠抗人p-AKT(Ser473)多克隆抗体(1∶1 000)和兔抗人GAPDH多克隆抗体(1∶1 000),4 ℃孵育过夜,再在室温下用Ⅱ抗孵育2 h,加 ECL显影液,用ImageQuant LAS 4000化学发光成像仪(GE Healthcare)曝光成像。采用BandScan 图像分析软件分析,以目的蛋白灰度值/GAPDH 灰度值的比值来表示。
3 统计学处理
实验数据通过 SPSS 16.0 统计软件进行统计分析,计量资料以均数±标准差(mean±SD)表示,多组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 槲皮苷和IGF-1对SGC7901细胞活力的影响
MTT法检测结果显示,随着槲皮苷浓度的升高,SGC7901细胞活力逐渐降低,具有剂量依赖性。当槲皮苷处理浓度为400 μmol/L时,细胞活力最低(P<0.05)。经计算槲皮苷作用48 h的IC50值为275.40 μmol/L。选择200 μmol/L槲皮苷分别处理SGC7901细胞24 h、48 h和72 h,细胞活力无显著性差异,见图1。综合考虑,将选择200 μmol/L的槲皮苷作用于SGC7901细胞48 h进行后续实验。随着IGF-1浓度的升高,细胞活力逐渐上升,当IGF-1浓度为100、150和200 μg/L时与0 μg/L比较细胞活力有显著差异(P<0.05),见图2。后续实验中将采用100 μg/L IGF-1处理细胞。
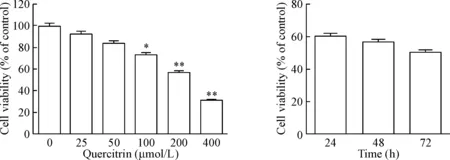
Figure 1.The effect of quercitrin on the viability of SGC7901 cells. Mean±SD. n=3. *P<0.05, **P<0.01 vs 0 μmol/L group.
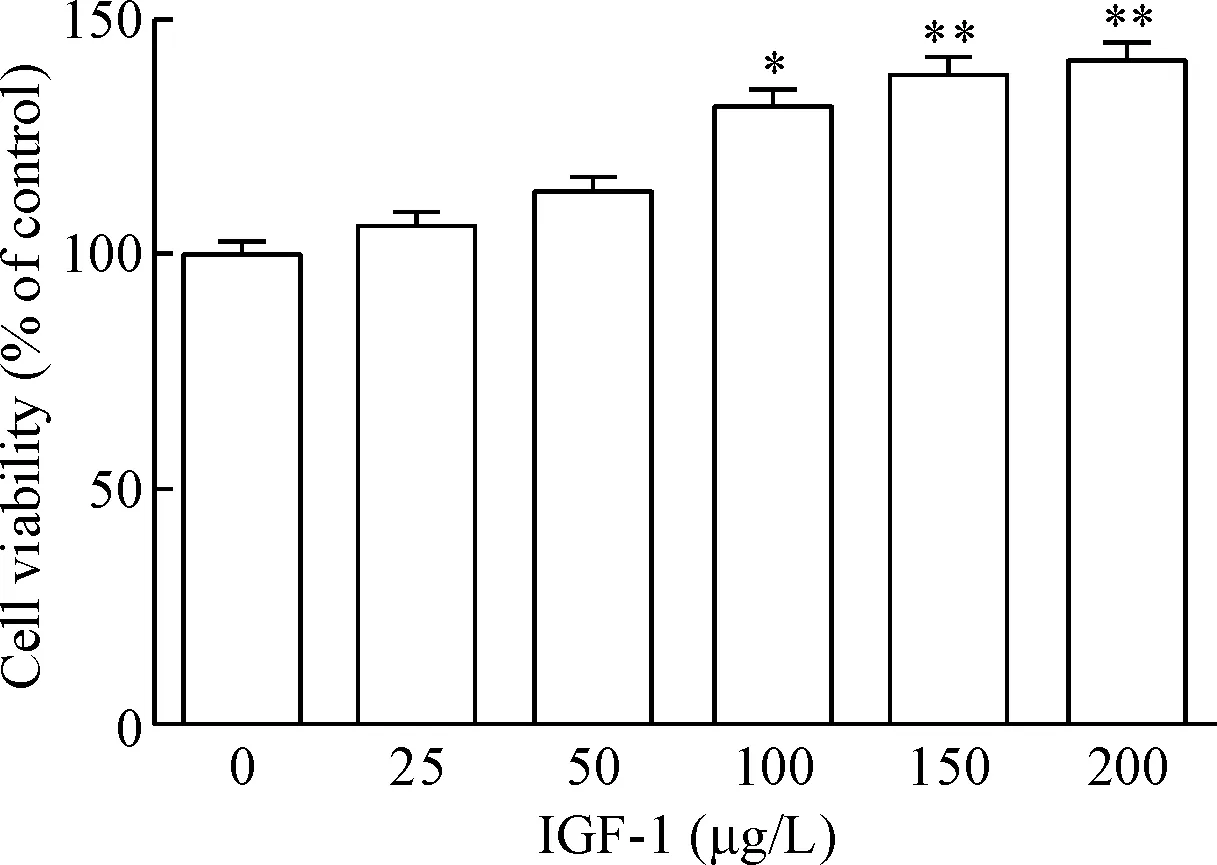
Figure 2.The effect of IGF-1 on the viability of SGC7901 cells. Mean±SD. n=3. *P<0.05, **P<0.01 vs 0 μg/L group.
2 槲皮苷对SGC7901细胞凋亡的影响
AnnexinⅤ/PI双染流式细胞术检测细胞凋亡结果示,采用200 μmol/L槲皮苷处理SGC7901细胞48 h后,quercitrin组细胞凋亡率显著高于control组(P<0.05);若200 μmol/L槲皮苷与100 μg/L IGF-1共处理SGC7901细胞48 h,结果显示quercitrin+IGF-1组细胞凋亡率显著低于quercitrin组(P<0.05)。Western blot结果显示,与control组比较,200 μmol/L槲皮苷处理SGC7901细胞48 h可显著上调cleaved caspase-3的表达(P<0.05);而与quercitrin组比较,槲皮苷与IGF-1共处理SGC7901细胞, quercitrin+IGF-1组cleaved caspase-3表达则又显著降低(P<0.05),见图4。
3 槲皮苷抑制PI3K/AKT信号通路的激活
Western blot结果显示,与control组比较,200 μmol/L槲皮苷处理SGC7901细胞48 h可显著降低p-AKT和p-PI3K的水平(P<0.05),而对于AKT和PI3K的表达无影响;而与control组比较,100 μg/L IGF-1处理可显著提高p-AKT和p-PI3K的水平(P<0.05)。200 μmol/L槲皮苷与100 μg/L IGF-1共处理SGC7901细胞48 h后,与quercitrin组比较, quercitrin+IGF-1组p-AKT和p-PI3K水平显著增加(P<0.05),见图5。
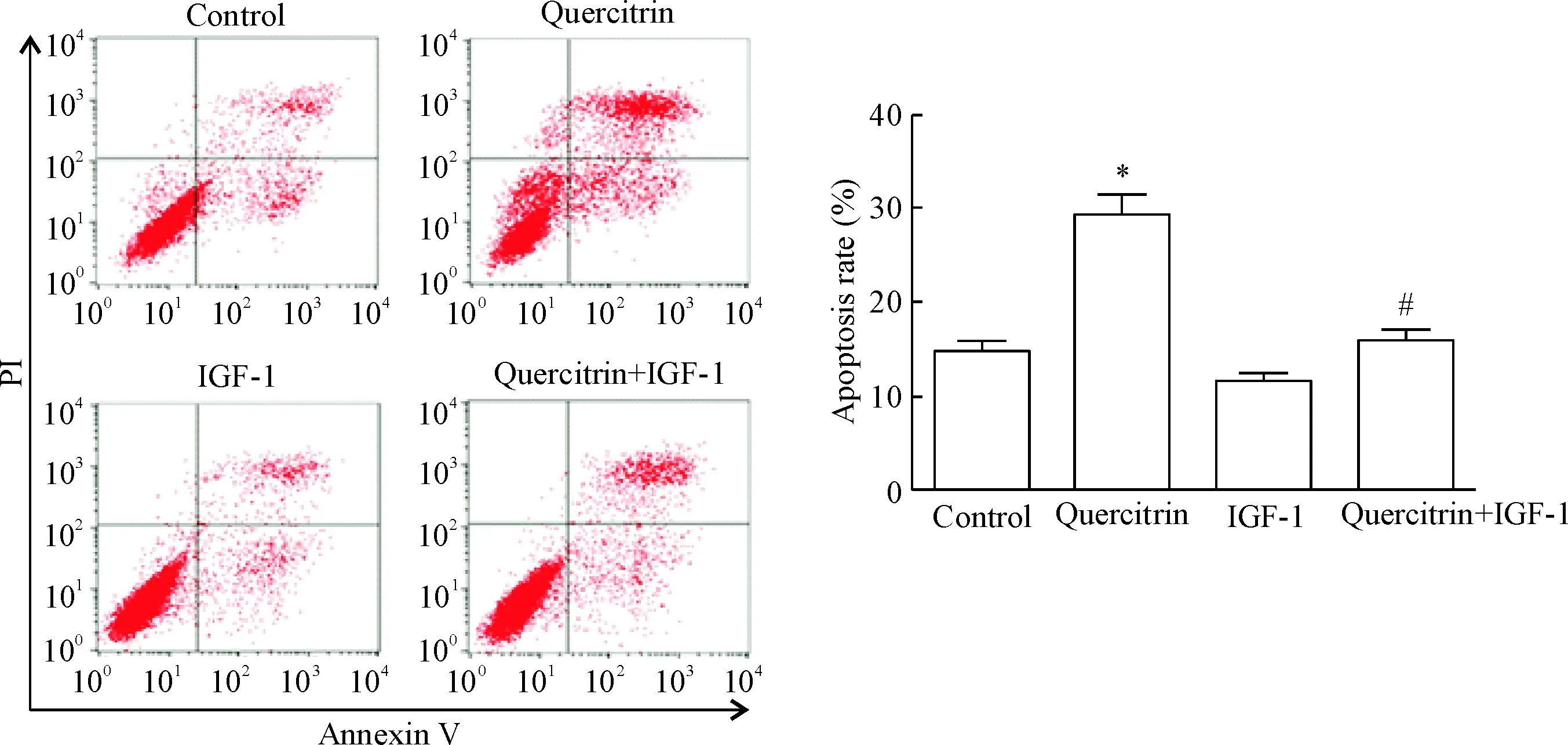
Figure 3.Quercitrin promoted apoptosis of SGC7901 cells. Mean±SD. n=3. *P<0.05 vs control group; #P<0.05 vs quercitrin group.
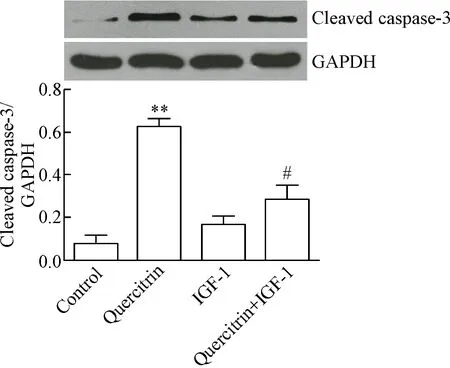
Figure 4.Quercitrin induced the activation of caspase-3. Mean±SD. n=3. **P<0.01 vs control group; #P<0.05 vs quercitrin group.
讨 论
胃癌是源于上皮的恶性肿瘤,具有较高的发病率和死亡率,一般多见于中年以后的男性。早期诊断相对困难,而待确诊时大多数已是癌症晚期,并且肿瘤细胞对放化疗极易产生抗性。因此,从植物中寻找高效的天然抗肿瘤药物成为近年来热门的研究方向。槲皮苷是一种广泛存在于植物中的黄酮类单体化合物,具有多种药理活性,并且还具有成本低、毒副作用小的优点。近期有研究发现其可以诱导胃癌细胞的凋亡[4],因此,槲皮苷可能在胃癌药物治疗方面具有潜在的应用价值。
细胞凋亡是机体细胞在正常生理或病理状态下发生的一种由基因控制的程序化死亡过程,是一种主动过程,涉及一系列基因的激活、表达以及调控等。许多天然抗癌药物都可以通过诱导肿瘤细胞凋亡而达到抑制肿瘤生长的目的[8-9]。本研究结果显示,槲皮苷可浓度依赖性地抑制胃癌细胞株SGC7901的存活,说明槲皮苷对SGC7901细胞具有一定的杀伤作用。流式细胞术检测结果表明,槲皮苷可诱导SGC7901细胞凋亡。同时,Western blot结果也证实,槲皮苷可诱导caspase-3激活,切割形成有活性的cleaved caspase-3,进而诱导细胞凋亡。说明,槲皮苷可以诱导SGC7901细胞发生凋亡。然而,对于槲皮苷诱导胃癌SGC7901细胞凋亡的机制研究鲜有报道。
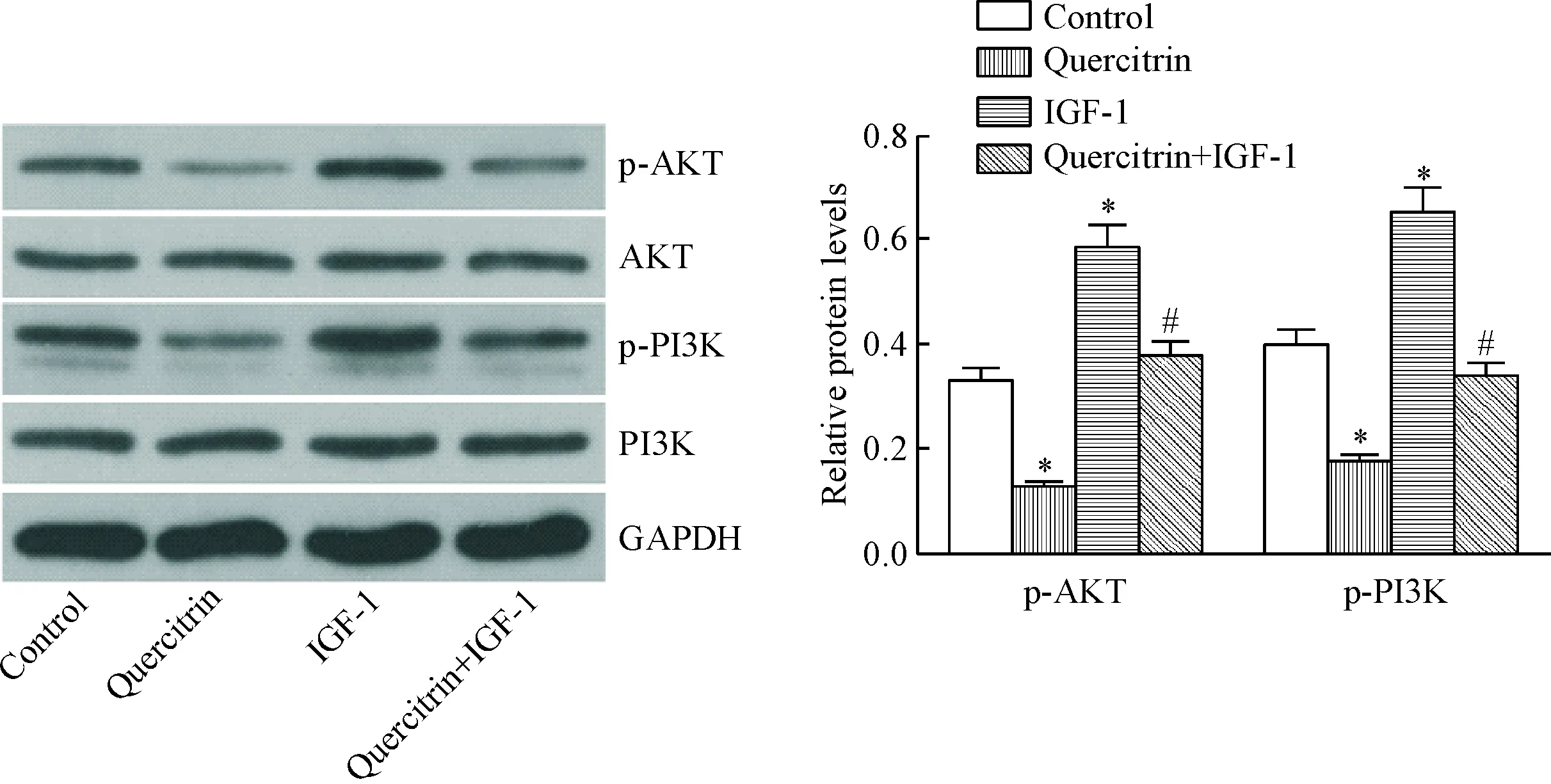
Figure 5.Quercitrin inhibited the activation of PI3K/AKT signaling pathway. Mean±SD. n=3. *P<0.05 vs control group; #P<0.05 vs quercitrin group.
PI3K/AKT信号通路是参与多重生命活动的关键信号通路,在肿瘤的发展进程中起着重要作用。有研究表明,PI3K/AKT信号通路与胃癌的发生、生长以及化疗耐药都有密切的关系[10]。PI3K/AKT信号通路的激活受多因素调节,活化的PI3K可以通过激活下游AKT的活化,活化的AKT通过磷酸化作用激活其下游与抗凋亡相关的靶蛋白Bcl-2的表达,进而发挥抗凋亡作用[11]。IGF-1是一个由70多个氨基酸组成的碱性蛋白质,对机体生长发育起着非常重要的调节作用。IGF-1可以使PI3K发生磷酸化而激活,并且引起下游AKT的磷酸化,常被作为PI3K/AKT通路的激动剂[12-14]。本实验结果显示,单独采用IGF-1处理SGC7901细胞,并不能引起SGC7901细胞显著凋亡,而采用IGF-1与槲皮苷共处理SGC7901细胞,则能显著抑制槲皮苷诱导的SGC7901细胞凋亡,亦显著抑制cleaved-caspase-3的表达。说明IGF-1可以抵消槲皮苷对SGC7901细胞的凋亡诱导作用。另外,槲皮苷可显著抑制p-AKT和p-PI3K的表达,说明槲皮苷处理可显著抑制SGC7901细胞中PI3K/AKT信号通路的活化,然而这种抑制作用可以被IGF-1所抵消。提示,槲皮苷诱导SGC7901细胞发生凋亡可能是通过抑制PI3K/AKT信号通路实现的。
综上所述,槲皮苷可诱导胃癌细胞株SGC7901细胞发生凋亡,其机制可能是槲皮苷可抑制PI3K/AKT信号通路激活,促进细胞凋亡。由此推断,阻断PI3K/AKT信号通路并诱导肿瘤细胞发生凋亡可能是槲皮苷抗肿瘤作用的分子作用机制之一。

