MicroRNA-146在糖尿病心肌病中的调控作用*
杨开雯, 强 郑, 靳贝芳, 靳文雨, 刘 昉△
(1桂林医学院基础医学院解剖教研室, 广西 桂林 541004; 2信阳职业技术学院医学院, 河南 信阳 464000)
糖尿病是当今威胁人类健康的重大疾病,超过1/3的糖尿病患者已有严重的并发症,严重威胁着人类生命安全和生活质量。研究表明,合并心血管系统并发症的糖尿病患者致死率增加 2 倍以上[1],其中糖尿病心肌损伤是糖尿病心血管并发症的重要组成部分。糖尿病心肌病(diabetic cardiomyopathy, DCM)是独立于高血压、缺血和心脏瓣膜疾病所导致的心脏结构和功能异常的心肌病,最终临床表现为充血性心力衰竭、心源性休克以及猝死[2]。微小RNA(microRNA,miRNA,miR)是一种长度为18~25个核苷酸的小分子,通过调节目标信使RNA来调节转录基因的表达。有数据显示,miRNAs参与30%~50%基因的表达调控[3-4]。近年来的研究显示心脏高丰度表达的miRNAs在各种心脏病的发病机制中扮演着重要角色。miR-146家族有miR-146a和miR-146b 2种,分别位于不同的染色体,在3’端“非种子区”有2个碱基不同。本研究拟探讨miR-146a和miR-146b在糖尿病导致的心肌损伤过程中的调控作用,以及其下游靶基因免疫调节相关分子TNF受体相关因子6(TNF receptor-associated factor 6,TRAF6)和白细胞介素1受体相关激酶1(interleukin-1 receptor-associated kinase 1,IRAK1)在糖尿病心肌损伤中表达情况,试图从miRNAs的角度寻找新的糖尿病心肌病变的发病机制和治疗方案。
材 料 和 方 法
1 动物分组与处理
SPF级雄性C57BL/6小鼠60 只,体质量约(19.00±3.67)g,购自湖南斯莱克景达实验动物有限公司,许可证号为 SCXK(湘)2016-0002。所有实验小鼠在桂林医学院动物实验中心适应性喂养 1周后,随机分为对照(control)组和糖尿病心肌病(DCM)组,每组30只,其中DCM组小鼠采用10 mmol/L链脲佐菌素(streptozotocin,STZ,Sigma-Aldrich)连续5 d腹腔注射并且给予高脂高糖饮食喂养制作1型糖尿病模型,注射剂量为50 mg/kg; control 组则注射同等剂量的枸橼酸钠缓冲液。注射1周后,尾静脉取血测量各组血糖水平。根据相关文献,啮齿类动物血浆葡萄糖浓度>16.7 mmol/L可认为糖尿病模型造模成功。每周监测随机血糖和体质量,并密切观察所有小鼠的基本情况。造模成功后 12 周末,对小鼠进行1次性腹腔注射 3%戊巴比妥钠麻醉,开胸取出心脏,一部分做成蜡块用于石蜡切片,另外一部分保存于-80 ℃冰箱中,用于后续的RT-qPCR及Western blot检测实验。
2 方法
2.1HE和Masson染色 (1)HE染色:石蜡切片经二甲苯脱蜡,依次梯度乙醇水化;苏木素液染色 5 min 后,流水冲洗 1~3 min;然后加 1%盐酸乙醇 2 s,流水冲洗 3~5 min;伊红染液复染 30 s 后脱水;最后用中性树胶封片; (2)Masson染色切片脱蜡至水,Masson 复合染液滴染 2 min,0.2%冰醋酸洗 3 次,共 1 min;0.1%磷钨酸分化 4 min,0.2%冰醋酸溶液洗 3 次,共1 min;亮绿染液染 1 min,0.2%冰醋酸洗 3 次,共 1 min,95%乙醇脱水 1 min,无水乙醇脱水 1 min,环保透明剂浸泡 5 min,最后用中性树胶封片; (3)图像分析:采用生物显微镜软件拍照,心肌细胞呈红色,胶原纤维呈蓝色条索状或均质结构,位于细胞间隙。采用ImageJ程序软件进行图像分析,胶原纤维染色面积占组织切片总面积的比例为胶原容积分数(collagen volume fraction,CVF)。
2.2RT-qPCR检测miR-146a和miR-146b及心房利钠肽(atrial natriuretic peptide,ANP)、β-肌球蛋白重链(β-myosin heavy chain,β-MHC)、IRAK1和TRAF6 mRNA的表达 从-80 ℃冰箱中取出保存的约 50 mg 小鼠心肌组织,按照 TRIzol(Invitrogen)法提取 RNA,用 NanoDrop 2000 分光光度仪(NanoDrop)检测 RNA 纯度和浓度。以 RNA 为模板,使用反转录试剂盒(TOYOBO)进行逆转录, 利用SYBR® Green Real-time PCR Master Mix 试剂盒(TOYOBO)检测miR-146a和miR-146b的表达水平及ANP、β-MHC、IRAK1和TRAF6 的mRNA 表达水平,其中, miR-146a和miR-146b以U6为内参照,反转录引物和PCR扩增引物购于RiboBio;ANP、β-MHC、 IRAK1及TRAF6以GAPDH为内参照,应用随机引物反转录,PCR引物购于Sangon Biotech。各基因引物序列采用 Prmier 3.0设计,见表1。

表1 RT-qPCR的引物序列
2.3Western blot检测小鼠心肌组织中IRAK1及TRAF6的蛋白表达 将小鼠心脏加入RIPA 裂解液(Santa Cruz),匀浆、离心后获得总蛋白。BCA法测定蛋白浓度后,使用 SDS-PAGE分离,电转印至 PVDF 膜上。5% 脱脂牛奶封闭后,分别加入抗IRAK1 (Cell Signaling Technology)、TRAF6(Abcam)和β-tubulin(Cell Signaling Technology)的I抗,4 ℃孵育12 h;TBST 洗涤后,加入II抗(中杉金桥),室温下孵育 60 min,ECL显色法显色,X线片曝光检测IRAK1和TRAF6的蛋白水平表达。
3 统计学处理
采用 SPSS 13.0 进行统计学分析,数据均采用均数±标准差(mean±SD)表示,2组间比较采用t检验。以P<0.05为差异有统计学意义。
结 果
1 小鼠代谢指标的变化
与control组比较, DCM组小鼠的血糖值稳步上升,并趋于稳定在高血糖范围(P=0.0011),见图1A;DCM组小鼠体重在建模早期与control组无明显差异,8周后呈现明显下降趋势(P=0.0039),见图1B;DCM组小鼠心脏重量与control组相比差异无统计学显著性,见图1C。我们进一步检测了心肌肥大的标志性因子ANP和β-MHC的mRNA表达情况,结果显示与control组相比,DCM组小鼠心肌组织中的ANP及β-MHC的mRNA水平显著升高(P<0.05或P<0.01),见图2。
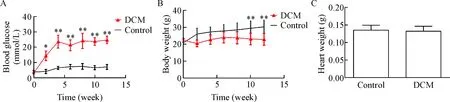
Figure 1.Blood glucose (A), body weight (B) and heart weight (C) in control group and DCM group. Mean±SD. n=6. *P<0.05, **P<0.01 vs control group.
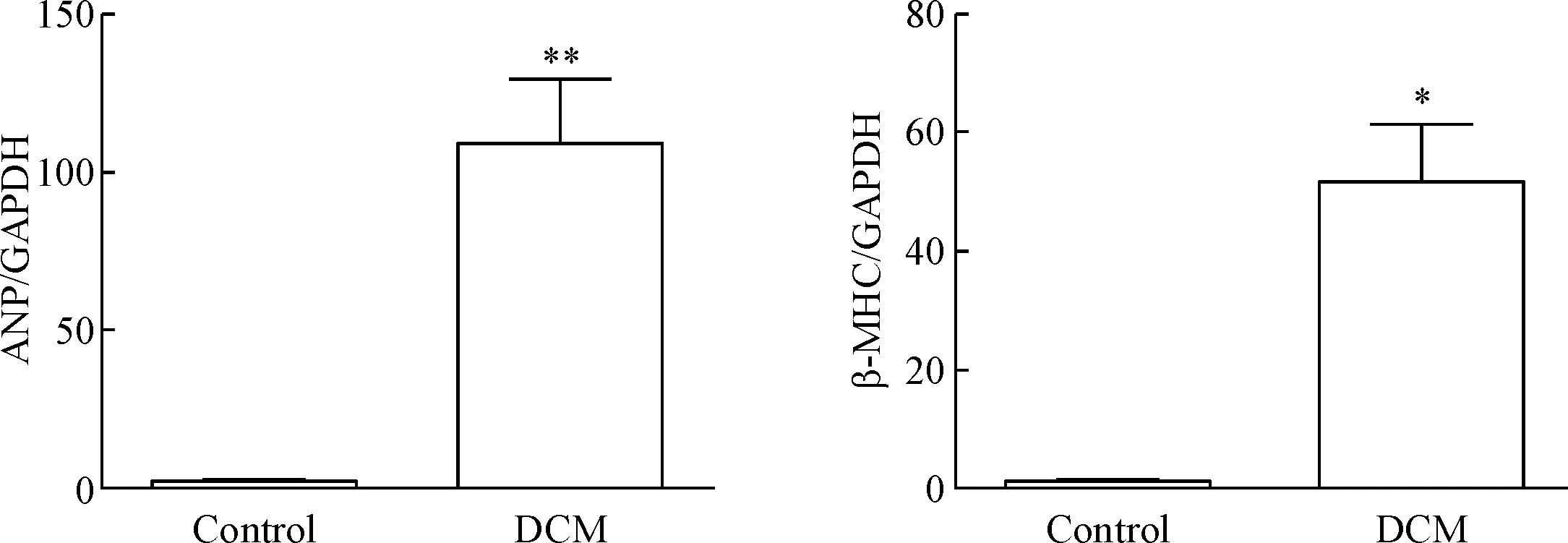
Figure 2.The mRNA levels of ANP and β-MHC in the heart of control group and DCM group. Mean±SD. n=6. *P<0.05, **P<0.01 vs control group.
2 小鼠心脏的病理变化
第 12周末小鼠心脏的 HE染色结果发现,与control组相比,DCM 组小鼠部分心肌细胞肥大,心肌结构紊乱,成纤维细胞明显增多,见图3。Masson 染色可见心肌纤维为暗红色,而胶原纤维为深蓝色,control组小鼠间质胶原纤维较少,且主要分布于大血管壁周围,DCM 组心肌内血管壁周围胶原纤维增多,在心肌细胞间隙内也出现大量胶原纤维,DCM组CVF较control组显著升高(P=0.0257),见图4。
3 小鼠心肌组织中miR-146的表达
RT-qPCR检测miR-146a及miR-146b的水平,结果表明,与control组相比,DCM组小鼠心肌组织中miR-146a及miR-146b的表达均显著减少(P<0.01),见图5。
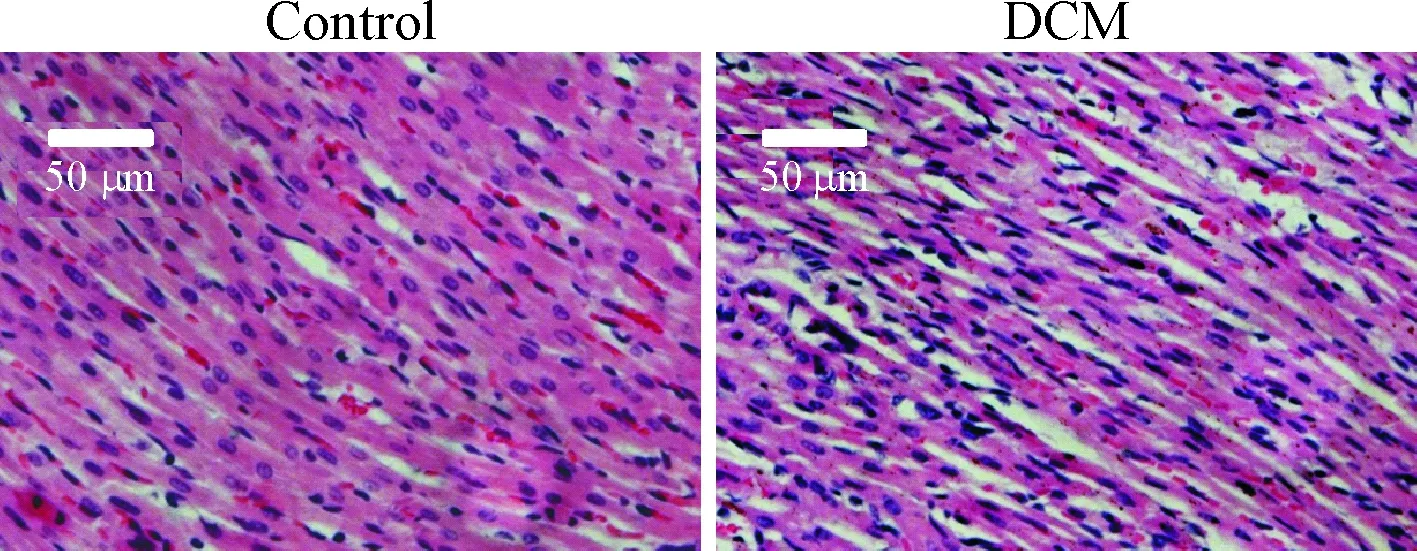
Figure 3.The cardiac pathological changes of control group and DCM group observed by HE staining (×20).
4 TRAF6及IRAK1 mRNA和蛋白表达的变化
RT-qPCR结果显示,与control组相比,DCM组TRAF6的mRNA表达显著降低,而IRAK1的mRNA表达显著增高(P<0.01或P<0.05),见图6。Western blot 检测TRAF6和IRAK1的蛋白表达水平与mRNA水平的变化趋势一致,与control组相比,DCM组小鼠心脏的TRAF6蛋白表达显著降低,IRAK1的蛋白表达显著增加(P<0.05),见图7。
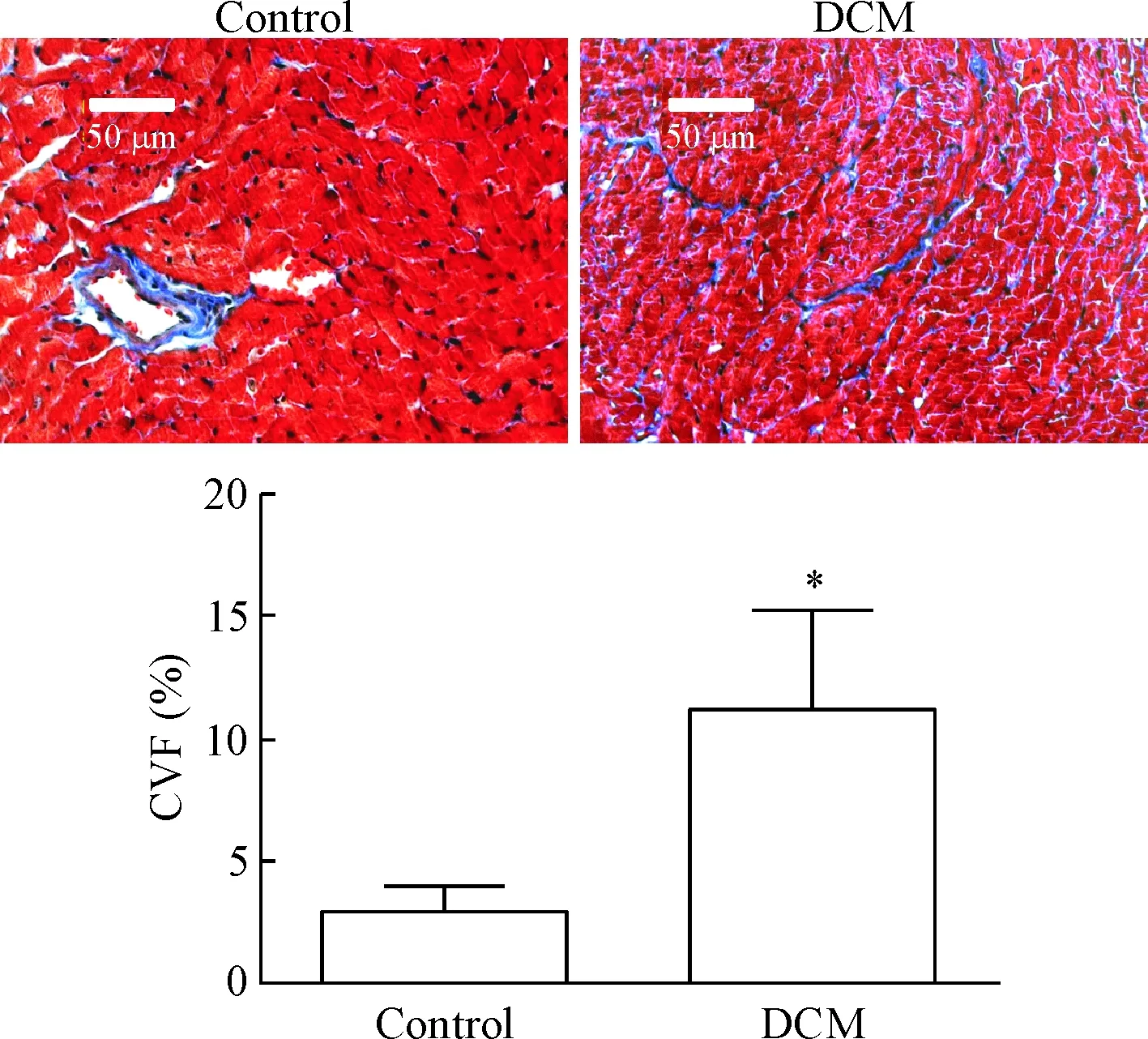
Figure 4.The cardiac pathological changes of control group and DCM group observed by Masson staining (×20). Mean±SD. n=6. * P<0.05 vs control group.
讨 论
在目前的研究中,STZ常用于破坏胰腺细胞,构建糖尿病模型,这种实验性糖尿病模型能够在很长一段时间内保持稳定,死亡率较低[5];此外,这种模型在短时间内很容易诱发1型糖尿病,与非肥胖糖尿病患者[6]的糖尿病非常相似。在本研究中,空腹血糖的研究结果与之前的实验结果一致[7-8],并证实了1型糖尿病的诱导成功。另外心肌细胞肥大相关基因ANP和β-MHC的mRNA表达显著升高,符合体外研究动物糖尿病心肌病早期心肌细胞肥大的病理特征及心肌病理变化的动态过程[9],说明糖尿病实验组小鼠心脏出现了心肌肥大等糖尿病心肌损伤的典型症状。
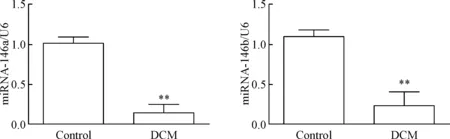
Figure 5.The expression of miR-146a and miR-146b in the heart of control group and DCM group detected by RT-qPCR. Mean±SD. n=6. ** P<0.01 vs control group.
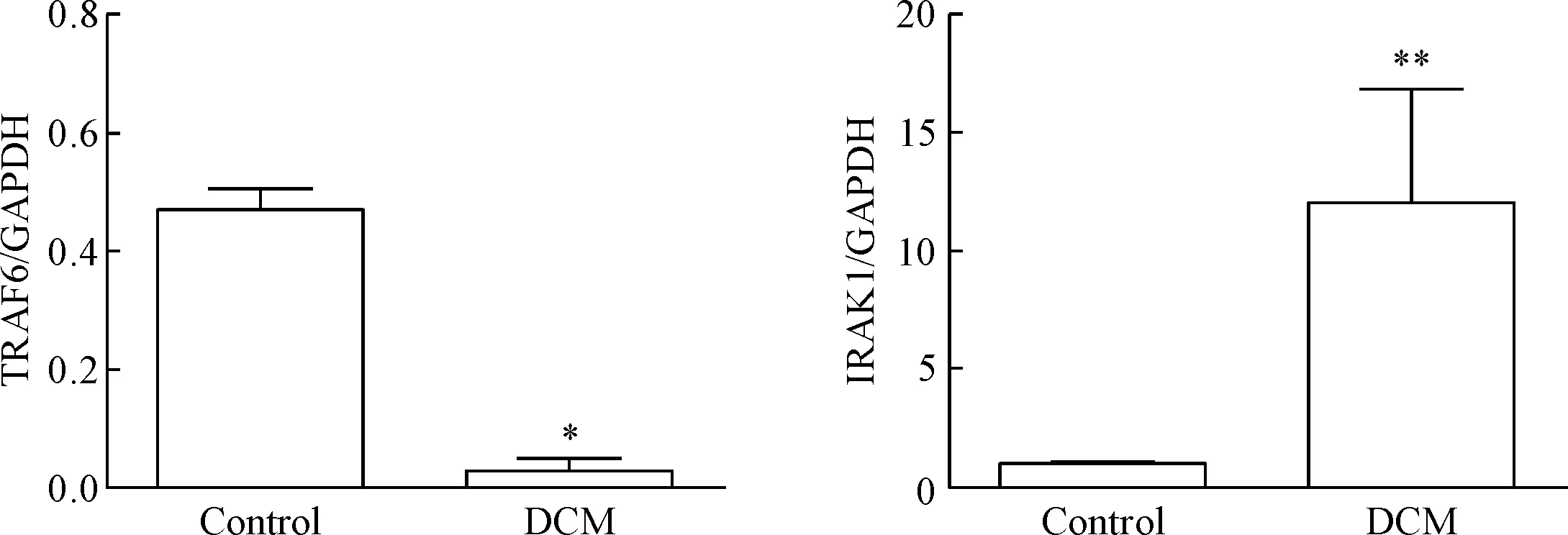
Figure 6.The mRNA levels of TRAF6 and IRAK1 in the mouse myocardium of control group and DCM group. Mean±SD. n=6. *P<0.05, **P<0.01 vs control group.
非编码RNA尤其是miRNAs是转录后基因表达的主要调控因子,多数情况下与信使RNA的3’-UTR结合,通过降解信使RNA或抑制转录从而调控基因的表达[10],一些特殊的miRNAs参与糖尿病的慢性并发症[11-14],如在先前的研究中,miR-146a在糖尿病肾[15]和糖尿病患者[16-17]的血浆和角膜上皮组织表达增加,在糖尿病大鼠的主动脉和坐骨神经[18-19]中表达下调;miRNA-146b在人和小鼠的心肌炎[20]和自发性心肌肥大和心衰小鼠[21]的心脏中表达上调。
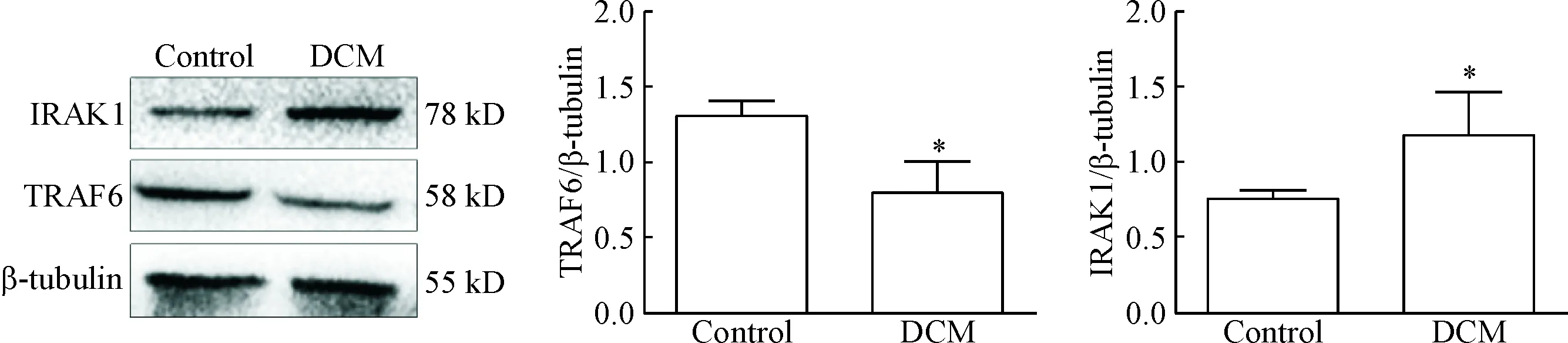
Figure 7.The protein levels of TRAF6 and IRAK1 in the mouse myocardium of control group and DCM group. Mean±SD. n=6. *P<0.05 vs control group.
2型糖尿病与慢性低水平炎症的相关性具有典型性,miR-146在2型糖尿病患者血清中表达减少被认为是慢性炎症的标志[22]。但是在1型糖尿病中,根据胰腺组织的损伤情况来看,这种炎症反应很可能也存在于1型糖尿病中[23-25]。根据文献报道,TRAF6和IRAK1为miR-146的靶基因[26],miR-146可以通过结合下游靶基因特定的3’-UTR来调节基因的表达,而且TRAF6和IRAK1是炎症调控相关因子,在糖尿病心肌病的发病过程中也可能起重要作用。本研究中,糖尿病实验组小鼠心脏中的miR-146a和miR-146b表达均显著降低,这很可能是1型糖尿病小鼠心脏出现慢性炎症的一个标志。本实验中,糖尿病实验组小鼠心肌组织中TRAF6表达较control组显著降低,而IRAK1的表达显著升高。IRAK1为白细胞介素受体相关激酶,是促炎症因子,也是TLR/IL1R炎症信号通路的主要介质,参与IL-1诱导的NF-κB上调调控通路,在吴铿等[27]的研究中, DCM能上调TLR4表达。本研究中,糖尿病心肌病小鼠miR-146表达降低,而IRAK1的表达明显升高,因此在糖尿病心肌病小鼠心肌组织中miR-146对IRAK1可能也存在负调控作用。也有报道显示miR-146可以通过抑制Toll样受体(Toll-like receptors,TLR)信号通路调节Th1[28]细胞以应对炎症刺激。TRAF6也是NF-κB信号通路中的转导因子,但是在本实验结果中TRAF6的表达水平降低,这可能与炎症反应调控的时点有关,这提示,在心脏中miR-146可能只调控IRAK1的表达,TRAF6可能受到其它miRNAs的负向调控。在有关干燥综合征的研究中,miR-146也只是负反馈调节IRAK1,对TRAF6的调控不明显[29],这与我们的研究结果类似。 关于糖尿病心肌病的炎症网络调控机制还有待深入研究。
总之,目前的研究结果表明miR-146参与糖尿病心肌病的发生发展,另外,在2型糖尿病中,miR-146被认为是炎症反应的血清标志物,这也显示了miR-146及其下游信号导致糖尿病的慢性炎症和胰岛素抵抗。细胞培养和动物模型表达的研究,将有助于确定miR-146的确切作用,以及它与糖尿病炎症和胰岛素抵抗的相关性。血清可检测到的microRNA可能为疾病检测、监测和个性化药物提供一种潜在的非侵入性措施。未来的研究将证明,在增强miR-146表达或调节miR-146信号时,能够改变糖尿病心肌病变中炎症介质的产生,减少炎症和胰岛素敏感性的作用,以防止糖尿病心脏发生炎症变化。

