DJ-1保护多巴胺能神经元抵抗过氧化氢氧化应激损伤的研究
胡霞,陈方方,孔陈苏
(1.四川省八一康复中心、四川省康复医院神经内科,四川 成都 611135;2.新疆维吾尔自治区鄯善县人民医院医务部,新疆 鄯善 838200)
帕金森病(PD)是老年人常见的运动障碍。其主要病理特征是纹状体中多巴胺能神经元的退化和坏死。临床表现为肌僵直、静止性震颤等。目前国内外帕金森病的发病机制一直处于探讨中,而在临床治疗上也缺乏有效的抗氧化应激以及神经保护治疗措施[1-4]。PD形成的重要原因与α-突触核蛋白的异常聚集相关,这更容易在氧化应激环境中聚集和促进多巴胺能神经元的进行性退化和坏死[5]。DJ-1蛋白参与基因转录、信号转导、维持mRNA的稳定性以及参与抗氧化应激等过程。在对抗氧化应激治疗中,氧化应激的敏感性的增加是由于DJ-1基因的缺陷引起的[6-7]。此外,DJ-1基因可保护细胞免受大鼠多巴胺能神经元细胞系和原代多巴胺细胞过氧化氢(H2O2)氧化应激诱导的细胞凋亡[9-10]。本研究自2016年1月至2017年7月建立了用H2O2处理的PC12多巴胺能神经元的体外氧化应激模型,探讨 DJ-1对多巴胺能神经元氧化应激损伤的保护作用与机制,为PD的发病机制和治疗方法提供理论依据。
1 材料与方法
1.1主要仪器和试剂冷冻高速离心机,购买于Thermo Fisher公司;酶标仪,购买于Bio-rad公司;荧光显微镜,购买于Olympus公司;荧光定量PCR仪,购买于Bio-rad公司;蛋白电泳仪,购买于Bio-rad公司。
大鼠嗜铬细胞瘤细胞系(PC12细胞)及胎牛血清(Gibco)购买于中国科学院上海细胞研究所;H2O2购买于上海远大公司;DHE超氧阴离子荧光探针购买于碧云天公司; DJ-1抗体、TH蛋白抗体和β-actin抗体购买于Abcom公司;CCK-8试剂盒购买于BBI life sciences公司;RNA提取试剂盒购买于上海杰瑞生物技术有限公司;逆转录和定量PCR试剂盒均购买于TAKARA。
1.2PC12细胞培养及诱导分化将 PC12细胞系置于 RPMI1640培养基中(含有10只灭活的小牛血清,青霉素100 U·mL-1,链霉素100 U·mL-1, L-谷氨酰胺0.12 g·L-1, NaHCO33 g·L-1),37 ℃,5% CO2的培养箱中培养。将100 μg·L-1神经生长因子(NGF)加入PC12细胞培养基中进行分化。隔天更换培养液,培养液中事先加入 NGF,诱导分化进行8 d。形态学鉴定后,将已经分化成多巴胺能神经元细胞的PC12细胞系进行后续实验。
1.3H2O2诱导的氧化应激损伤模型在96孔板中接种 PC12细胞,处理组分别加入50、100、150 μmol·L-1的H2O2,空白对照组不加H2O2,在1.5 h和3 h后分别采用 CCK-8法检测 PC12细胞活性。
1.4DJ-1过表达载体的构建DJ-1基因序列由Bioengineering Biotechnology(Shanghai)Co.,Ltd。合成和限制性内切核酸酶KpnI和XbaI设计在序列的两端。随后将片段连接到pCDH1-cmv载体上。采用氨苄青霉素用于筛选阳性克隆抽提质粒,进行DNA序列测定,验证基因序列和表达框是否正确。
1.5细胞内活性氧(ROS)水平检测处理3 h后,加入用50、100、150 μmol·L-1H2O2处理的PC12细胞培养基,并用PBS洗涤2次。随后用5 μmol·L-1的DHE染色30 min,DAPI染核。在荧光显微镜下观察拍照。
1.6PI/Hoechst染色法检测细胞凋亡在96孔板中接种 PC12细胞,处理组分别加入50、100、150 μmol·L-1的H2O2,空白对照组不加H2O2,反应24 h。PI / Hoechst染色显微镜下观察PC12细胞凋亡,计算细胞凋亡率。
1.7蛋白质免疫印迹法(WesternBlot)检测使用RIPA裂解物裂解细胞,裂解上清液并使用BCA试剂盒测量蛋白质浓度。通过半干电泳将SDS-PAGE凝胶电泳应用于PVDF膜,并将第一抗体在4 ℃温育过夜,将第二抗体温育1 h,然后显影并暴露。抗体使用稀释比分别为:DJ-1 1∶1 000,TH蛋白抗体 1∶2 000,β-actin 1∶2 000。
1.8荧光定量PCR用不同浓度的H2O2处理PC12细胞3 h后,提取总RNA,用TAKARA逆转录试剂盒将500 ng总RNA逆转录成cDNA。稀释5倍后用荧光定量 PCR检测。所用PCR引物如为,DJ-1正向引物:5′-GGTCCTACTGCTCTGTTG-3′,DJ-1反向引物:5′-GTTGTGACTTCCA-TACTTCC-3′;Caspase-3正向引物:5′-AGAGCTGGACTGCGGTATTGAG-3′,Caspase-3反向引物:5′-GAACCATGACCCGTCCCTTG-3′;α-synuclein正向引物:5′-CCTCAGCCCAGAGCCTTTC-3′,α-synuclein反向引物:5′-CCTCTGCCACACCCTGCTT-3′;Bax正向引物:5′-ACACCTGAGCTGACCTTGGA-3′,Bax反向引物:5′-CCGTGTCCACGTCAGCAATC-3;Bcl-2正向引物:5′-AAGCTGTCACAGAGGGGCTA-3′,Bcl-2反向引物:5′-GACGGTAGCGACGAGAGAAG-3′;p53正向引物:5′-GTACCGTATGAGCCACCTGAG-3′,p53反向引物:5′-CGTCCCAGAAGATTCCCAC-3′;β-actin (内参)正向引物:5′-AGAAAATCTGGCACCACACC-3′,β-actin (内参)反向引物:5′-CTCCTTAATGTCACGCACGA-3′。
1.9统计学方法实验数据由SPSS 13.0软件进行统计学分析。通过单因素方差分析(ANOVA)分析组间比较的结果,并通过SNK-q检验进行两组之间的比较。以P<0.05被认为差异有统计学意义。
2 结果
2.1H2O2对PC12细胞增殖活性的影响分别用不同浓度的H2O2处理PC12细胞1.5 h和3 h,用CCK-8试剂盒检测细胞增殖活性。结果如图1所示,PC12细胞的活性随H2O2浓度的升高逐渐降低。当H2O2浓度大于100 μmol·L-1时,细胞活性低到一定水平继续升高H2O2浓度对细胞活性的影响不大。

注:与0 μmol·L-1的H2O2处理1.5 h组相比较,aP<0.05
图1H2O2处理对PC12细胞增殖活性影响
2.2H2O2处理对PC12细胞凋亡的影响用不同浓度H2O2处理PC12细胞24 h后,PI结果显示,PI阳性细胞的随H2O2浓度的升高而增多,H2O2浓度大于100 μmol·L-1时,超过80%的细胞呈PI阳性,即100 μmol·L-1H2O2可以引起大部分细胞发生凋亡。
2.3H2O2对DJ-1表达的影响TH蛋白是多巴胺合成的限速酶[11],而PD的病理学特征之一是纹状体多巴胺含量显著减少,所以TH蛋白的表达量是PD的一个重要参数。Western blot检测发现,随着H2O2处理浓度的升高,TH蛋白表达量逐渐减少(图2)。
2.4过表达DJ-1对H2O2诱导的PC12细胞凋亡的影响用pCDH1-cmv过表达载体表达DJ-1,转染到PC12细胞中,pCDH1-cmv空载体组作为对照组,过表达DJ-1组作为实验组。用100 μmol·L-1的H2O2处理PC12细胞24 h,用PI/Hoechst染色法检测细胞凋亡情况。结果显示相对于对照组,DJ-1组细胞的凋亡率降低超过50%,见图3。

注:与对照组相同H2O2浓度相比较,aP<0.05
图3DJ-1对H2O2诱导的细胞凋亡的影响(DHE染色×100)
2.5过表达DJ-1对细胞内ROS水平的影响H2O2处理PC12细胞3h,pCDH1-cmv空载体组作为对照组,过表达DJ-1组作为实验组。细胞内的ROS水平用DHE探针检测。结果是经过100μmol·L-1H2O2处理后,对照组ROS水平在上升。而在过表达DJ-1后,ROS上升却受到了抑制,见图4。
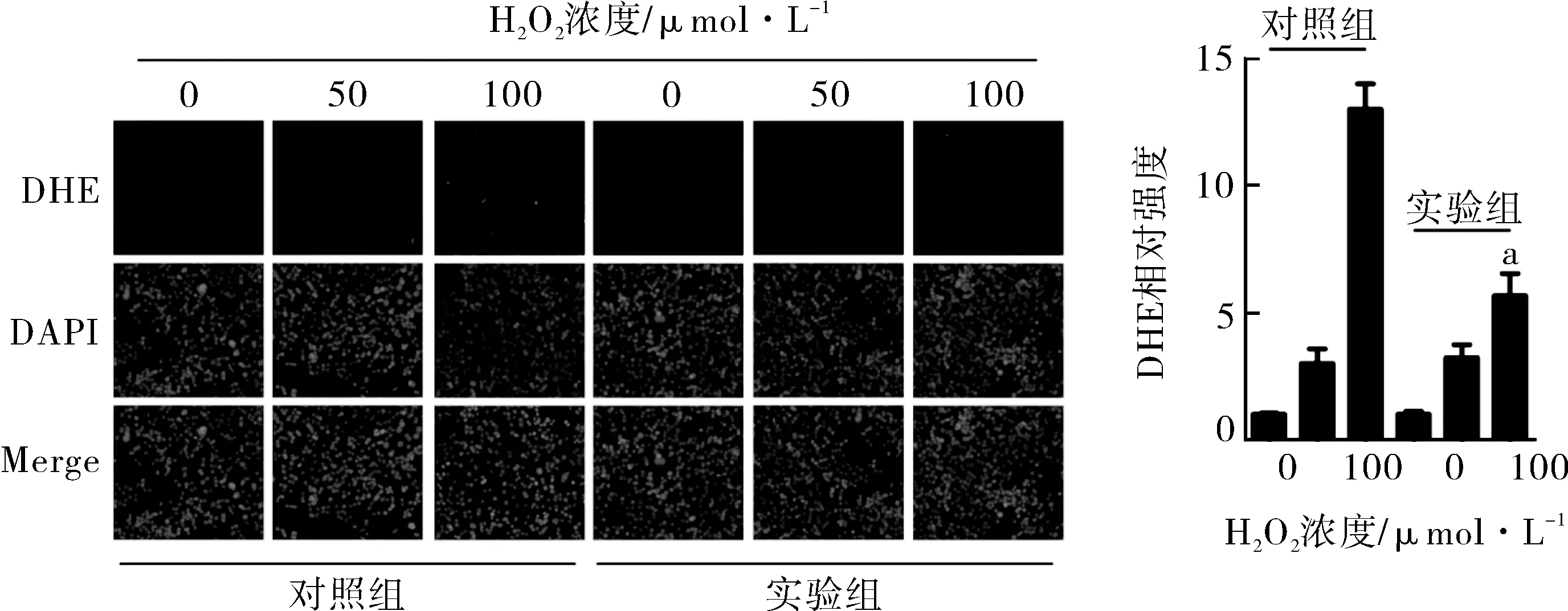
注:与对照组相同H2O2浓度相比较,aP<0.05
图4DJ-1对H2O2细胞内ROS水平的影响(DHE染色×100)
2.6过表达DJ-1对H2O2中凋亡基因表达的影响
pCDH1-cmv空载体作为对照组,过表达DJ-1作为实验组,用不同浓度的H2O2处理细胞3 h,并用RT-qPCR检测相关基因的表达变化。结果显示,随着H2O2浓度的升高,α-synuclein的表达逐渐增加。同时凋亡相关基因Bax,p53和caspase-3的表达增加,而Bcl-2的表达减少。这些基因的表达变化也许是细胞出现凋亡的主要原因。过表达DJ-1后,α-synuclein表达升高幅度变小。凋亡基因Bax,p53和caspase-3的表达不再随H2O2浓度的升高而增加,H2O2对Bcl-2的下调作用也被减弱(图5)。
3 讨论
PD是一种神经退行性疾病,其主要病理特征是纹状体,尤其是黑质多巴胺能神经元(DA),它们是退行性缺陷。大量文献证实,纹状体中多巴胺及其代谢物的减少是由于TH的丧失引起的,导致一系列病理和临床症状[12]。形态学研究报道了PD患者脑内多巴胺能神经元凋亡的显著变化[13-14]。目前PD黑质多巴胺能神经元凋亡的一个重要因素被认为是由氧化应激引起的活性氧的增加[15-18]。研究表明,多巴胺类固醇和细胞毒性物质如 H2O2和超氧化物是H2O2对多巴胺神经细胞的损害[19],在黑质铁离子催化下产生有毒的羟基受损细胞会使多巴胺能神经元置于氧化应激状态[20]。DA本身还可以与谷胱甘肽结合形成谷胱甘肽-多巴胺,从而减弱PD患者脑内的抗自由基能力,增强氧化应激损伤作用[21];此外,由氧化应激引起的DA神经元中α-突触核蛋白的异常修饰和聚集破坏了细胞内DA的自我平衡[22]。DA的氧化产生细胞毒性物质并且增加细胞自身的氧化应激的损害。使得其持久损害神经元[23]。

注:与0 μmol·L-1H2O2处理组相比较,aP<0.05
图2Western blot检测H2O2对DJ-1和TH蛋白表达的影响

注:与对照组相同H2O2浓度比较,aP<0.05
图5RT-qPCR检测DJ-1对H2O2中凋亡基因表达的影响
DJ-1基因位于人染色体1p36.26.3处,全长是24 kb。有8个外显子,其中外显子1A和1B不参与蛋白质的编码,编码DJ-1蛋白含有外显子2-7[24]。研究表明, DJ-1可以控制多个抗凋亡的基因,除此之外,还发现在体内 DJ-1和体外 DJ-1,他们与 p53均相互作用影响, UV暴露条件下,过表达 DJ-1能够明显抑制 p53的转录活性,这导致 Bax表达降低并且还抑制胱天蛋白酶-3活性,最终导致小鼠神经母细胞瘤细胞的凋亡[25]。另有研究表明, DJ-1在细胞内外均具有与多个目的 RNA结合的能力,不乏包括 PTEN/ PI3 K通路上成员、线粒体基因以及谷胱甘肽代谢基因。在氧化应激状态下,纳摩尔浓度水平的DJ-1即可发挥上述作用,但有致病性的突变会使其失活,从而上述作用被抑制[26]。
在这里,神经生长因子(NGF)用于诱导PC12细胞进入具有长树突的多巴胺能神经元。建立了H2O2诱导的PDPC12细胞氧化应急损伤模型。结果表明,H2O2可显著抑制PC12细胞的增殖活性。 DHE染色显示H2O2处理后 PC12细胞内 ROS水平显著升高,在长时间的H2O2处理后能够诱导细胞凋亡,即在H2O2的处理后可以造成 DJ-1蛋白和 TH蛋白的表达下调。过表达DJ-1后,PC12细胞对H2O2的耐受力升高,细胞内的ROS升高受到抑制。DJ-1可以抑制α-突触核蛋白的表达水平,而p53,Bax和caspase-3的表达水平受到抑制。Bcl-2的表达受到保护,这些功能可以减少细胞凋亡。这些结果表明, DJ-1可以通过调节 p53, Bax, caspase-3和 Bcl-2的表达,调节细胞中的 ROS水平并减弱H2O2诱导的多巴胺神经元中的氧化应激损伤。本研究为PD的发病机制和临床治疗提供了新的靶点。这将带来PD临床治疗的曙光。
(本文图3,4见插图12-1)

