系统性红斑狼疮并多发骨梗死2例分析
时一添,袁风红,陈海凤,邹耀红
(南京医科大学附属无锡人民医院风湿免疫科,江苏 无锡 214023)
骨梗死是指骨细胞和骨髓细胞持续性发生缺血坏死,被纤维组织和肉芽组织替代,最终逐渐钙化和骨化的病理状态。系统性红斑狼疮(SLE)合并骨梗死以股骨头受累多见,而股骨段、胫腓骨、跟骨、距骨等部位受累少见,报道也以病例报告为主,由于症状不典型,容易延误诊治。笔者回顾性分析2例SLE合并多发骨梗死患者的临床资料,结合相关参考文献,总结该类患者的病因、临床及影像学特点。
1 临床资料
病例1,患者,女,54岁,因“皮疹12年,泡沫尿4年,关节痛1月”入院,患者2004年起出现颜面皮疹、口腔溃疡、关节肿痛,白细胞低,红细胞沉降率高,ANA阳性,诊断为“系统性红斑狼疮”,予泼尼松60 mg·d-1口服,约5年后自行停药;2012年8月因泡沫尿增多收治我科,24 h尿蛋白定量4 g,肾穿:狼疮性肾炎Ⅳ型,予“甲强龙120 mg,3 d→泼尼松60 mg·d-1”,口服吗替麦考酚酯1.5 g·d-1,后复查尿蛋白转阴,激素逐渐减量至泼尼松5 mg,每天1次,同时停吗替麦考酚酯,改予来氟米特10 mg,每天1次;2016年8月出现双髋及右踝疼痛,活动受限,行双髋及右踝MRI(图1~5):左侧股骨头变扁,股骨上段见片状长T1长T2信号影,左髋臼形态欠规则, T1WI呈低信号,T2WI呈混杂高低信号,右侧股骨头关节面下见地图状异常信号,周围环绕线条状长T1长T2信号影,右股骨上端外侧软组织内条状长T1长T2信号影;胫腓骨下段、根骨内见不规则形长短T1异常信号,T2WI呈高低信号,距骨内见片状长T1、高T2WI异常信号,关节腔内见长T1长T2异常信号;红细胞沉降率55 mm·h-1;ACL阴性;考虑合并多发骨梗死,维持泼尼松5 mg,每天1次,予碳酸钙D3、阿法骨化醇、双磷酸盐、阿司匹林抗等治疗,按需服用NSAIDs治疗;2017年3月行左侧全髋关节置换手术,目前可弃拐杖行走,仍有右踝间断疼痛不适,持续随访中。
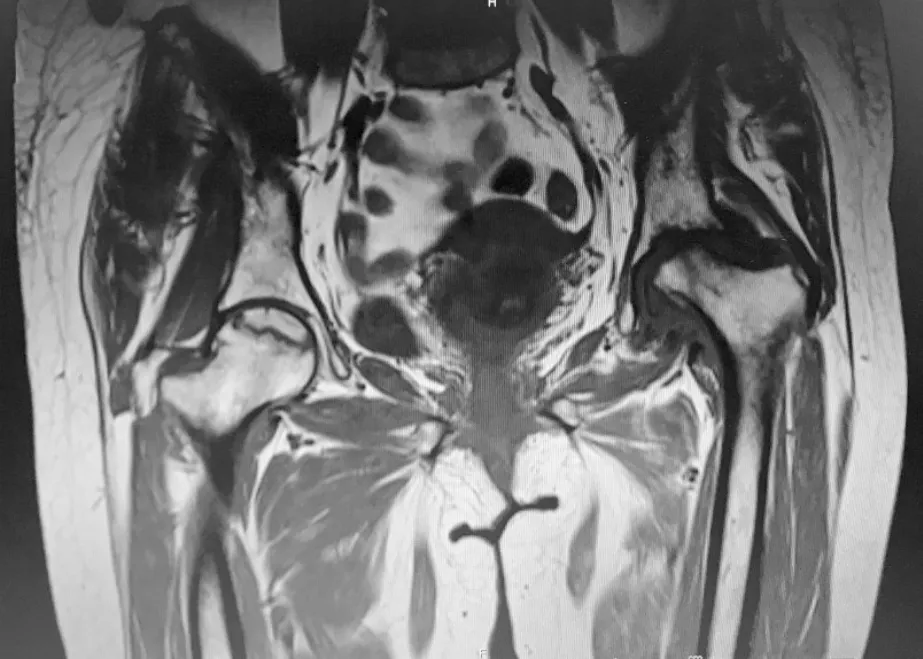
图1 例1 患者双髋冠状位MRI T1图像
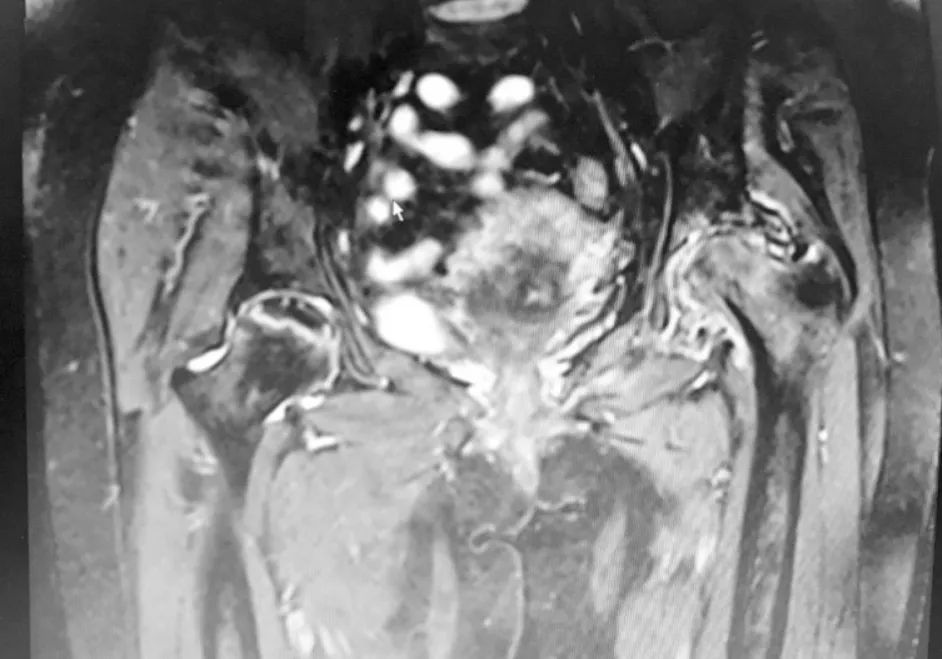
图2 例1 患者双髋冠状位MRI T2 图像
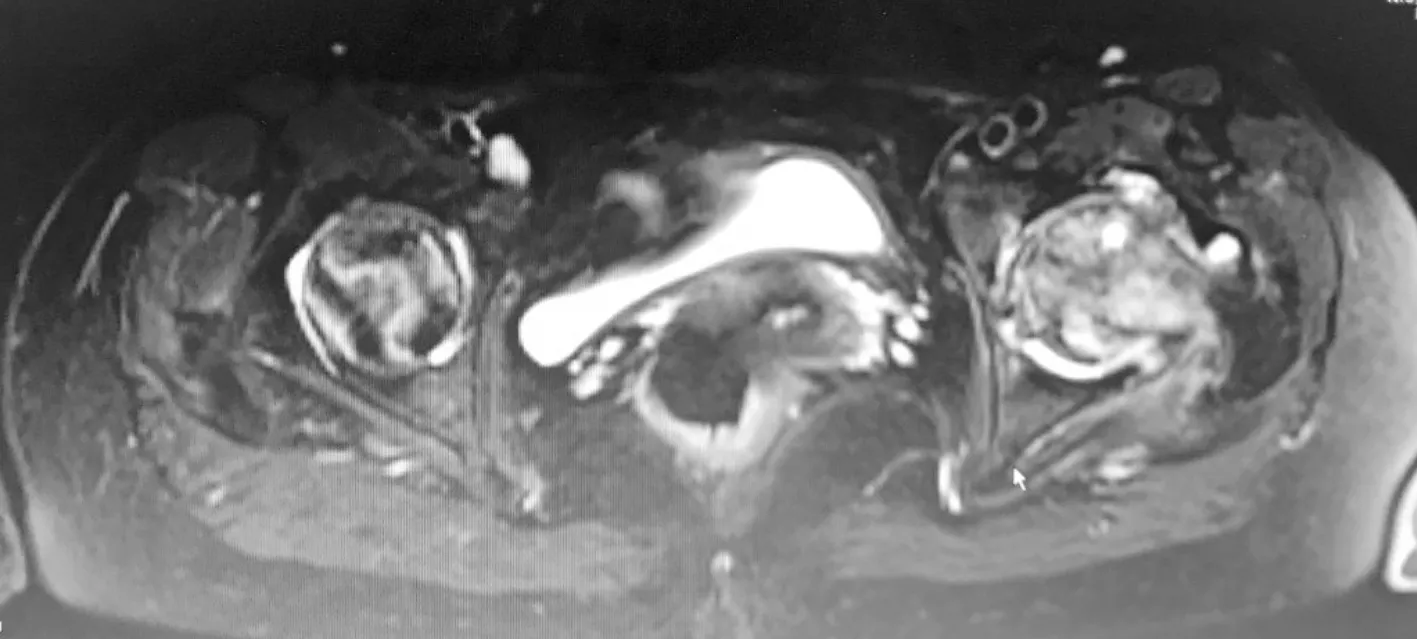
图3 例1患者双髋横轴位MRI T2图像
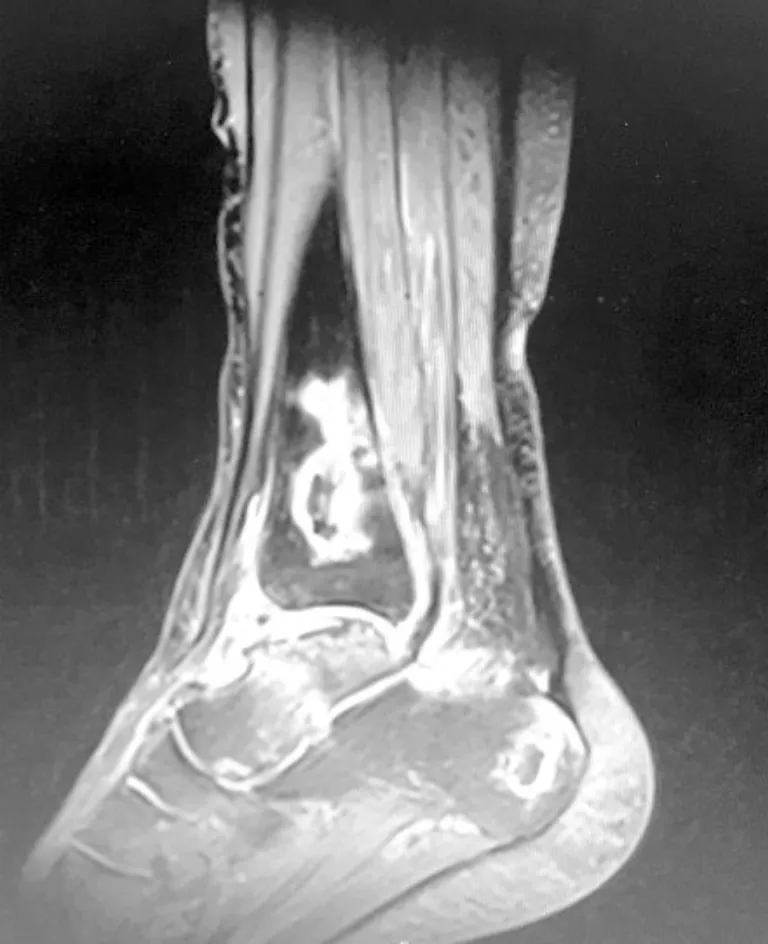
图4 例1患者右踝矢状位MRI T2 图像
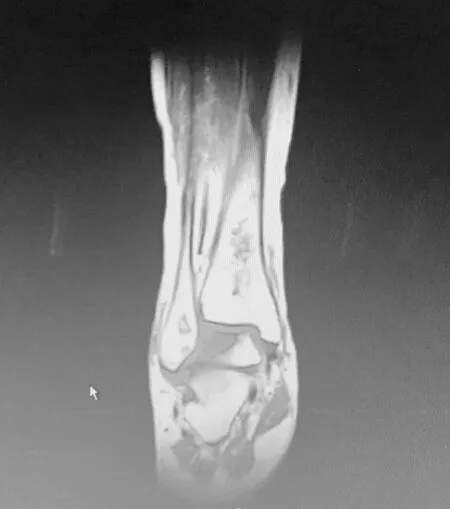
图5 例1患者右踝冠状位MRI T2图像
病例2,患者,男,33岁,因“皮疹10年,泡沫尿3年,膝关节痛1月”入院,患者2005年前出现皮疹、脱发,当地医院诊断为“系统性红斑狼疮”,予“泼尼松10 mg·d-1、羟氯喹”治疗;2012年出现泡沫尿,尿常规:蛋白+++,24 h尿蛋白定量4 g,血浆白蛋白26 g·L-1,红细胞沉降率100 mm·h-1,ANA1:80阳性,抗DsDNA抗体阳性,诊断为“狼疮性肾炎”,建议肾穿,患者拒绝,予甲强龙80 mg,5 d→泼尼松60 mg,每天1次治疗,吗替麦考酚酯1.5 g·d-1协同治疗,后尿蛋白尿蛋白转阴,激素逐渐减量至泼尼松7.5 mg,每天1次维持;2015年出现双髋、膝关节疼痛,查红细胞沉降率16 mm·h-1,双髋+双膝关节MRI(图6~10):两侧股骨头下见地图样长T1长T2异常信号,双侧股骨上段、下段、胫骨上段骨质见地图样长T1长T2异常信号,周围见片状稍长T1稍长T2信号影;抗β2GPI抗体>200 RU·mL-1,ACL阴性,狼疮抗凝物1.32(北京协和医院),诊断为“系统性红斑狼疮、继发性抗磷脂综合征、多发骨梗死”,维持泼尼松7.5 mg,每天1次,华法林抗凝、阿伦磷酸钠口服,NSAIDs止痛,门诊规律随诊中。
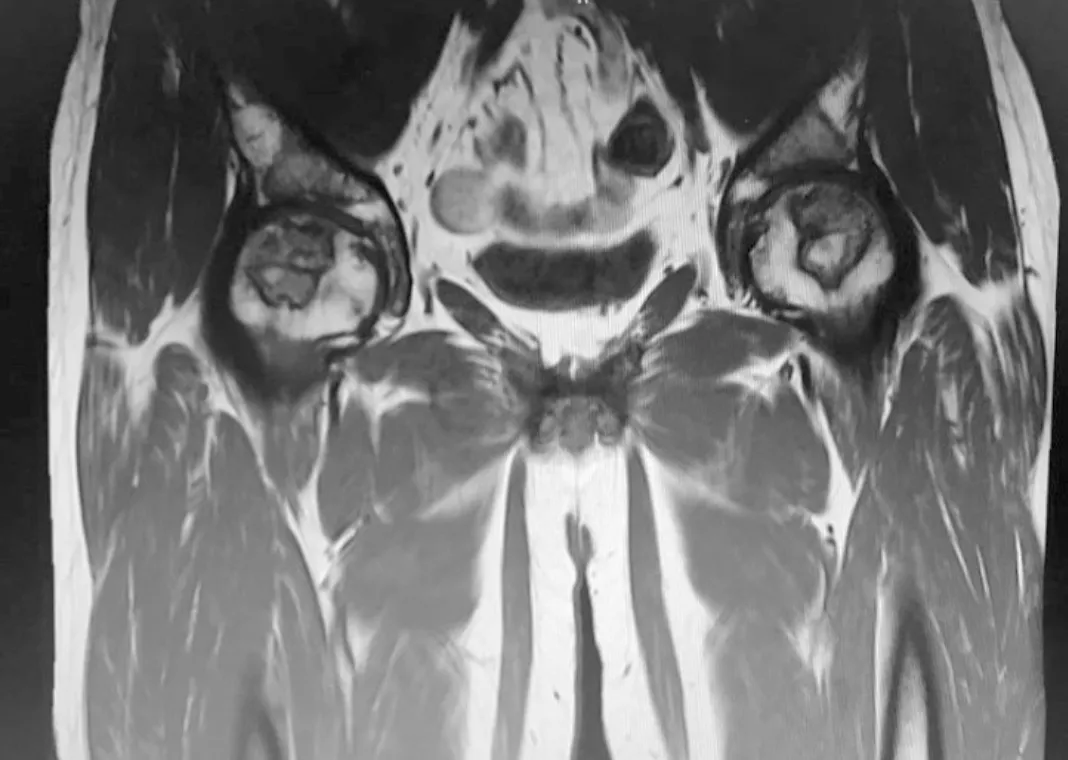
图6 例2患者双髋冠状位MRI T1图像

图7 例2患者双髋冠状位MRI T2 图像
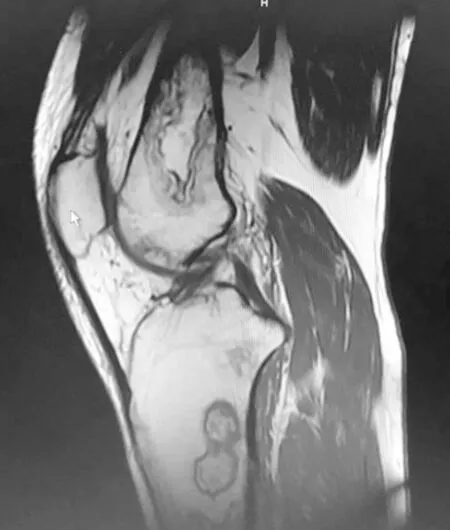
图9 例2患者膝关节矢状位MRI T1图像
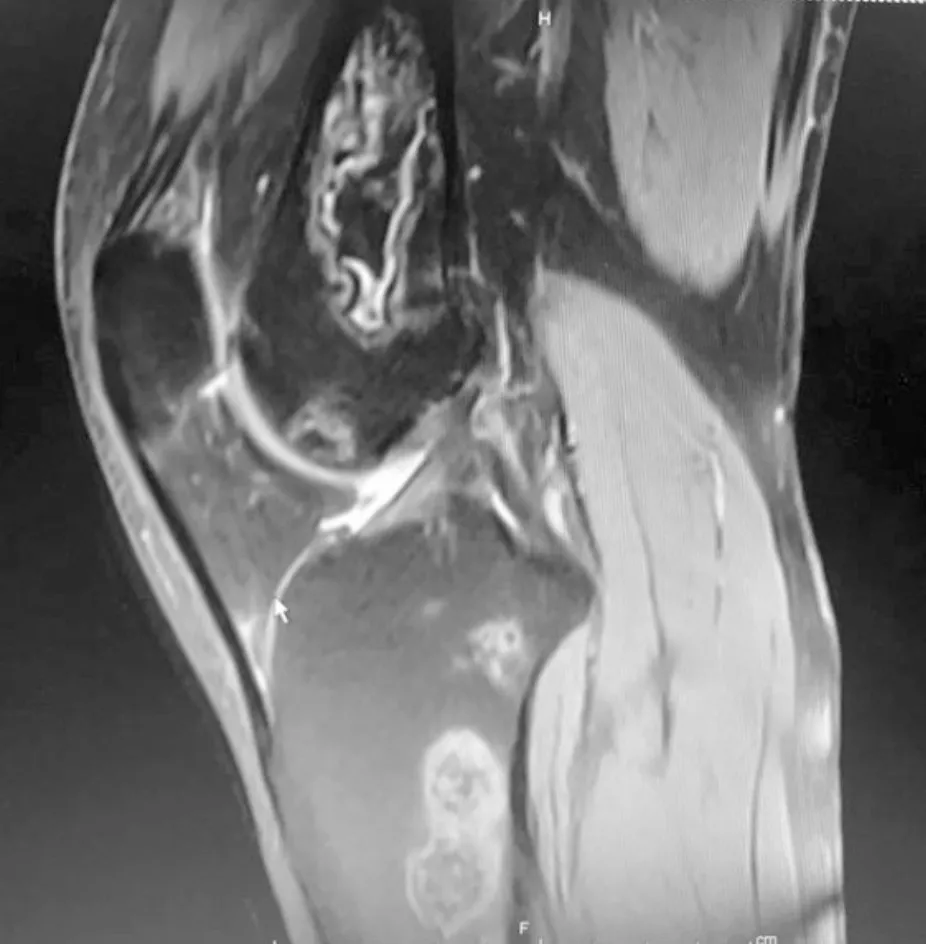
图10 例2患者膝关节矢状位MRI T2 图像
2 讨论
骨梗死常见病因为潜水减压,激素、化疗药物、饮酒、脂肪代谢紊乱,胰腺炎及外伤也是常见原因。骨梗死的病理变化包括细胞性骨坏死和骨质结构变化两个阶段[1]。影像学检查为诊断的重要手段,早期,由于处于细胞性骨坏死阶段,无骨质结构改变,X线和CT检查无特异性表现,而MRI早期检出率高,病变区域表现为T1WI低信号,T2WI高信号,而中晚期时已经有骨质结构改变,出现死骨块、吸收带、新生骨带[2], X线在中期可见死骨边缘出现骨质吸收带和新骨带,晚期骨端密度不均匀,表现为低密度病灶内出现点片状、环状致密影;CT表现为骨松质内出现匍行、周边为带状硬化缘的骨质吸收区,期内可见死骨或钙化,也有“地图状”分布的斑片状或类圆形高密度区;肉芽组织和新生血管在MRI上表现为T1WI低信号、T2WI高信号,表现为以梗死灶为中心的“地图样”、“靶环样”的特征性改变,而死骨吸收、新骨形成T1WI、T2WI均为低信号[2-3]。
系统性红斑狼疮合并骨梗死以股骨头受累多见,其发生率为3%~52%[4],而股骨段、胫腓骨、跟骨、距骨等部位受累并不常见,报道也以病例报告为主,由于症状不典型,容易延误诊治。SLE骨梗死与多种因素有关,糖皮质激素使用仍考虑为SLE骨梗死的主要原因,目前多项研究发现发现更高的平均每日剂量、大剂量激素冲击、长期使用激素(疗程)及最初6个月累计量[5-9]均是危险因素。本报道中两例患者均因疾病活动应用中大剂量激素治疗。糖皮质激素引起骨梗死的可能机制如下:激素直接导致的低纤溶/血栓形成倾向[10]、内皮细胞凋亡、内皮细胞功能障碍或损害,导致血小板过度活化引起血管内凝血,从而引起骨细胞缺血、缺氧及坏死;激素还可以加重脂质代谢异常,高LDL可以促进细胞核转录因子的过氧化物酶增殖激活,增加脂肪细胞数量,引起骨细胞脂肪变性,造成脂肪栓塞从而使骨内压力增加、血液灌注减少,导致骨坏死[11];激素还可能通过诱导成骨细胞及骨细胞凋亡,引起成骨细胞及骨细胞坏死,损害骨骼,并且通过下调骨保护素及上调RANKL引导骨形成与骨吸收之间的平衡[12]。Tristan 等[13]发现,大鼠实验中,激素可以抑制MMP-2、MMP-13、MMP-14、cathepsin K、TRAP等蛋白酶的表达,导致胶原蛋白破坏和基质过度矿化引起软骨及骨细胞变性坏死;Kaneshiro等发现骨梗死患者肝脏CYP3A酶活性水平较健康人群显著降低,因此推测低肝脏CYP3A酶活性水平者激素代谢能力低下,导致长时间暴露于较高水平激素治疗,从而引起相关副作用,并且动物实验模型也证实了上述假说[14-15]。另外,一些研究也发现,AI-1、PAI-1、PAI-1和P-gp基因多形性以及激素受体与骨梗死有关[16-18]。
尽管激素是骨梗死的重要危险因素,但是研究发现,其他需使用激素的慢性疾病骨梗死的发生率明显低于SLE患者[19],如慢性肠炎、肾移植、骨髓移植等疾病股骨头梗死的发生率仅为2%~6%[8,20-21],也有关于未使用激素SLE患者在发病初期发生骨梗死的报道[22],提示SLE疾病本身也是导致骨梗死的原因之一。多项研究发现其中致病原因包括抗心磷酯综合征所致微血栓形成、脂肪栓子、雷诺现象、血管炎及患者高血压[23-24]。一项队列研究纳入经MRI证实的膝关节骨梗死SLE患者20例[25],纳入80例年龄性别匹配的无膝关节骨梗死的SLE患者,分析发现皮肤血管炎、高纤维蛋白原血症、血清IgG水平升高、血小板减少、aPL阳性率、在膝关节骨梗死组显著增加,而羟氯喹(HCQ)的使用显著降低,研究表明羟氯喹对SLE骨梗死有保护作用,其降低胆固醇、三酰甘油和低密度脂蛋白水平从而降低血栓栓塞事件的发生、抑制血小板聚集以及抑制与抗心磷脂抗体结合,同时羟氯喹的应用也有助于SLE病情的缓解而减少激素的使用剂量及时间,同样的结果在UEA等[26]的文章中也有报道。另外一些研究发现库欣体态也是SLE骨梗死发生的独立危险因素[27]。
本文中2例SLE患者,病程长,均合并有狼疮性肾炎,原发病活动,曾予大剂量激素联合免疫抑制剂治疗,后出现踝、膝关节疼痛,上述症状需要与SLE疾病活动引起关节症状相鉴别;其中1例患者高滴度β2GPI及狼疮抗凝物阳性,确诊为继发性抗磷脂综合征,骨梗死亦考虑与此有关;2例患者均通过MRI检查确诊为骨梗死,MRI为早期发现骨梗死的重要手段。更好的控制原发病活动情况,减少激素及免疫抑制剂使用,可降低合并骨梗死风险。骨梗死的治疗以保守治疗为主,包括口服非甾体类抗炎镇痛药物、抗凝药物、降脂药物、钙剂、活性维生素D及双磷酸盐类药物,除此以外,还有关节功能锻炼、减重减少负重、高压氧治疗;但对于病变范围广,保守治疗效果不佳者,建议外科手术干预。

