PK-15细胞中与CSFV感染相关的microRNAs筛选及 miR-214的功能研究
邓少锋,叶佐东,范双旗,陈金顶,张静远,朱梦娇,赵明秋
PK-15细胞中与CSFV感染相关的microRNAs筛选及 miR-214的功能研究
邓少锋,叶佐东,范双旗,陈金顶,张静远,朱梦娇,赵明秋
(华南农业大学兽医学院,广州 510642)
【目的】利用制作的猪的miRNA表达谱芯片筛选猪瘟病毒(classical swine fever virus,CSFV)感染PK-15细胞后表达有差异的miRNA,并进一步探讨其中表达差异较明显的miRNA的作用和功能,从miRNA的角度探究CSFV的致病机制,为猪瘟(classical swine fever,CSF)的防控提供新依据。【方法】为了研究CSFV感染PK-15细胞后miRNA表达的变化情况,根据miRBase version 19.0数据库中326条猪的miRNA合成探针,采用原位合成技术制作表达谱芯片,筛选得到CSFV感染PK-15细胞后表达有差异的miRNA。挑选CSFV感染PK-15细胞后表达差异最明显的miR-214作为进一步研究对象,研究miR-214在CSFV感染过程中的功能和作用。CSFV感染PK-15细胞后,用荧光定量PCR检测miR-214的mRNA表达水平。为了进一步研究miR-214对CSFV感染的影响,合成miR-214模拟物及抑制物,并分别转染PK-15细胞,转染后24 h感染CSFV,感染后48h用荧光定量PCR检测CSFV的基因拷贝数,用间接免疫荧光方法检测CSFV的病毒滴度。为了进一步探究miR-214参与调控CSFV复制的机制,通过生物信息学软件预测miR-214参与调控CSFV复制的靶蛋白,并用荧光素酶报告基因系统进一步确证miR-214能够靶向作用于凋亡通路中重要分子TNFR1 相关的死亡区域蛋白(TNF Receptor-Associated Death Domain,TRADD),因此猜测miR-214通过影响靶蛋白TRADD的表达水平从而影响PK-15细胞凋亡,将miR-214模拟物及抑制物分别转染PK-15细胞,转染后24 h感染CSFV,同步设立不感染CSFV的细胞对照,感染后48 h用荧光定量PCR和Western blot分别检测TRADD的mRNA和蛋白表达量的变化,同时用流式细胞术检测miR-214对CSFV感染的PK-15细胞凋亡的影响。【结果】CSFV感染PK-15细胞后,通过表达谱芯片技术筛选得到69条表达有差异的miRNA,其中miR-214表达量上调且差异最明显。qRT-PCR结果显示,CSFV感染PK-15细胞后miR-214的mRNA表达量上调,验证了表达谱芯片的结果。将miR-214模拟物转染PK-15细胞后再感染CSFV, CSFV的基因拷贝数及病毒滴度均显著下降;转染miR-214抑制物后再感染CSFV,CSFV的基因拷贝数及病毒滴度均显著上升,表明miR-214促进了CSFV的复制。为了进一步探究miR-214促进CSFV复制的机制,用生物信息学软件预测TRADD为miR-214的靶蛋白,荧光素酶报告基因系统验证了miR-214能够靶向作用于TRADD。转染miR-214模拟物后,PK-15细胞中TRADD的mRNA和蛋白表达量均显著上升,而转染miR-214抑制物后,PK-15细胞中TRADD的mRNA和蛋白表达量均显著下降,表明miR-214抑制TRADD的表达。通过流式细胞术,验证了CSFV感染PK-15抑制细胞凋亡,miR-214抑制CSFV感染的PK-15细胞凋亡。【结论】CSFV感染PK-15后,上调细胞内miR-214的表达。miR-214能通过靶向抑制TRADD蛋白的表达,从而抑制PK-15细胞凋亡,促进CSFV在细胞内的复制。
猪瘟病毒;miRNA;复制;TRADD;凋亡
0 引言
【研究意义】猪瘟(classical swine fever, CSF)是由猪瘟病毒(classical swine fever virus, CSFV)引起的猪的一种重大烈性传染性疾病[1],被世界动物卫生组织(Office International Des Epizooties,OIE)列为法定报告动物传染病之一[2],严重危害着我国养猪业的健康发展,造成重大经济损失。CSFV的致病机制十分复杂,因此,从不同角度深入研究其致病过程有利于促进对CSFV致病机制的认识。microRNA(miRNA)是一类非编码单链小分子RNA,通过与其靶mRNA分子的3′端非编码区域互补匹配抑制该mRNA分子的翻译,从而对靶蛋白表达进行调控[3]。miRNA在病毒致病性以及病毒与宿主的相互作用方面发挥重要作用,但是对CSFV相关的miRNA研究较少。本研究通过生物信息学等试验方法筛选出可能与猪瘟病毒相关的miRNA,并对其进行功能研究,从宿主细胞的角度研究猪瘟病毒与细胞之间相互作用的关系,为猪瘟病毒的致病机理提供理论依据。【前人研究进展】研究证实miRNA参与许多重要生物学过程,包括调控信号通路[4-6]、促进机体发育[7]、诱导细胞凋亡[8-10]、参与免疫反应[11-13]以及在病毒感染中发挥作用。研究表明,有些miRNA能够直接以病毒基因组为靶位,调节病毒的复制[14-15]。有些miRNA能介导宿主的抗病毒活性[16-17]。目前对于CSFV相关的miRNA研究较少,如miRNA-let-7c可下调CSFV的RNA复制水平[18]。作为与CSFV同属黄病毒科的HCV的相关miRNA的研究已经十分深入[14, 19-20],对研究CSFV相关miRNA的作用有很大指导意义。【本研究切入点】miRNA在病毒感染中发挥重要作用,但目前对于CSFV相关的miRNA研究较少,而作为与CSFV同属黄病毒科的HCV的研究已十分成熟,对研究CSFV相关miRNA的作用有很大指导意义。【拟解决的关键问题】通过生物信息学和试验方法筛选出可能与CSFV感染相关的miRNA及其功能研究,从宿主细胞的角度来研究CSFV与细胞相互作用的关系,为研究其致病机理提供有价值的科学资料。
1 材料与方法
试验于2015年9月至2016年5月在华南农业大学兽医学院完成。
1.1 试验材料
猪源肾脏细胞(PK-15)、CSFV石门株和大肠杆菌DH5α感受态细胞由华南农业大学兽医学院微生物学与免疫学教研室保存。pmirGLO Dual-Luciferase miRNA Target Expression Vector由华南农业大学动物科学学院王翀教授惠赠。
1.2 试验方法
1.2.1 病毒接种和滴度测定 PK-15细胞传代于培养瓶中生长到80%—90%时,用PBS洗涤细胞2次,加入CSFV病毒液,置于含5% CO2的37℃培养箱中孵育4—6 h后,弃去病毒液,用PBS洗涤细胞2次,加入细胞维持培养基继续培养,72 h后收获病毒液,于-80℃保存备用。
用无血清无抗生素的DMEM将上述所获得的CSFV病毒液分别做10倍连续梯度稀释至10-10,再分别将每个梯度的病毒液按0.1 mL/孔接种4孔细胞,同时设空白细胞对照。接种CSFV后继续培养5 d,取出细胞培养板进行间接免疫荧光检测,并计算CSFV感染滴度。
1.2.2 细胞总RNA的提取与检测 弃去细胞培养液,用PBS洗涤细胞2次,加1 mL的胰酶消化并收集细胞至1.5 mL离心管中,参考Omega公司的总RNA提取试剂盒说明书提取细胞总RNA,再经过1%琼脂糖凝胶电泳鉴定提取的总RNA的完整性,并用超微量分光光度计测定RNA的浓度和纯度。
1.2.3 制作miRNA表达谱芯片 miRNA表达谱芯片试验是由广州锐博公司完成。根据miRBase version 19.0数据库中326条猪miRNA合成探针,采用原位合成技术制作表达谱芯片。miRNA表达谱芯片制作完成后进行扫描。
1.2.4 荧光定量PCR检测基因的表达 分别采用相应的反应体系和条件,根据PrimeScript miRNA cDNA Synthesis Kit说明书和PrimeScript® RT Master Mix说明书进行反转录反应合成miRNA cDNA和病毒基因或蛋白基因cDNA。然后根据SYBR® Premix Ex Taq™ II说明书进行qRT-PCR检测基因的表达。
1.2.5 生物信息学预测miRNA的靶标蛋白 根据miRNA表达谱芯片筛选出来CSFV感染PK-15后表达变化的miRNA,用Target Scan、RNA22、Pictar等生物信息学软件预测miRNA的靶蛋白。
1.2.6 重组质粒的构建 提取PK-15细胞总RNA并反转录为cDNA作为模板,以上游引物:5′CCGCTCG AGGCGGCCGCCTGAGTACCAGAGAAAGAGG3′,下游引物:5′TGCTCTAGA TCAGAGTACCAT ACTG AGTG3′,扩增TRADD 3′UTR基因。胶回收PCR产物和表达载体,以I和I进行双酶切。酶切产物用1%琼脂糖凝胶电泳分离并回收目的片段。按T4 DNA连接酶说明书进行目的片段与载体质粒的连接,连接产物转化DH5α感受态细胞,挑取单菌落进行菌落PCR,同时送测序公司测序。选取菌落PCR和测序正确的菌落,按照Omega无内毒素质粒抽提试剂盒说明书进行质粒抽提。
1.2.7 双荧光素酶报告基因检测试验 将PK-15细胞接种至24孔培养板,待细胞生长密度至80%左右时,按照Lipofectamine 2000试剂说明书进行转染。将合成的miRNA 模拟物、模拟物对照、miRNA 抑制物、抑制物对照分别与pmirGLO-TRADD 3′UTR质粒共转染,以单独转染pmirGLO-TRADD 3′UTR质粒重组质粒为对照。转染24 h后,用GloMax生物化学发光仪检测荧光素酶活性。
1.2.8 免疫印迹试验(Western blot) 裂解细胞提取总蛋白,用BCA蛋白浓度测定试剂盒对蛋白样品进行定量。蛋白样品与含有5%的β-巯基乙醇上样缓冲液充分混合后,放入95℃水浴锅中加热5 min,进行蛋白变性。变性后的蛋白80 V电泳2 h,采用湿法转膜(200 mA、1 h)将蛋白转印到PVDF膜上,用含5%吐温的PBS(PBST)室温漂洗转印后的PVDF膜3次,每次10 min,加入含5%脱脂奶粉的PBST封闭液37℃摇床摇动封闭1 h。用PBST洗涤3次后4℃过夜孵育一抗,次日取出孵育后的PVDF膜用PBST漂洗3次,37℃条件下孵育HRP标记的荧光二抗1 h,漂洗3次后,扫描PVDF膜。
1.2.9 流式细胞术 按照Annexin V-FITC细胞凋亡检测试剂盒说明书方法,检测细胞凋亡率。用PBS洗涤细胞2次,加入适量胰酶消化后,弃去胰酶,用1 mL细胞培养液吹打混匀细胞,转移到离心管内,1 000 r/min离心5 min,弃上清,收集细胞,用PBS轻轻重悬细胞并计数。取5—10万重悬的细胞,1 000 r/min离心5 min,弃上清,加入200 µL Annexin V-FITC结合液和10 µL碘化丙锭(PI)染色液,轻轻混匀,室温避光孵育10—20 min,随后置于冰浴中。进行流式细胞仪检测,Annexin V-FITC为绿色荧光,PI为红色荧光。
1.2.10 数据统计与分析 所有实验都至少重复3次,获得的数据用平均值±标准差表示,利用GraphPad Prism软件进行统计学作图和差异显著性分析。统计学分析采用检验(<0.05;<0. 01;<0.001),当<0.05时认为有统计学差异。
2 结果
2.1 PK-15细胞中与CSFV感染相关的miRNA的初步筛选
为了检测CSFV体外感染PK-15细胞后miRNA表达的变化,用CSFV石门株感染PK-15,24 h后进行miRNA表达谱芯片试验。结果表明,CSFV感染PK-15细胞后,诱导细胞miRNA差异表达。与未感染CSFV的对照组相比,CSFV感染PK-15细胞共引起69条miRNAs表达变化,其中包括39条miRNAs表达量上调,30条miRNAs表达量下调(表1、表2)。这表明CSFV感染PK-15细胞后,宿主细胞miRNA表达发生变化。
2.2 CSFV上调miR-214的表达水平
miRNA表达谱芯片的结果显示,在上调的39条miRNAs中,miR-214表达差异最明显,故选取miR-214作为研究对象,研究其在CSFV体外感染中的功能与作用。为了验证基因芯片数据结果,采用qRT-PCR方法验证miR-214在CSFV感染的PK-15细胞中的表达情况。结果显示,CSFV感染PK-15细胞后,随着时间推移,miR-214表达水平逐渐升高(图1),与表达谱芯片结果一致,表明CSFV感染促进了miR-214的表达。
2.3 miR-214模拟物与抑制剂效果检测
根据miRBase下载miR-214的序列并合成其模拟物及对应的抑制剂。将miR-214模拟物和抑制剂分别转染PK-15,24 h后提取细胞总RNA,qRT-PCR检测细胞内miR-214的表达量。结果显示,miR-214模拟物转染能够极显著提高细胞内miR-214的表达水平(图2-A),抑制剂则相应的显著抑制miR-214的表达水平(图2-B)。表明合成的miR-214模拟物及抑制剂可以进行后续试验。
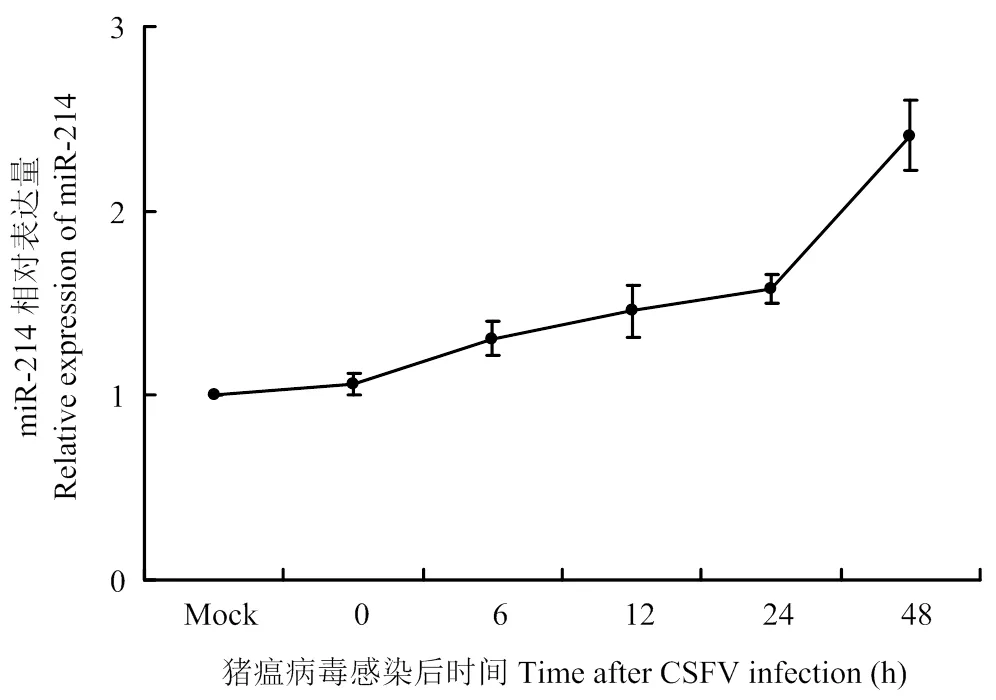
图1 CSFV感染PK-15细胞后miR-214的表达水平
2.4 miR-214促进CSFV复制
为了确定miR-214对CSFV复制的影响,将miR-214 模拟物和抑制剂分别转染PK-15细胞,转染后24 h,以MOI=0.1接种CSFV石门株,继续培养48 h后,提取细胞总RNA,用qRT-PCR方法检测CSFV NS5B mRNA表达水平。收集细胞培养液上清,间接免疫荧光(IFA)检测病毒滴度。结果表明,miR-214模拟物能够显著促进CSFV的复制及病毒滴度(图3-A),而miR-214抑制剂显著抑制了CSFV的复制及病毒滴度(图3-B),表明miR-214促进了CSFV RNA复制。
2.5 荧光素酶报告基因系统验证miR-214的靶蛋白TRADD
为了进一步确认miR-214能够靶向作用于TRADD,将TRADD的3′UTR区域构建入荧光素酶报告基因表达载体。分别共转染重组质粒与miR-214模拟物和miR-214抑制剂,24 h后检测荧光素酶活性。结果显示,转染miR-214 模拟物能够显著下调荧光素酶报告基因的表达(图4-A),而转染miR-214抑制剂能够显著上调荧光素酶报告基因的表达(图4-B),表明miR-214能够靶向作用于TRADD的3′UTR,进一步证明了miR-214对TRADD的靶向作用。
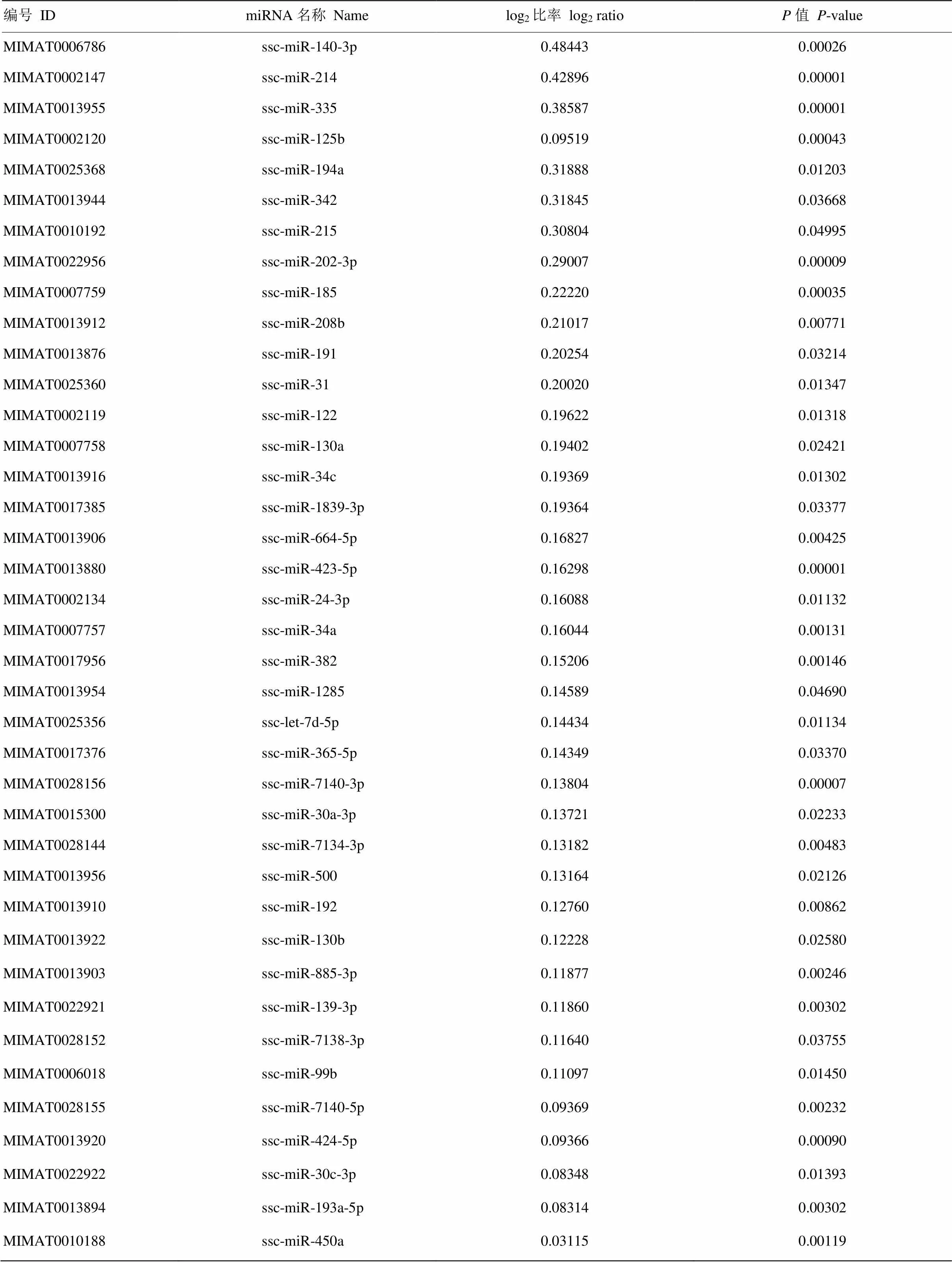
表1 CSFV感染PK-15细胞后表达量上调的miRNA
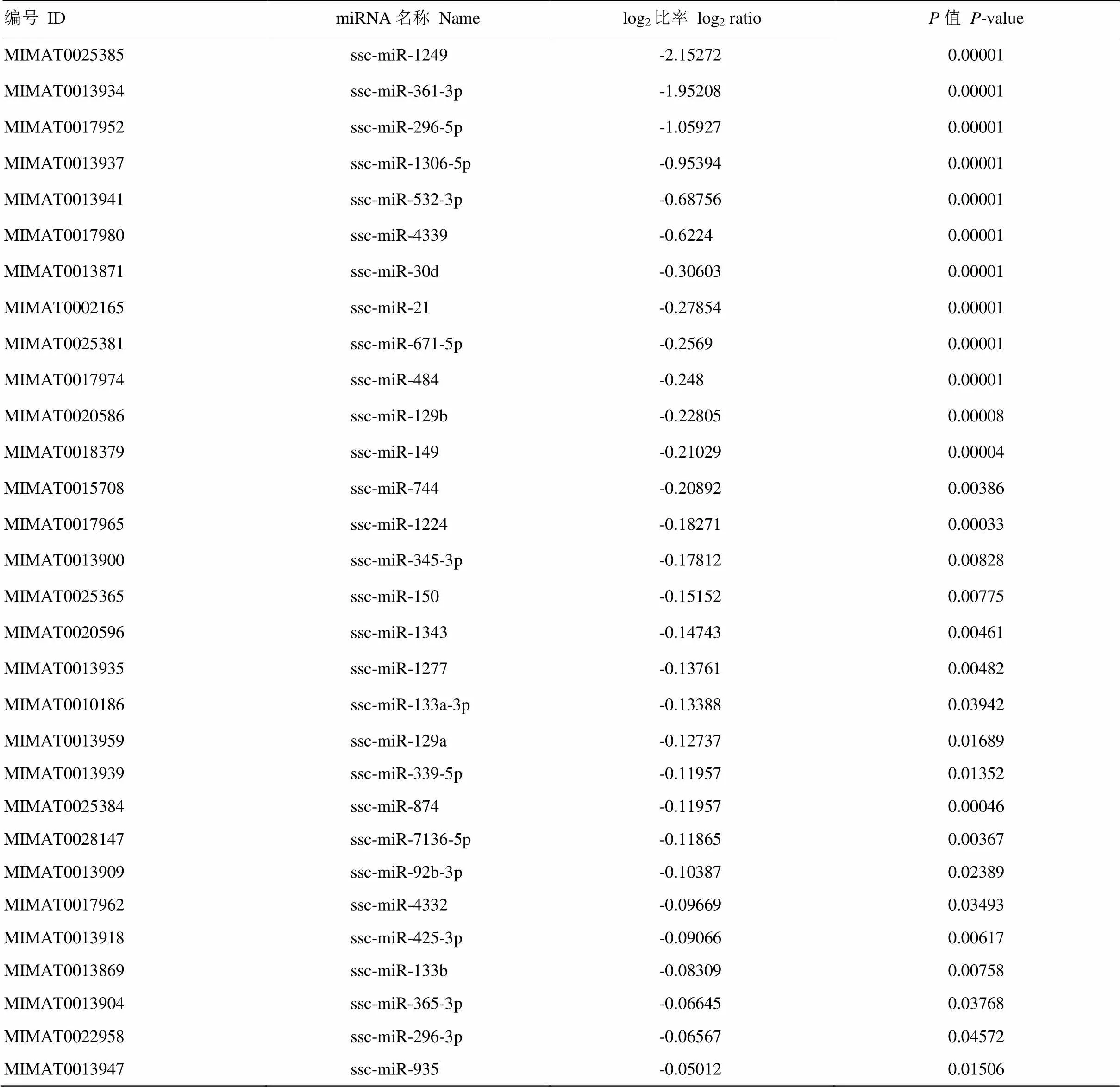
表2 CSFV感染PK-15细胞后表达下调的miRNA
2.6 生物信息学软件预测miR-214的靶蛋白
通过TargetScan、RNA22、Pictar等生物信息学软件预测miRNA的靶蛋白,发现,TRADD的3′UTR区域存在miR-214潜在作用靶点(图5)。
2.7 miR-214抑制TRADD的表达
通过上述试验,证明了miR-214对TRADD的靶向作用。为了进一步探究miR-214对TRADD表达的影响,将miR-214 模拟物及其抑制剂转染细胞,24 h后以MOI=0.1接种CSFV石门株,同步设立不感染组作为对照。 48 h后收集细胞提取总RNA,用qRT-PCR方法检测潜在靶蛋白TRADD的mRNA表达水平,验证miR-214对TRADD表达的影响。结果显示,miR-214模拟物能够显著下调TRADD mRNA表达(图6-A),而miR-214抑制剂则显著上调TRADD mRNA表达(图6-B)。同时裂解细胞提取总蛋白,用鼠源TRADD单抗和鼠源β-actin单抗进行Western blot,检测TRADD的蛋白表达水平。结果显示,miR-214模拟物抑制了TRADD的蛋白表达水平,而miR-214抑制剂则促进了TRADD的蛋白表达(图7)。综上试验结果表明,miR-214能抑制TRADD的表达。
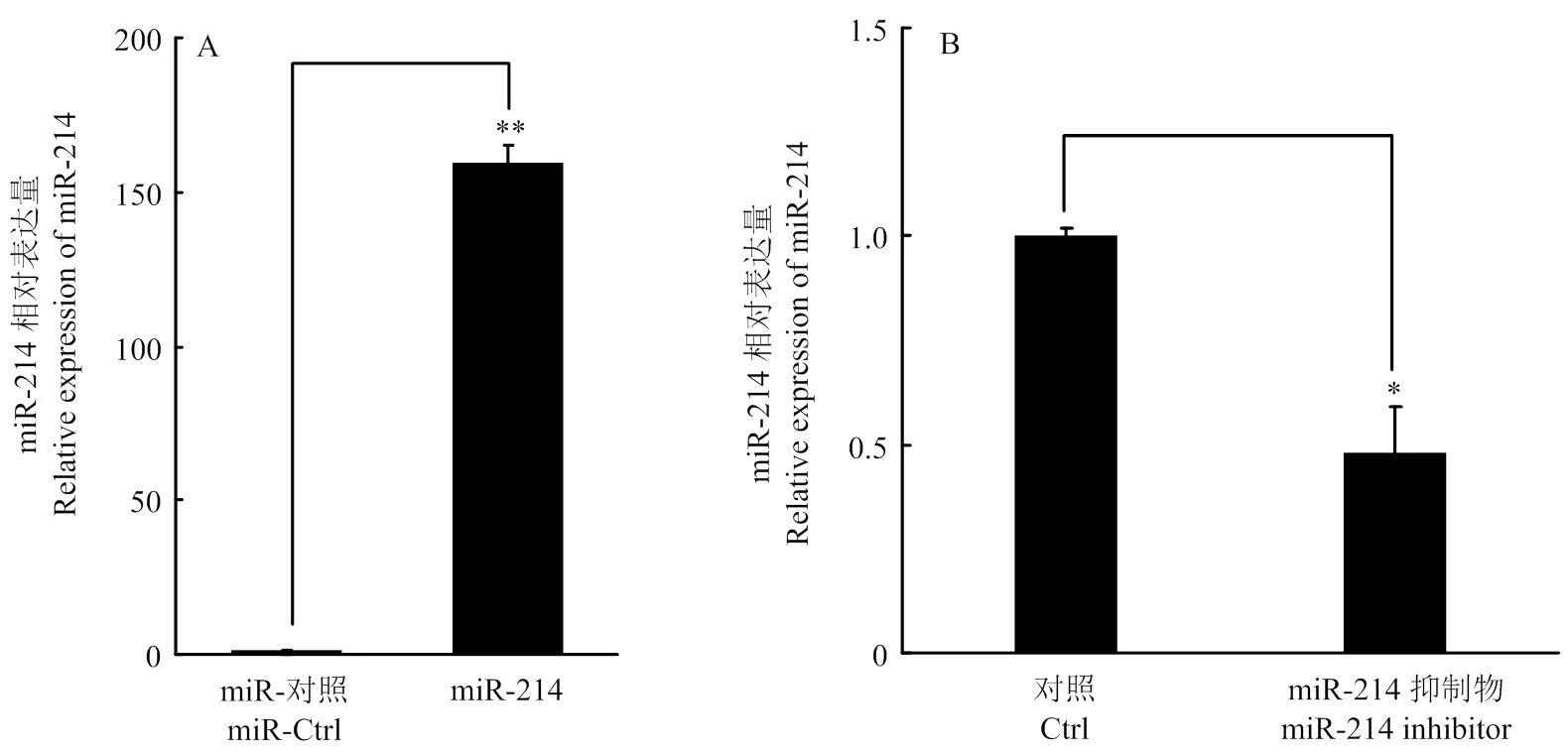
A. miR-214模拟物转染细胞后miR-214的表达量;B. miR-214抑制剂转染细胞后miR-214的表达量
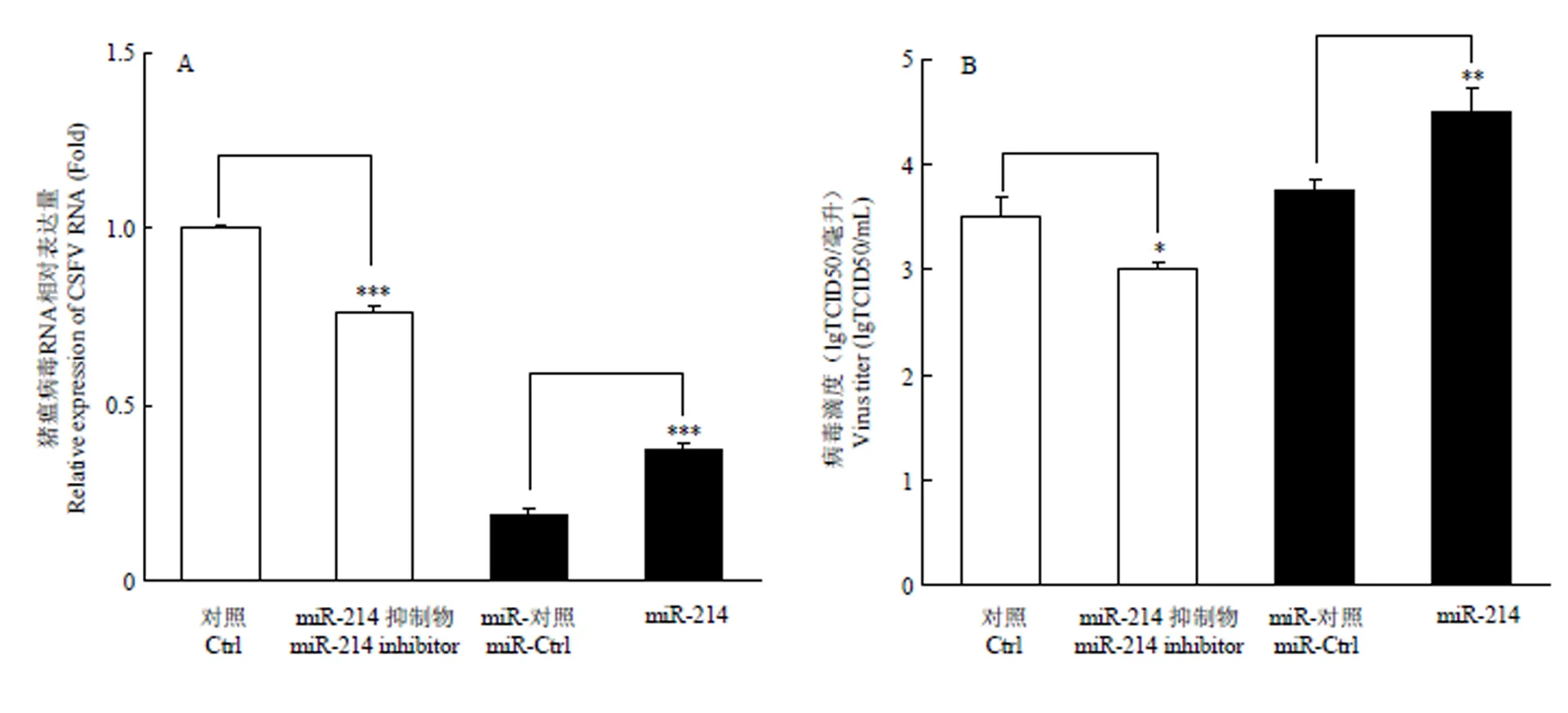
A. miR-214对CSFV NS5B mRNA表达量的影响;B. miR-214对CSFV病毒滴度的影响
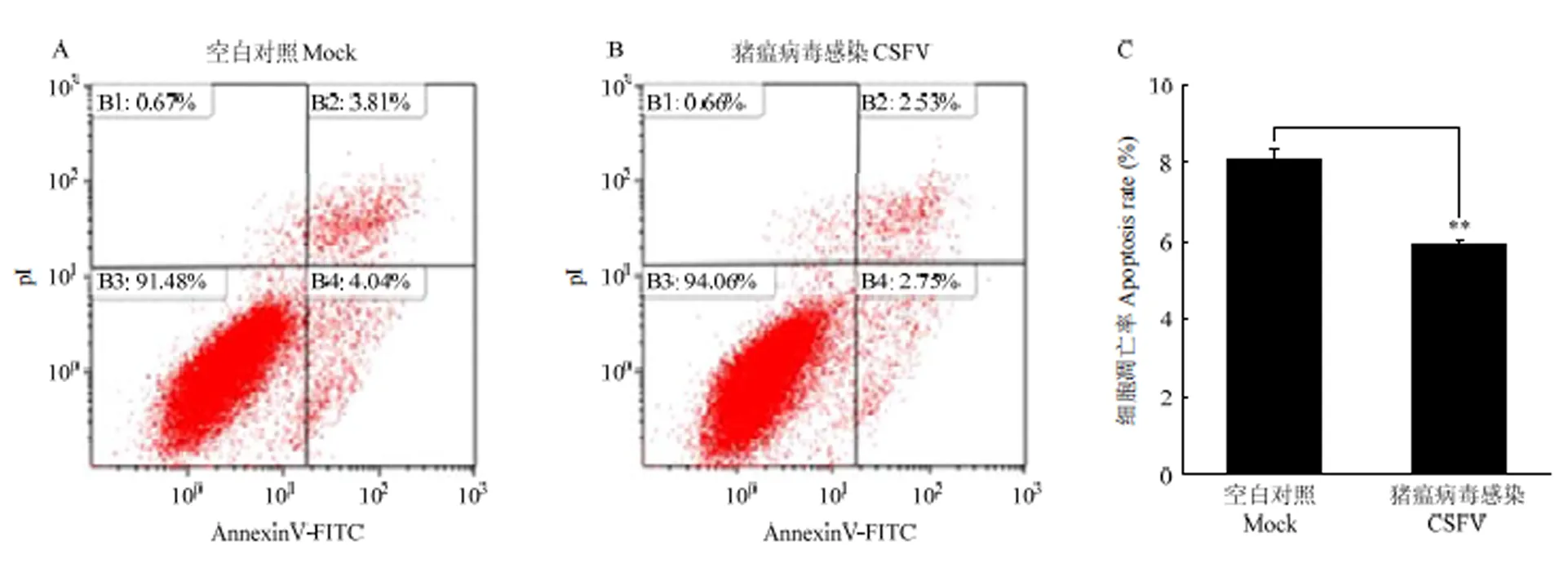
2.8 CSFV体外感染抑制PK-15细胞凋亡
有研究表明,CSFV在体外感染过程中通过抑制细胞凋亡实现持续感染[21]。在本研究中,首先验证CSFV对细胞凋亡的影响。PK-15细胞在6孔板中培养生长至80%,接种CSFV(MOI=1),同步设立未感染为对照组,感染24 h后,收集细胞,用流式细胞术检测细胞凋亡情况。结果显示,与对照组相比,CSFV感染PK-15细胞后抑制了细胞的凋亡(图8)。
2.9 miR-214抑制PK-15细胞凋亡
试验证明CSFV感染PK-15细胞后抑制细胞凋亡,有研究表明,TRADD与肿瘤坏死因子受体相互作用,能诱导细胞凋亡[22-23],而miR-214能抑制TRADD的表达。为了验证在CSFV体外感染过程中,miR-214是否参与调控细胞凋亡,PK-15细胞转染miR-214模拟物,用流式细胞术检测细胞凋亡情况。结果显示,miR-214模拟物能够抑制细胞凋亡(图9-A)。为了进一步验证在CSFV感染过程中,miR-214对凋亡的影响,将miR-214 模拟物和抑制剂及其相应的阴性对照转染PK-15细胞,转染24 h后,以MOI=0.1接种CSFV石门株,48 h后用流式细胞术检测细胞凋亡情况。结果显示,在未感染CSFV的PK-15细胞中,转染miR-214模拟物下调了细胞凋亡率,而转染miR-214抑制剂能够上调细胞凋亡率。同样,在CSFV感染组中,得到一致的结果,即转染miR-214模拟物能够下调细胞凋亡率,而转染miR-214抑制剂能够上调细胞凋亡率(图9-B、C)。由此推测,在CSFV感染过程中,miR-214可能参与抑制细胞凋亡。
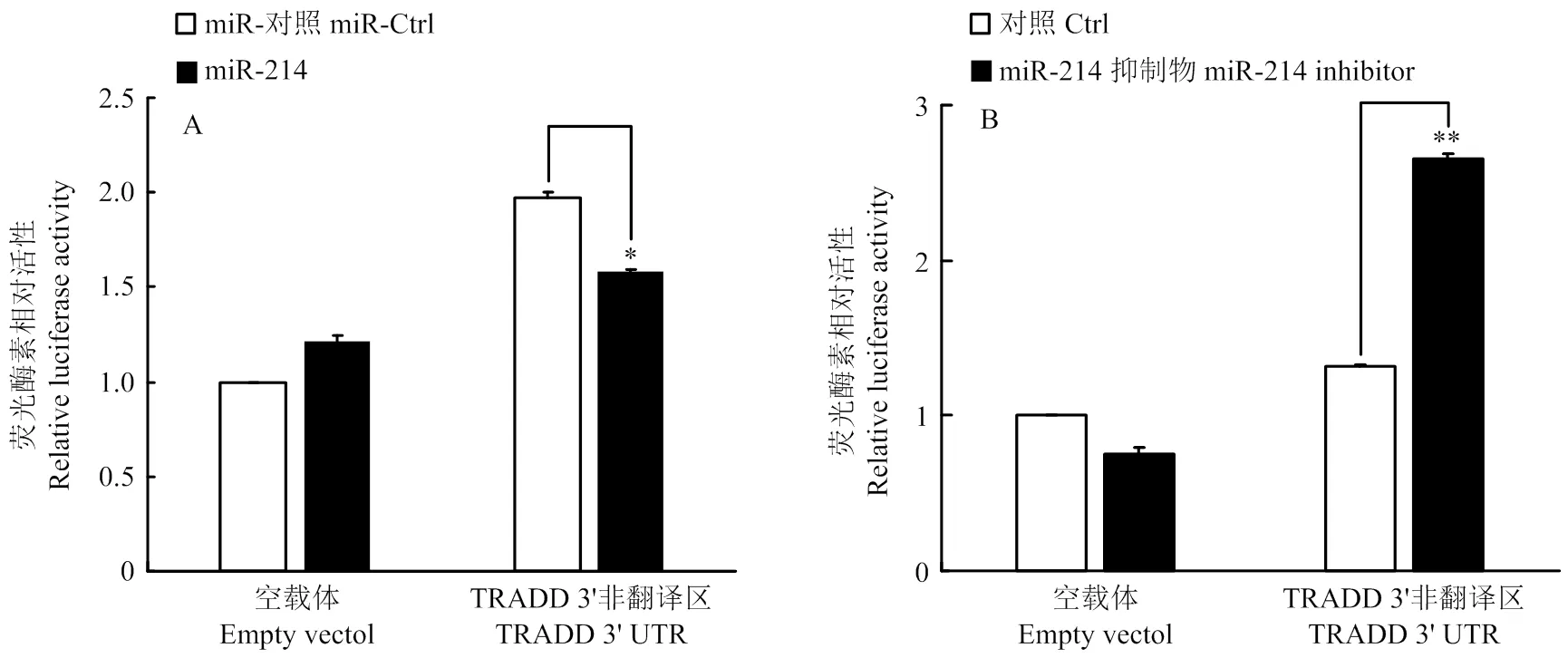
图4 miR-214对pmirGLO-TRADD 3′UTR荧光素酶活性的影响

图中红色标注部分为miR-214与TRADD的3′非翻译区互补配对的碱基对
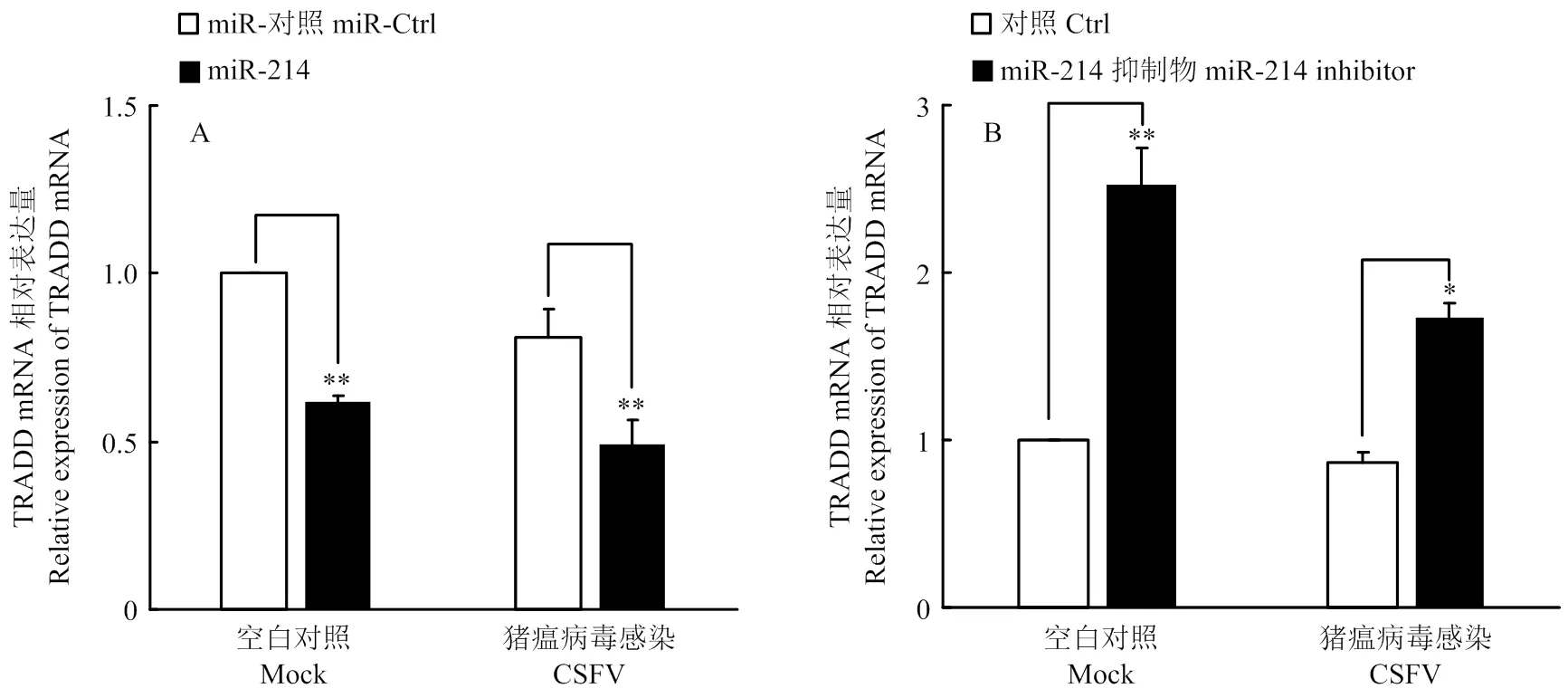
A.转染miR-214 对TRADD mRNA表达的影响;B.转染miR-214抑制物对TRADD mRNA表达的影响
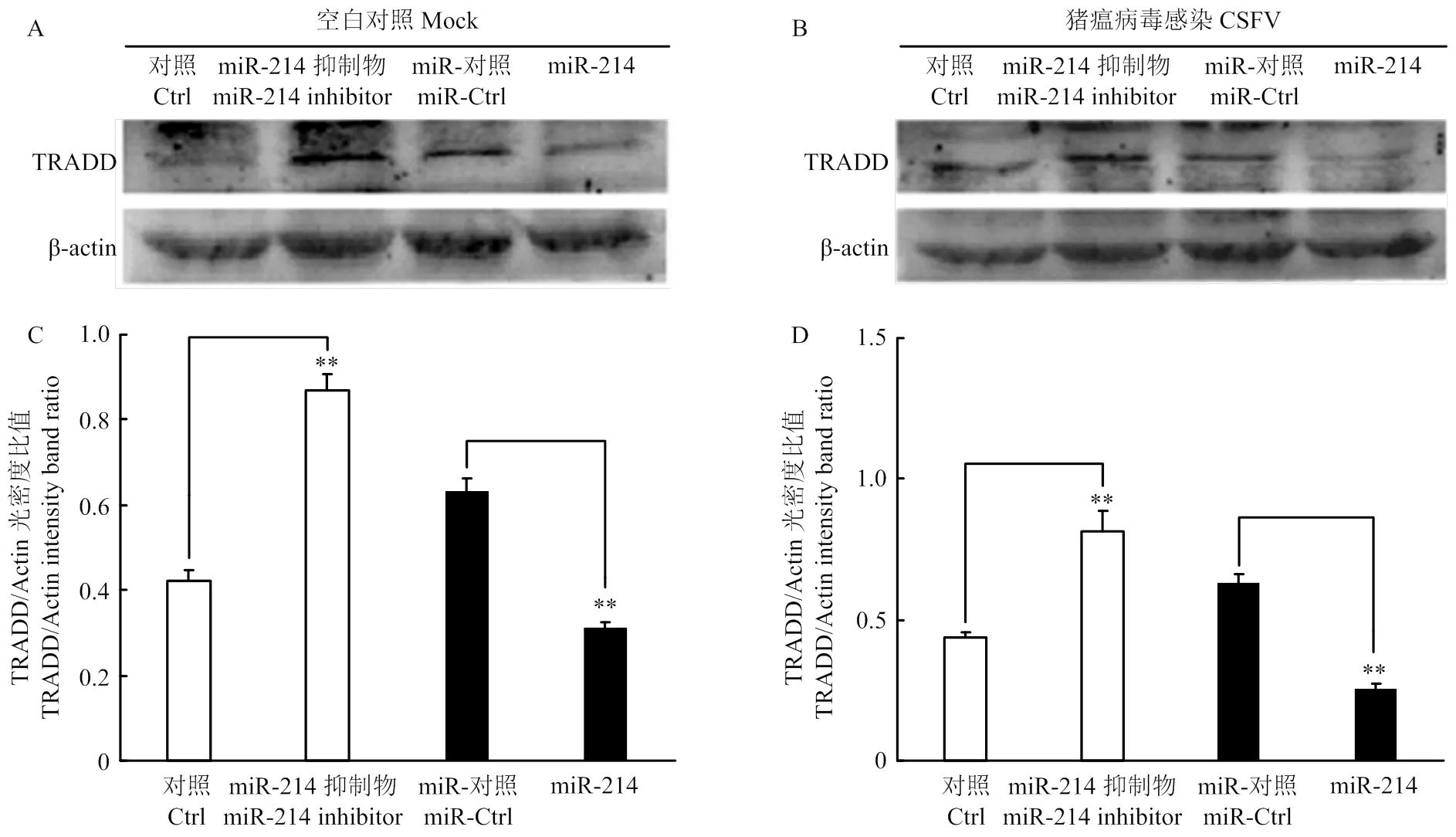
A.转染miR-214模拟物对TRADD 蛋白表达的影响;B.转染miR-214抑制剂对TRADD 蛋白表达的影响;C和D分别为A和B光密度比值的统计学分析
A. PK-15细胞未感染CSFV的凋亡率;B. PK-15细胞感染CSFV的凋亡率;C.CSFV感染组与对照组凋亡率的统计学分析

A. miR-214对PK-15细胞凋亡的影响;B. miR-214对在CSFV感染条件下PK-15细胞凋亡的影响;C. miR-214抑制剂对在CSFV感染条件下PK-15细胞凋亡的影响
3 讨论
miRNA是一类调节性非编码RNA分子,广泛存在于植物、动物以及动物病毒的基因组,主要参与基因转录后调控。近年来大量研究表明,细胞内的miRNA在调控宿主细胞基因及病毒复制中发挥重要作用[20,24],但是大部分研究都是基于人和小鼠等模式动物上,对猪源miRNA的研究较少。此外,对于HCV的miRNA的研究较为深入,为HCV致病机理研究方面提供了很多理论支持。展开对CSFV相关miRNA的研究,为揭示其致病机理开辟了新的方向,也为防控CSFV及寻找药物靶位提供了新的策略。
本研究中,以PK-15细胞为研究对象,通过表达谱筛选出与CSFV密切相关的差异表达的细胞miRNA,为研究miRNA介导调控CSFV感染致病机制打下前期基础。表达谱试验共筛选出69条差异表达的miRNA,但是与未感染CSFV的细胞组相比,大部分miRNA表达变化差异不大,差异水平在1.5倍左右,最多达到4倍,与其他病毒的miRNA表达谱结果相比,变化差异不是非常明显。推测其原因,可能跟病毒及种属有关,也可能细胞miRNA表达量相对较高,导致病毒感染后表达虽然有变化,但是变化比例较小。如果联合全基因组小RNA高通量测序,得到的差异结果可能更明显。另外,也可能与CSFV病毒自身感染PK-15细胞的特性有关,miRNA的调控水平可能较微弱。
本试验选择miR-214为研究对象,因为在筛选CSFV上调的39条miRNA当中,miR-214的表达差异最大。此外,miR-214的靶蛋白TRADD对凋亡具有调节作用。前期的研究表明猪瘟病毒能够抑制凋亡,达到持续感染的目的[21,25]。已经有大量的研究报道miR-214参与调控细胞凋亡,如miR-214能直接靶向于Bcl2l2,通过抑制Bcl2l2蛋白表达水平,从而诱导凋亡[26];在鼻咽癌组织或细胞系中高表达miR-214,而抑制miR-214表达,能够上调Bim蛋白的表达,从而促进细胞凋亡抑制癌细胞增殖[27]。因此推测,宿主miR-214在CSFV感染的PK-15细胞中参与调控细胞凋亡。
细胞凋亡是细胞Ⅰ型死亡程序,细胞凋亡启动细胞程序性死亡后不利于病毒在细胞内的存活和持续性感染[28]。有研究表明,CSFV感染细胞后,可以通过抑制细胞凋亡从而促进病毒的复制[21]。通过生物信息学手段预测miR-214的靶蛋白中,发现TRADD存在miR-214结合位点,推测可能是miR-214的靶蛋白之一。死亡受体介导的细胞凋亡包括FASL- FAS、TRAIL-DR4以及TNFα-TNFR1途径[29-30],TRADD作为TNFα-TNFR1途径中一个接头分子,对下游凋亡信号激活及分子招募至关重要。因此本试验对TNFα-TNFR1介导的凋亡进行探讨,结果证明在CSFV感染中高表达miR-214能够一定程度上抑制TRADD表达,抑制PK-15细胞凋亡。表明CSFV体外感染中抑制细胞凋亡的机制可能与CSFV上调的miR-214有关。
综上所述,本研究筛选出CSFV感染诱导差异表达的miRNA,为以后研究miRNA介导调控CSFV感染和从miRNA方面揭示CSFV致病机理奠定了基础。此外,细胞凋亡作为宿主抗病毒感染的第一道防线,是宿主细胞自身受外界刺激下启动的死亡程序,不利于病毒复制。但许多病毒却可以利用细胞某些调控机制延迟或者抑制细胞发生凋亡,从而有利于自身复制。本试验初步揭示了CSFV诱导的miR-214的功能和作用,表明在CSFV感染过程中miR-214可能参与调控细胞凋亡,从而有利于CSFV在细胞内的复制和持续性感染,为了解CSFV的致病机制提供新的方向,也为防控CSFV感染寻找新的作用靶位提供一个新的思路。
4 结论
利用miRNA表达谱芯片筛选CSFV感染PK-15细胞后差异表达的miRNAs,结果表明,CSFV感染PK-15细胞诱导69条差异表达的猪源miRNAs,其中包括上调表达的39条,下调表达的30条。
CSFV感染PK-15细胞后上调miR-214表达,且miR-214抑制PK-15细胞凋亡,促进CSFV RNA的复制。miR-214靶向于TRADD蛋白,作用于TRADD 3′UTR。即CSFV感染宿主细胞后,通过促进miR-214的表达从而抑制TRADD的表达水平,达到抑制细胞凋亡的目的,使CSFV实现持续感染。
[1] MOENNIG V. Introduction to classical swine fever: virus, disease and control policy.2000, 73 (2/3): 93-102.
[2] STEGEMAN A, ELBERS A, DE SMIT H. The 1997-1998 epidemic of classical swine fever in the netherlands.2000, 73 (2/3): 183-196.
[3] BARTEL D P. Micrornas: Target recognition and regulatory functions.2009, 136(2): 215-233.
[4] FLYNT A S, LI N, THATCHER E J,SOLNICA-KREZEL L, PATTON J G. Zebrafish Mir-214 modulates hedgehog signaling to specify muscle cell fate.2007, 39(2): 259-263.
[5] MICHAEL M Z, O' C S, VAN HOLST P N,YOUNG G P, JAMES R J. Reduced accumulation of specific micrornas in colorectal neoplasia.2003, 1 (12): 882-891.
[6] CAMERON J E, YIN Q, FEWELL C, LACEY M, MCBRIDE J, WANG X, LIN Z, SCHAEFER B C, FLEMINGTON E K. Epstein- barr virus latent membrane protein 1 induces cellular microrna mir-146a, a modulator of lymphocyte signaling pathways.2008, 82(4): 1946-1958.
[7] ZHAO H, WEN G, HUANG Y,YU X, CHEN Q, AFZAL T A, LUONG LE A, ZHU J, YE S, ZHANG L, XIAO Q. Microrna-22 regulates smooth muscle cell differentiation from stem cells by targeting methyl cpg-binding protein 2.2015, 35(4): 918-929.
[8] YANG M, LIU R, LI X,LIAO J, PU Y, PAN E, YIN L, WANG Y. Mirna-183 suppresses apoptosis and promotes proliferation in esophageal cancer by targeting pdcd4., 2014, 37(12): 873-880.
[9] XU P, VERNOOY S Y, GUO M, HAY B A. The drosophila micrornamir-14 suppresses cell death and is required for normal fat metabolism., 2003, 13(9): 790-795.
[10] BOUTLA A, DELIDAKIS C, TABLER M. Developmental defects by antisense-mediated inactivation of micro-rnas 2 and 13 in drosophila and the identification of putative target genes.2003, 31(17): 4973-4980.
[11] NEILSON J R, ZHENG G X, BURGE C B, SHARP P A. Dynamic regulation of mirna expression in ordered stages of cellular development., 2007, 21(5): 578-589.
[12] LI Q J, CHAU J, EBERT P J, SYLVESTER G, MIN H, LIU G, BRAICH R, MANOHARAN M, SOUTSCHEK J, SKARE P, KLEIN L O, DAVIS M M, CHEN C Z. Mir-181a is an intrinsic modulator of t cell sensitivity and selection.2007, 129 (1): 147-161.
[13] VIGORITO E, PERKS K L, ABREU-GOODGER C,BUNTING S, XIANG Z, KOHLHAAS S, DAS PP, MISKA E A, RODRIGUEZ A, BRADLEY A, SMITH KG, RADA C, ENRIGHT A J, TOELLNER K M, MACLENNAN I C, TURNER M. Microrna-155 regulates the generation of immunoglobulin class-switched plasma cells., 2007, 27(6): 847-859.
[14] KUMAR A. Rna interference: a multifaceted innate antiviral defense.2008, 5: 17.
[15] LECELLIER C H, DUNOYER P, ARAR K, LEHMANN-CHE J, EYQUEM S, HIMBER C, SAÏB A, VOINNET O. A Cellular microrna mediates antiviral defense in human cells., 2005, 308(5721): 557-560.
[16] TILI E, MICHAILLE J J, CIMINO A, COSTINEAN S, DUMITRU C D, ADAIR B, FABBRI M, ALDER H, LIU C G, CALIN G A, CROCE C M. Modulation of Mir-155 and Mir-125B levels following lipopolysaccharide/Tnf-Alpha stimulation and their possible roles in regulating the response to endotoxin shock.2007, 179 (8): 5082-5089.
[17] TAGANOV K D, BOLDIN M P, CHANG K J, BALTIMORE D. Nf-kappab-dependent induction of microrna mir-146, an inhibitor targeted to signaling proteins of innate immune responses.2006, 103 (33): 12481-12486.
[18] 张旭, 张彦明, 张倩, 程媛媛, 谭晓妮. 稳定表达猪Mirna Let-7C细胞株的建立及其对CSFV的调控作用. 西北农林科技大学学报(自然科学版), 2010(12): 1-6.
ZHANG X, ZHANG Y M, ZHANG Q, CHENG Y Y, TAN X N. Establishment of cell line expressing miRNA let-7c and regulation on classical swine fever virus., 2010(12): 1-6. (in Chinese)
[19] CHEN Y, CHEN J, WANG H, SHI J, WU K, LIU S, LIU Y, WU J. Hcv-induced Mir-21 contributes to evasion of host immune system by targeting Myd88 and Irak1., 2013, 9(4): e1003248.
[20] JOPLING C L, NORMAN K L, SARNOW P. Positive and negative modulation of viral and cellular mrnas by liver-specific microrna Mir-122., 2006, 71: 369-376.
[21] BENSAUDE E, TURNER J L, WAKELEY P R M,SWEETMAN D A, PARDIEU C, DREW T W, WILEMAN T, POWELL P P. Classical swine fever virus induces proinflammatory cytokines and tissue factor expression and inhibits apoptosis and interferon synthesis during the establishment of long-term infection of porcine vascular endothelial cells.2004, 85 (Pt 4): 1029-1037.
[22] HSU H, XIONG J, GOEDDEL D V. The TNF Receptor 1-associated protein tradd signals cell death and Nf-Kappa B activation.1995, 81(4): 495-504.
[23] MICHEAU O, TSCHOPP J. Induction of TNF receptor I-mediated apoptosis via two sequential signaling complexes.2003, 114(2): 181-190.
[24] SONG L, LIU H, GAO S, JIANG W, HUANG W. Cellular micrornas inhibit replication of the H1N1 influenza a virus in infected cells.2010, 84(17): 8849-8860.
[25] JOHNS H L, BENSAUDE E, LA ROCCA S A,SEAGO J, CHARLESTON B, STEINBACH F, DREW T W, CROOKE H, EVERETT H. Classical swine fever virus infection protects aortic endothelial cells from Pipc-Mediated apoptosis.2010, 91 (Pt 4): 1038-1046.
[26] WANG F, LIU M, LI X, TANG H. Mir-214 reduces cell survival and enhances cisplatin-induced cytotoxicity via down-regulation of Bcl2L2 in cervical cancer cells., 2013, 587(5): 488-495.
[27] ZHANG Z C, LI Y Y, WANG H Y, FU S, WANG X P, ZENG M S, ZENG Y X, SHAO J Y. Knockdown of miR-214 promotes apoptosis and inhibits cell proliferation in nasopharyngeal carcinoma., 2014, 9(1): e86149.
[28] GRIFFIN D E, HARDWICK J M. Regulators of apoptosis on the road to persistent alphavirus infection., 1997, 51: 565-592.
[29] KROEMER G, GALLUZZI L, BRENNER C. Mitochondrial membrane permeabilization in cell death.2007, 87(1): 99-163.
[30] KUROKAWA M, KORNBLUTH S. Caspases and kinases in a death grip.2009, 138 (5): 838-854.
Screen of MicroRNAs in Classical Swine Fever Virus-Infected PK-15 Cells and the Regulation of Virus Replication by miR-214
DENG ShaoFeng, YE ZuoDong, FAN ShuangQi, CHEN JinDing , ZHANG JingYuan, ZHU MengJiao, ZHAO MingQiu
(College of Veterinary Medicine, South China Agricultural University, Guangzhou 510642)
【Objective】In this study, differential expression of miRNAs in CSFV-infected PK-15 cells were determined by miRNA expression array, and further explore the function of miRNAs in the pathogenic of Classical swine fever virus (CSFV), and provide some new basis for the prevention and control of Classical swine fever (CSF) .【Method】In order to investigate the changes of the miRNAs expression in CSFV-infected PK-15 cells, we synthesized probes of 326 miRNAs of pig according to the miRBase database version 19.0, and screening of differential expression of miRNAs in CSFV-infected PK-15 cells using miRNA expression array. Then, miR-214, the most obvious difference in expression of CSFV-infected PK-15 cells, was selected as the further study object to investigate the function of miR-214 in the infection process of CSFV. We detected mRNA expression of miR-214 in CSFV-infected PK-15 cells using qRT-PCR. In order to further study the effect of miR-214 of CSFV infection, we synthesized miR-214 analog and inhibitor and transfected into PK-15 cells respectively, follow with CSFV infection at 24 h post-transfection, and then detected CSFV titers and quantity of CSFV genomic copies. In order to further explore the mechanism of miR-214 participate in the regulation of CSFV replication, we predicted the target protein of miR-214 using bioinformatics software and confirmed it by luciferase reporter gene system. Given TRADD can specific interacts with TNFR1 intracellular dead zones and participate in the programmed cell death, we assume that miR-214 influencing apoptosis of PK 15 cells by influencing expression level of target protein TRADD. PK 15 cells transfected with miR-214 and inhibitor respectively, follow with CSFV infection at 24 h post-transfection. At 48 h post-infection, the expression levels of TRADD were detected, and the effect of miR-214 on the apoptosis of CSFV-infected PK-15 cells was detected by flow cytometry. 【Result】69 miRNAs with different expressions were screened by miRNA expression array in CSFV-infected PK-15 cells. Among which the expression changes of miR-214 were most obvious and up-regulated, and confirmed it by qRT-PCR. After transfected with miR-214 to PK-15 cells, CSFV titers and quantity of CSFV genomic copies decreased significantly, while transfected with miR-214 inhibitor, CSFV titers and quantity of CSFV genomic copies were increased significantly, which suggested that miR-214 promoted the replication of CSFV. In order to further explore the mechanism of miR-214 promoting CSFV replication, we confirmed TRADD is the target protein of miR-214. After transfected miR-214 to PK-15 cells, mRNA and protein expression of TRADD were increased significantly, while transfected with miR-214 inhibitor, that were decreased significantly, suggesting that miR-214.inhibits the expression of TRADD. And then, we verified that CSFV infection inhibits apoptosis of PK-15 cells, and miR-214 inhibits apoptosis of CSFV-infected PK-15 cells. 【Conclusion】The expression of miR-214 in cells was up-regulated after CSFV infected PK-15. miR-214 inhibits the apoptosis of PK-15 cells and promote the replication of CSFV in cells by targeting inhibits the expression of TRADD protein.
CSFV; miRNA; replication; TRADD; apoptosis
10.3864/j.issn.0578-1752.2018.21.014
2018-04-18;
2018-09-07
国家重点研发计划(2017YFD0501104,2017YFD0500600)、广州市科技计划项目(201803020005)、国家自然科学基金(U1405216,31472200,31672590)
邓少锋,E-mail:dsf4530@126.com。通信作者赵明秋,E-mail:zmingqiu@scau.edu.cn
(责任编辑 林鉴非)

