利用胚挽救技术创制无核抗寒葡萄新种质
赵雅楠,骆强伟,王跃进
利用胚挽救技术创制无核抗寒葡萄新种质
赵雅楠1,骆强伟2,王跃进1
(1西北农林科技大学园艺学院/旱区作物逆境生物学国家重点试验室/农业部西北地区园艺作物生物与种质创制重点试验室,陕西杨凌 712100;2新疆维吾尔自治区葡萄瓜果研究所,新疆鄯善 838201)
【目的】获得无核抗寒葡萄新种质并提高抗寒无核葡萄胚挽救育种效率。【方法】以7个杂交组合的胚珠作为试验材料,研究不同亲本基因型、基本培养基类型(MM3和ER)、不同氨基酸(MM3+2.5 mmol·L-1半胱氨酸、天冬酰胺、谷氨酰胺、丝氨酸)对无核葡萄胚发育率和成苗率的影响。从杂交亲本中分别利用无核探针GSLP1-569、SCC8-1018和抗寒的分子标记S241-717,确定能扩增出特异带的亲本,再用相应的分子标记对其杂种后代进行无核和抗寒性状的鉴定。【结果】7个杂交组合接种至MM3培养基的胚珠为1 168个,获得发育胚331个和杂种后代97株,杂交组合‘红宝石无核’ב北醇’的胚发育率和成苗率最高,分别为46.00%和17.33%。通过比较母本基因型,以‘双优’为父本,‘红脸无核’‘无核白’‘昆香无核’为母本,杂交组合‘昆香无核’ב双优’获得胚发育率和成苗率最高,分别为45.39%和16.31%;以‘北冰红’为父本,‘红脸无核’‘美丽无核’‘无核白’为母本,杂交组合‘红脸无核’ב北冰红’获得胚发育率和成苗率最高,分别为33.52%和6.59%。父本基因型对胚挽救成苗有一定影响,‘红脸无核’ב北冰红’和‘红脸无核’ב双优’,胚发育率分别为33.52%、39.00%,成苗率为6.59%、9.50%;‘无核白’ב北冰红’和‘无核白’ב双优’的胚发育率分别为7.64%、19.26%,成苗率为1.91%、8.15%。接种至MM3培养基的胚珠,获得的胚发育率和成苗率均高于ER培养基。杂交组合‘昆香无核’ב双优’的胚珠接种至添加2.5 mmol·L-1谷氨酰胺的MM3培养基,获得胚发育率最高,为59.69%;添加天冬酰胺、谷氨酰胺培养的杂种胚珠获得的成苗率分别为21.43%、20.93%,对成苗促进作用显著;对于杂交组合‘红宝石无核’ב北醇’,添加2.5 mmol·L-1天冬酰胺的胚发育率最高,为55.71%;添加天冬酰胺、谷氨酰胺培养的杂种胚珠的成苗率分别为21.43%、22.22%,对成苗促进作用显著。利用无核标记GSLP-569、SCC8-1018和抗寒分子标记S241-717,共检测了6个杂交组合的83个杂种株系,其中携带无核分子标记的杂种株系49个,抗寒分子标记的杂种株系55个,同时携带无核和抗寒标记的杂种株系36个。【结论】‘昆香无核’和‘红脸无核’适宜作为胚挽救育种的母本材料。‘双优’作为父本比‘北冰红’的胚挽救效率更高。MM3适宜作为胚发育培养基。MM3培养基中添加酰胺类氨基酸可以促进胚挽救成苗。分子标记检测的83个杂种株系中,36个杂种株系携带无核抗寒分子标记。
无核葡萄;抗寒性;胚挽救;胚珠培养;分子标记辅助选择
0 引言
【研究意义】葡萄是世界范围内主要的果树种类之一,占世界水果栽培总面积的14.1%[1-2]。无核葡萄因在鲜食和制干上具有独特优势而深受消费者青睐,美国市场中的大部分鲜食葡萄和制干葡萄为无核品种[3-5]。一般利用传统杂交育种培育无核葡萄只能采用有核×无核葡萄的方式进行杂交,育种年限长,无核后代效率低。胚挽救技术可将种子败育型无核葡萄作母本,提高杂种后代无核率和育种效率。现栽培无核葡萄品种多为欧亚种(),品质优良,但抗寒性差。在中国北方地区冬季需埋土防寒,增加了成本[6],每天达到625—1 000元/hm2[7],耗时耗力。因此,利用胚挽救技术缩短育种年限,通过以无核葡萄作母本,抗寒性强的葡萄作父本,可提高选育出抗寒、优质无核葡萄的育种效率,进而减少葡萄冬季埋土防寒的损耗,具有重要价值[6]。【前人研究进展】1982年,Ramming等[8]首次报道利用改良的White培养基培养无核葡萄胚珠,获得两株实生苗。此后,Emmershad等[9-10]继续深入研究基因型、取样时期、培养基及其相互作用对无核葡萄胚珠内培养的影响,建立了辅助无核葡萄育种的胚挽救技术程序。亲本基因型的筛选与离体培养基的组成是提高育种效率的重要因素,如何提高成苗率和育种效率仍然是胚挽救育种的重要课题[11]。目前筛选出的优良品种或品系,亲本多为欧洲葡萄[4-5,12-13],突出问题是抗寒性差。抗寒性是受多数基因控制的数量性状,葡萄属植物全部19对染色体上均承担同等分量的抗寒值。我国抗寒葡萄育种始于1952年,主要以山葡萄作为欧亚种或欧美杂种导入优良品质的亲本[14]。中国野生葡萄中的一些种或株系抗寒性强,可作为抗寒无核葡萄胚挽救育种的重要种质资源。【本研究切入点】从胚挽救影响的因素出发,配置无核品种×抗寒品种的杂交组合;优化胚发育基本培养基,对杂种后代进行早期无核、抗寒性状的辅助筛选。【拟解决的关键问题】通过比较亲本基因型和对胚发育培养基的筛选与优化,提高无核葡萄品种胚挽救效率。同时将中国野生葡萄和欧山杂种葡萄抗寒性基因融入到无核品种中,筛选携带无核和抗寒标记的胚挽救苗,以期获得抗寒性强的无核新种质。
1 材料与方法
试验于2017年4月至2018年4月在新疆维吾尔自治区葡萄瓜果研究所、旱区作物逆境生物学国家重点实验室和西北农林科技大学种质资源圃完成。
1.1 试验材料
以种子败育型无核品种‘昆香无核’‘无核白’‘红脸无核’‘美丽无核’及‘红宝石无核’为母本。以抗寒性较强的山葡萄‘双优’(‘双庆’ב左山一’)、欧山杂种‘北冰红’(‘左优红’× 84-26-53)和‘北醇’(‘玫瑰香’ב山葡萄’)为父本。杂交组合配置详见表1。
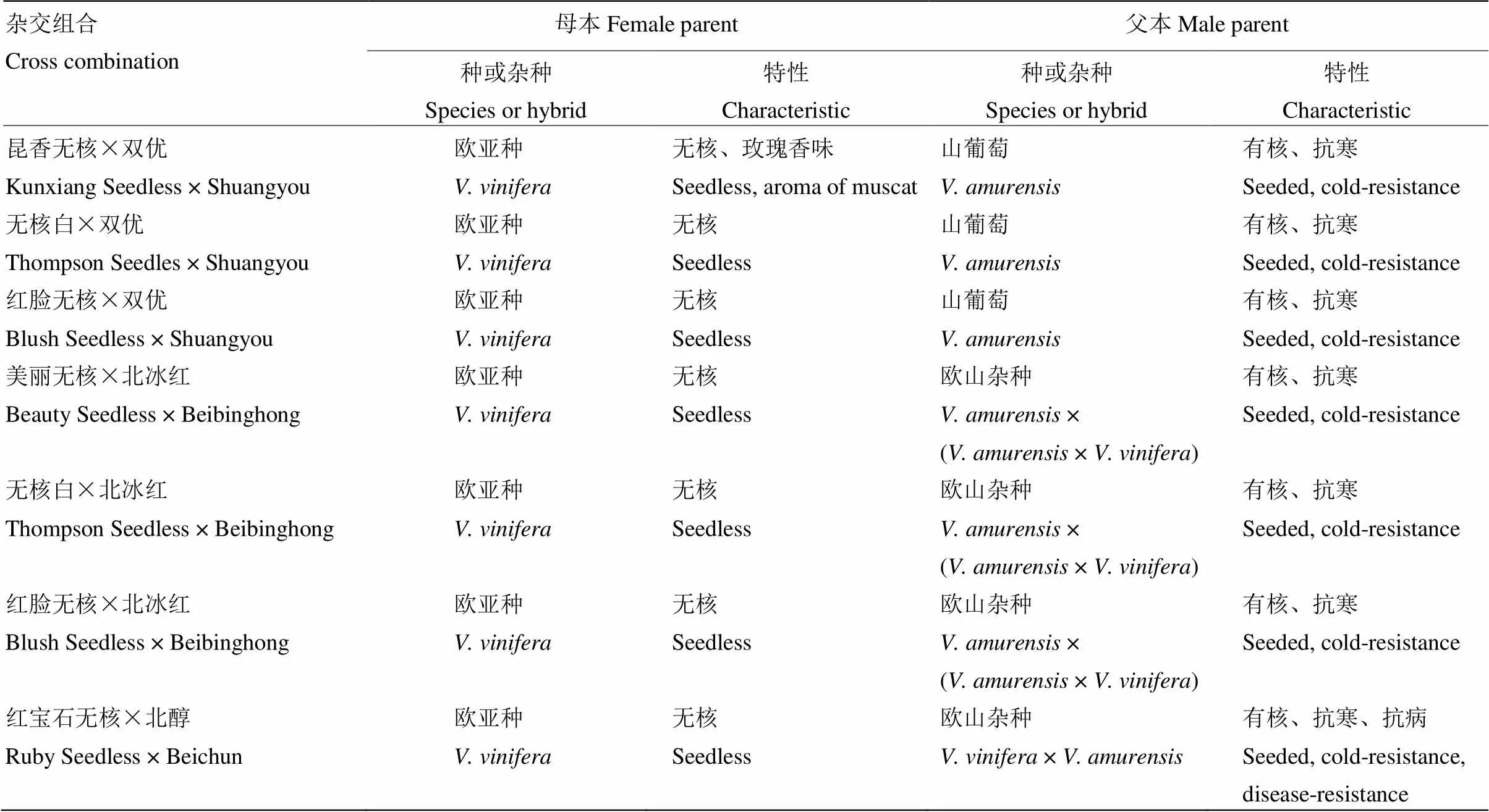
表1 杂交组合配置
1.2 试验方法
1.2.1 胚挽救技术的基本操作流程 选择长势健壮的母本及结果母枝,对发育良好的花序去雄。去雄后套袋标记。待柱头出现透明黏液时进行人工授粉。连续授粉2—3次,每次间隔24 h。根据母本的授粉日期,采集杂交果实。
胚挽救程序参照唐冬梅[1]的方法进行。将长度>2 mm的部分胚珠接种于发育培养基中,所用的发育培养基为MM3+60 g·L-1蔗糖+0.5 g·L-1水解酪蛋白+0.1 g·L-1肌醇+3 g·L-1活性炭+7 g·L-1琼脂,每个容器接种15粒胚珠,其余胚珠用于不同组分的发育培养基试验。暗培养10周后,无菌条件下剖取胚,接种至胚萌发培养基(WPM+20 g·L-1蔗糖+0.2 mg·L-16-BA+0.1 g·L-1肌醇+1 g·L-1活性炭+7 g·L-1琼脂)上。光照过程中统计不同组合发育胚的个数和正常成苗数,计算最终的胚发育率和成苗率,参考屈田田[15]的方法。
1.2.2 胚发育基本培养基对胚挽救的影响 ‘无核白’ב双优’和‘红宝石无核’ב北醇’的胚珠接种于ER或MM3培养基,比较基本培养基对胚挽救的影响。所用ER培养基和MM3培养基的主要成分参考文献[6]。每种培养基接种40—50粒胚珠,重复3次。
1.2.3 胚发育培养基中添加不同氨基酸对胚挽救的影响 以杂交组合‘昆香无核’ב双优’和‘红宝石无核’ב北醇’杂交后的胚珠接种于MM3基础培养基中,培养基内分别添加2.5 mmol·L-1的半胱氨酸、天冬酰胺、谷氨酰胺和丝氨酸,以不添加氨基酸的MM3培养基为对照。
上述培养基采用固体形式。每种处理接种30—150粒胚珠,重复3次。
1.2.4 杂交后代无核、抗寒性状的早期检测 参考文献[6]的方法,提取杂交后代株系基因组DNA,使用无核标记GLSP1-569、SCF27-2000和SCC8-1018,抗寒标记S241-717进行检测。
1.2.5 数据分析 试验数据使用SPSS 22软件进行差异显著性分析。
2 结果
2.1 无核抗寒葡萄胚挽救杂交组合成苗及基因型对胚挽救成苗的影响
2.1.1 无核抗寒葡萄胚挽救杂交组合成苗情况 2017年共配置7个杂交组合,其中1 168个胚珠接种于MM3胚发育培养基中,获得发育胚331个,成苗97株。杂交组合‘红宝石无核’ב北醇’的胚发育率和成苗率均最高,分别为46.00%和17.33%(表2)。
2.1.2 不同母本基因型对胚挽救成苗的影响 以‘双优’为父本,‘昆香无核’‘无核白’‘红脸无核’为母本的杂交组合的胚发育率分别为45.39%、19.26%、39.00%,成苗率分别为16.31%、8.15%、9.50%,‘昆香无核’ב双优’的胚发育率和成苗率最高;以‘北冰红’为父本,‘美丽无核’‘无核白’‘红脸无核’为母本的杂交组合的胚发育率分别为10.34%、7.64%、33.52%,成苗率为1.48%、1.91%、6.59%,‘红脸无核’ב北冰红’的胚发育率和成苗率最高。结果表明,‘昆香无核’与‘红脸无核’适宜作为胚挽救母本(表2)。
2.1.3 不同父本基因型对胚挽救成苗的影响 在以‘红脸无核’为母本的两个杂交组合‘红脸无核’ב北冰红’和‘红脸无核’ב双优’中,胚发育率分别为33.52%、39.00%,成苗率分别为6.59%、9.50%;以‘无核白’为母本的杂交组合‘无核白’ב北冰红’和‘无核白’ב双优’的胚发育率分别为7.64%、19.26%,成苗率为1.91%、8.15%。因此,‘双优’要优于以‘北冰红’作为父本的胚挽救效率(表2)。
2.2 不同培养基组分对胚挽救成苗的影响
2.2.1 基本培养基对胚挽救效率的影响 ‘无核白’ב双优’和‘红宝石无核’ב北醇’的胚珠分别接种到MM3或ER基本培养基。结果表明,接种至MM3培养基所获得的胚发育率和成苗率均显著高于ER培养基(表3),说明MM3培养基更有利于胚的发育和成苗。
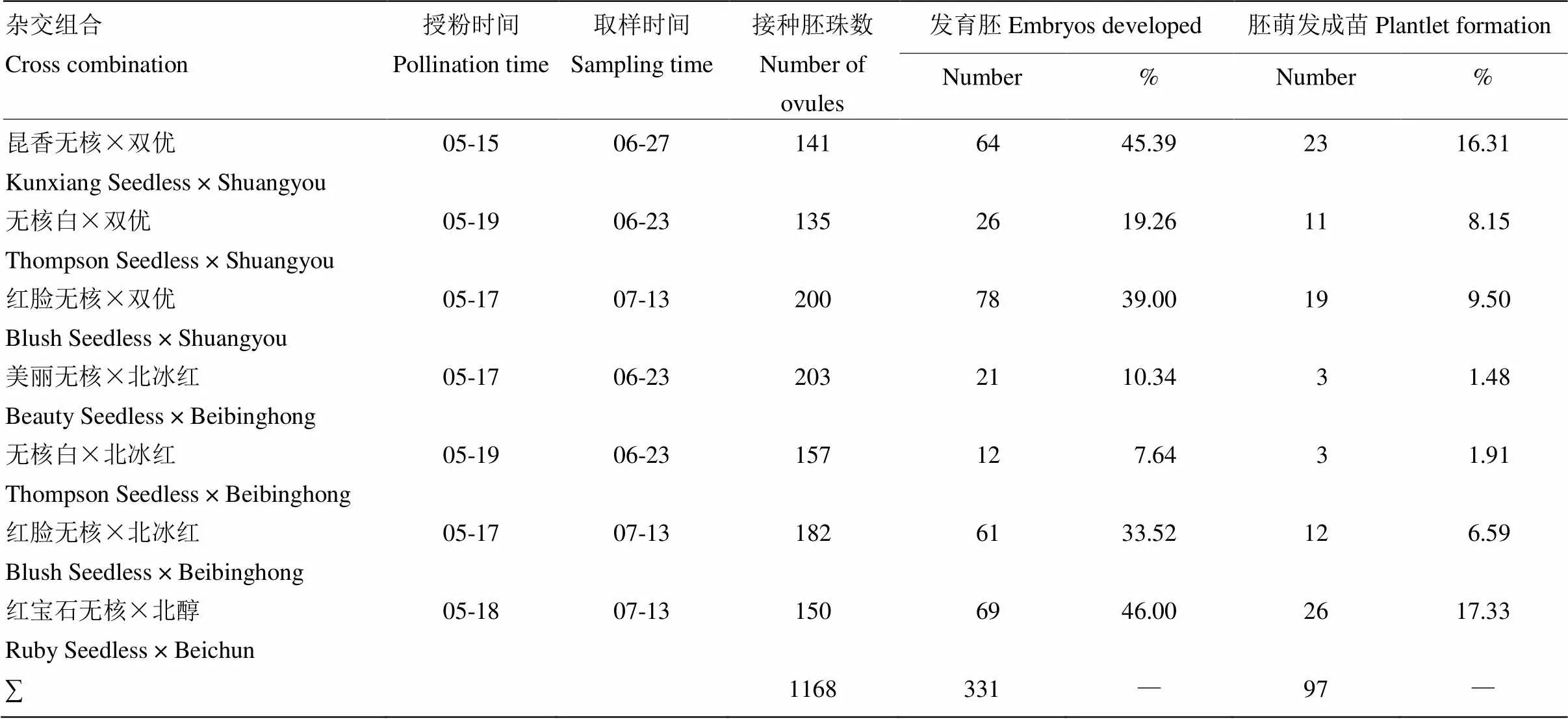
表2 杂交组合胚挽救成苗情况
以上所有杂交组合胚珠均接种于MM3发育培养基中 Ovules of combinations all above are cultured in MM3 medium
2.2.2 不同氨基酸对胚挽救效率的影响 对于杂交组合‘昆香无核’ב双优’,在MM3培养基中添加2.5 mmol·L-1谷氨酰胺的胚发育率最高达59.69%,显著高于对照45.39%,说明谷氨酰胺能促进该组合胚的发育。添加天冬酰胺和丝氨酸的胚发育率(47.86%和53.33%)虽高于对照,但无显著性差异。添加天冬酰胺、谷氨酰胺培养的杂种胚珠获得的成苗率分别为21.43%、20.93%,显著高于对照16.31%,说明天冬酰胺、谷氨酰胺对该组合成苗均具有促进作用(表3)。
对于杂交组合‘红宝石无核’ב北醇’,添加2.5 mmol·L-1天冬酰胺的胚发育率最高达55.71%,显著高于对照46.00%,说明天冬酰胺对该组合胚发育具有促进作用。添加天冬酰胺、谷氨酰胺培养的杂种胚珠获得的成苗率分别为21.43%、22.22%,显著高于对照17.33%,说明两种氨基酸均能促进‘红宝石无核’ב北醇’的成苗。添加谷氨酰胺的‘红宝石无核’ב北醇’杂交子代成苗率最高,其成苗根系发达,叶色浓绿,植株茎端粗壮,长势较好(图1-D)。添加半胱氨酸的成苗率为11.49%,显著低于对照,对该组合的成苗具有抑制作用(表3)。
上述试验证明,不同氨基酸对两个杂交组合的胚发育和成苗影响略有差异。通过比较发现添加了酰胺类物质的培养基对两种组合的成苗均有显著促进作用,两种组合成苗率均达20%以上。
2.3 杂交亲本的无核、抗寒性状检测
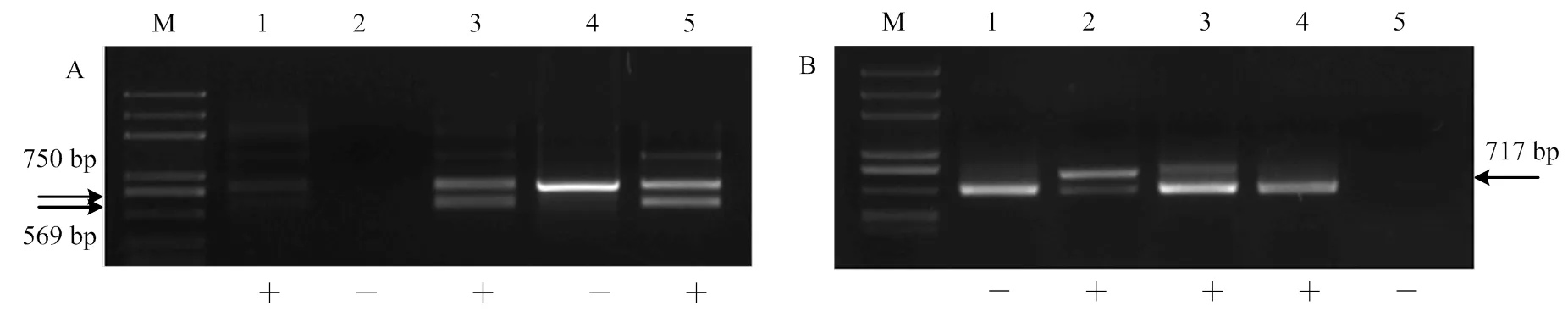
2.3.1 不同无核标记对杂交亲本的检测 利用3种无核标记对8个杂交亲本品种进行PCR分析的分子标记检测。无核基因探针GSLP1-569的检测结果表明,‘无核白’携带无核分子标记,其余亲本未扩增出特异条带。因此无核基因探针GSLP1-569可用于杂交组合‘无核白’ב北冰红’和‘无核白’ב双优’的杂种鉴定(图2-A);无核标记SCF27-2000的检测结果中,母本‘红脸无核’‘美丽无核’‘昆香无核’‘红宝石无核’与父本有核品种‘北冰红’‘双优’‘北醇’都具有2 000 bp特异条带,该标记不适用于对本试验杂交后代早期无核性状的鉴定(图2-B);无核标记SCC8-1018检测结果中,母本‘昆香无核’‘美丽无核’‘红脸无核’携带无核标记,适用于对组合‘昆香无核’ב双优’‘美丽无核’ב北冰红’‘红脸无核’ב北冰红’‘红脸无核’ב双优’的杂种进行早期无核性状的检测。‘红宝石无核’和父本有核品种‘北醇’携带无核标记,不适用对杂交组合‘红宝石无核’ב北醇’的杂种后代筛选(图2-C)。
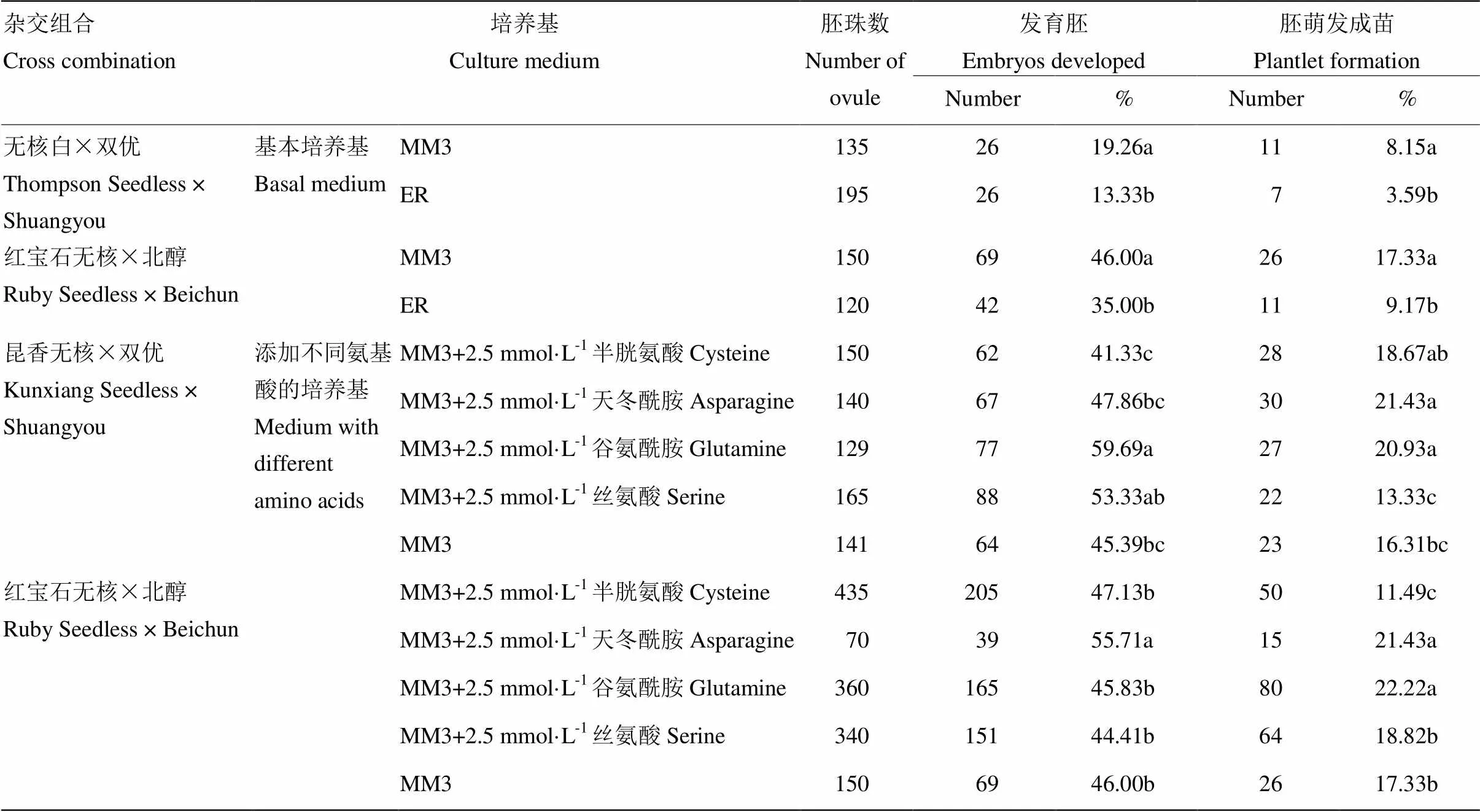
表3 不同发育培养基组分对不同杂交组合胚挽救成苗的影响
不同小写字母代表在<0.05 水平上差异显著 Means with different lowercases indicate significantly different at<0.05 level
2.3.2 抗寒标记S241-717对杂交亲本的检测 抗寒标记S241-717对8个杂交亲本进行PCR扩增,父本‘北冰红’和‘双优’在717 bp处扩增出特异条带。因此可用于以‘北冰红’和‘双优’为父本的杂交组合的杂交子代早期抗寒性状初步鉴定(图2-D)。

A:MM3;B—E:MM3+2.5 mmol·L-1半胱氨酸、天冬酰胺、谷氨酰胺、丝氨酸MM3+2.5 mmol·L-1 cysteine, asparagine, glutamine, serine
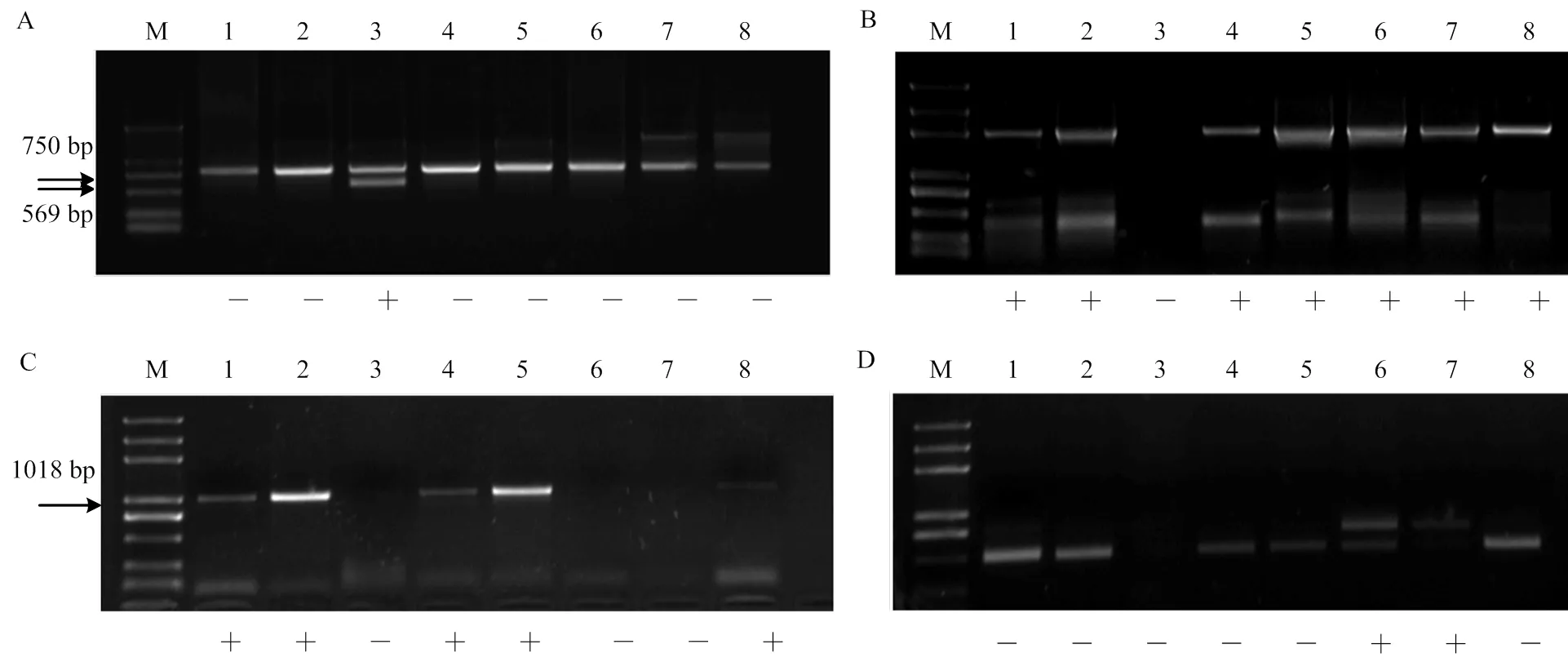
A:无核探针GSLP1-569 The probe of GSLP1-569 linked to seedlessness gene;B:无核标记SCF27-2000 The molecular marker of SCF27-2000 linked to seedlessness gene;C:无核标记SCC8-1018 The molecular marker of SCC8-1018 linked to seedlessness gene;D:抗寒标记S241-717 The molecular marker of S241-717 linked to the hardiness gene;M:Marker (DL2000Plus);1:昆香无核Kunxiang Seedless;2:美丽无核Beauty Seedless;3:无核白Thompson Seedless;4:红脸无核Blush Seedless;5:红宝石无核Ruby Seedless;6:北冰红Beibinghong;7:双优Shuangyou;8:北醇Beichun;“+”表示特异条带出现,“-”表示特异条带不出现,下同“+” indicates this material DNA contains specific band and “-” indicates this material DNA contains no specific band. The same as below
2.4 利用不同分子标记对杂交后代无核、抗寒性状鉴定
2.4.1 无核基因探针GSLP1-569和抗寒标记S241-717对杂交后代的检测 无核探针GSLP1-569对‘无核白’ב北冰红’3个杂交后代的DNA扩增结果中,株系C-1和C-3具有569 bp的特异性条带(图3-A)。抗寒标记S241-717对‘无核白’ב北冰红’后代的扩增结果中,株系C-1和C-2扩增出717 bp特异性条带(图3-B)。同扩增出无核和抗寒特异性条 带的株系为C-1(图3-A、3-B)。
利用无核基因探针GSLP1-569对‘无核白’ב双优’16个杂交后代进行检测,其中10个株系扩增出569 bp的特异性条带(图4-A)。利用抗寒基因标记S241-717对‘无核白’ב双优’杂交后代进行检测,有9个株系扩增出特异性条带(图4-B)。筛选出同时具有无核和抗寒特异性条带的株系7个,编号为D-3、D-4、D-6、D-8、D-9、D-10、D-16(图4-A、4-B)。
A:无核探针GSLP1-569 The probe of GSLP1-569 linked to seedlessness gene;B:抗寒标记S241-717 The molecular marker of S241-717 linked to the hardiness gene;M:Marker (DL2000Plus);1:无核白Thompson Seedless;2:北冰红Beibinghong;3:C-1;4:C-2;5:C-3
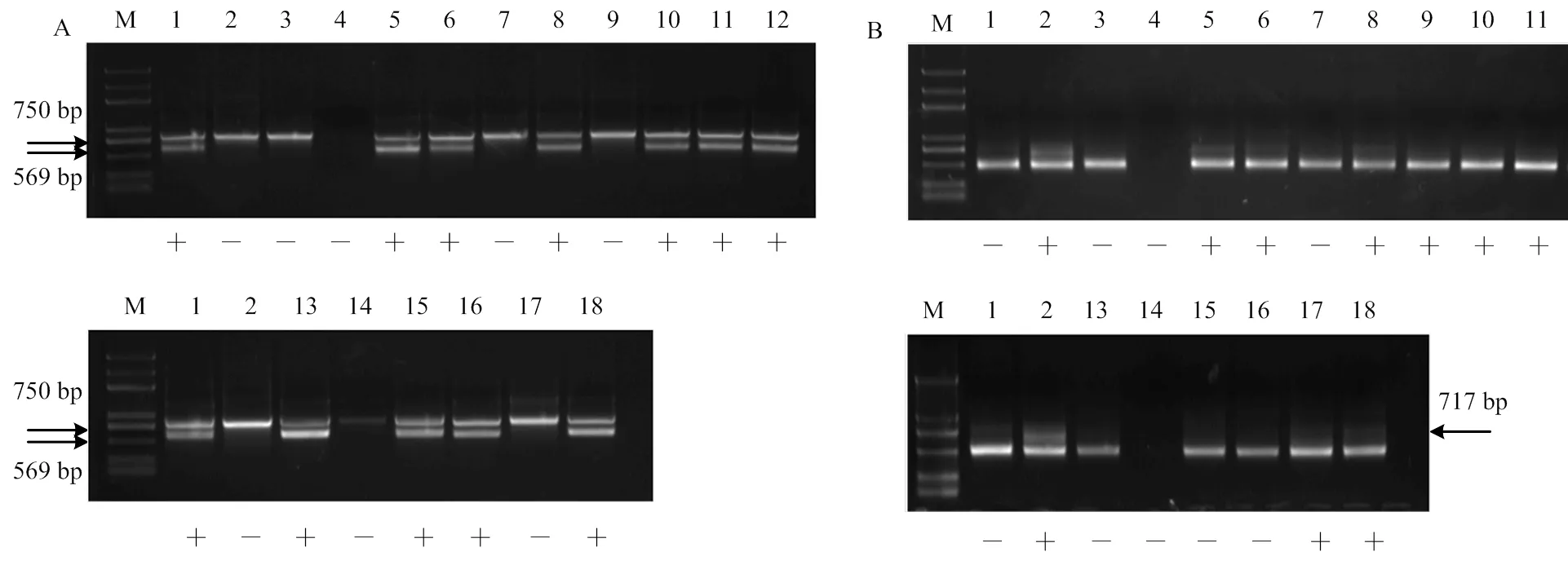
A:无核探针GSLP1-569 The probe of GSLP1-569 linked to seedlessness gene;B:抗寒标记S241-717 The molecular marker of S241-717 linked to the hardiness gene;M:Marker (DL2000Plus);1:无核白Thompson Seedless;2:双优Shuangyou;3:D-1;4:D-2;5:D-3;6:D-4;7:D-5;8:D-6;9:D-7;10:D-8;11:D-9;12:D-10;13:D-11;14:D-12;15:D-13;16:D-14;17:D-15;18:D-16
2.4.2 无核基因标记SCC8-1018和抗寒基因标记S241-717对杂交后代检测 无核标记SCC8-1018对‘红脸无核’ב北冰红’12个杂交后代进行检测结果表明,4个株系扩增出特异性条带(图5-A)。抗寒基因标记S241-717对该组合杂交后代的扩增结果中,具有特异性条带的株系7个(图5-B)。筛选出同时具有无核和抗寒特异性条带的株系3个,编号为F-5、F-6和F-10(图5-A、5-B)。
无核标记SCC8-1018对‘红脸无核’ב双优’的19个杂交后代进行PCR扩增结果表明,10个株系扩增出特异性条带(图6-A)。抗寒基因标记S241-717对该组合杂交后代的扩增结果表明,15个株系具有特异性条带(图6-B)。筛选出同时具有无核和抗寒特异性条带的株系9个,编号为G-2、G-3、G-5、G-8、G-10、G-11、G-13、G-16、G-19(图6-A、6-B)。
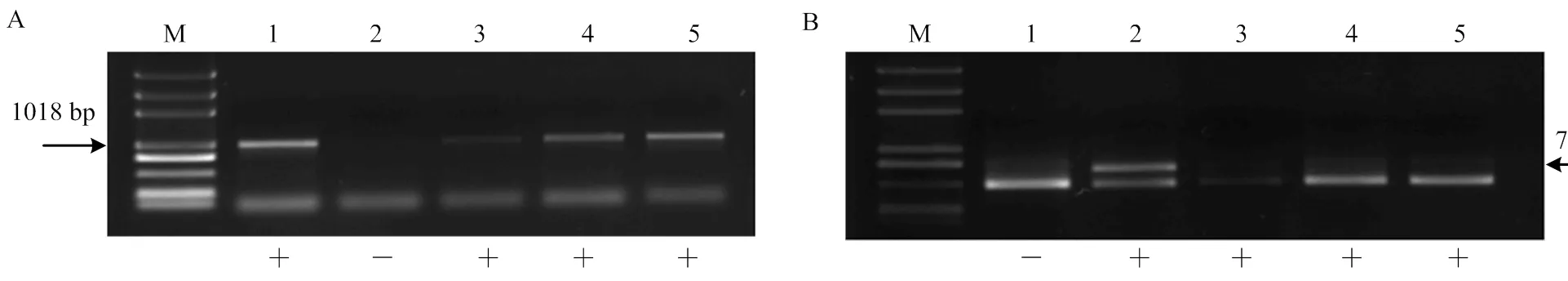
无核基因标记SCC8-1018和抗寒基因标记S241- 717检测的‘美丽无核’ב北冰红’3个杂交后代均兼有无核和抗寒的特异性条带,后代得到的无核、抗寒杂交率100%(图7-A、7-B)。
无核标记SCC8-1018 对‘昆香无核’ב双优’的30个杂交后代检测结果表明,20个株系扩增出特异性条带(图8-A)。抗寒基因标记S241-717对子代的检测结果表明,19个株系具有特异性条带(图8-B)。同时筛选出具有无核和抗寒特异性条带的株系13个,编号为A-3、A-5、A-6、A-7、A-9、A-10、A-13、A-14、A-15、A-16、A-19、A-24、A-26(图8-A、8-B)。
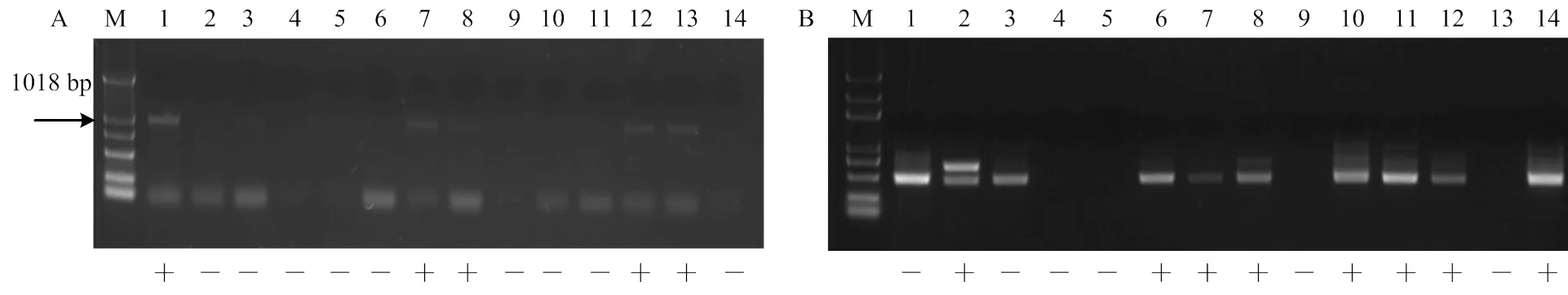
A:无核标记SCC8-1018 The molecular marker of SCC8-1018 linked to seedlessness gene;B:抗寒标记S241-717 The molecular marker of S241-717 linked to the hardiness gene;M:Marker (DL2000Plus);1:红脸无核Blush Seedless;2:北冰红Beibinghong;3:F-1;4:F-2;5:F-3;6:F-4;7:F-5;8:F-6;9:F-7;10:F-8;11:F-9;12:F-10;13:F-11;14:F-12
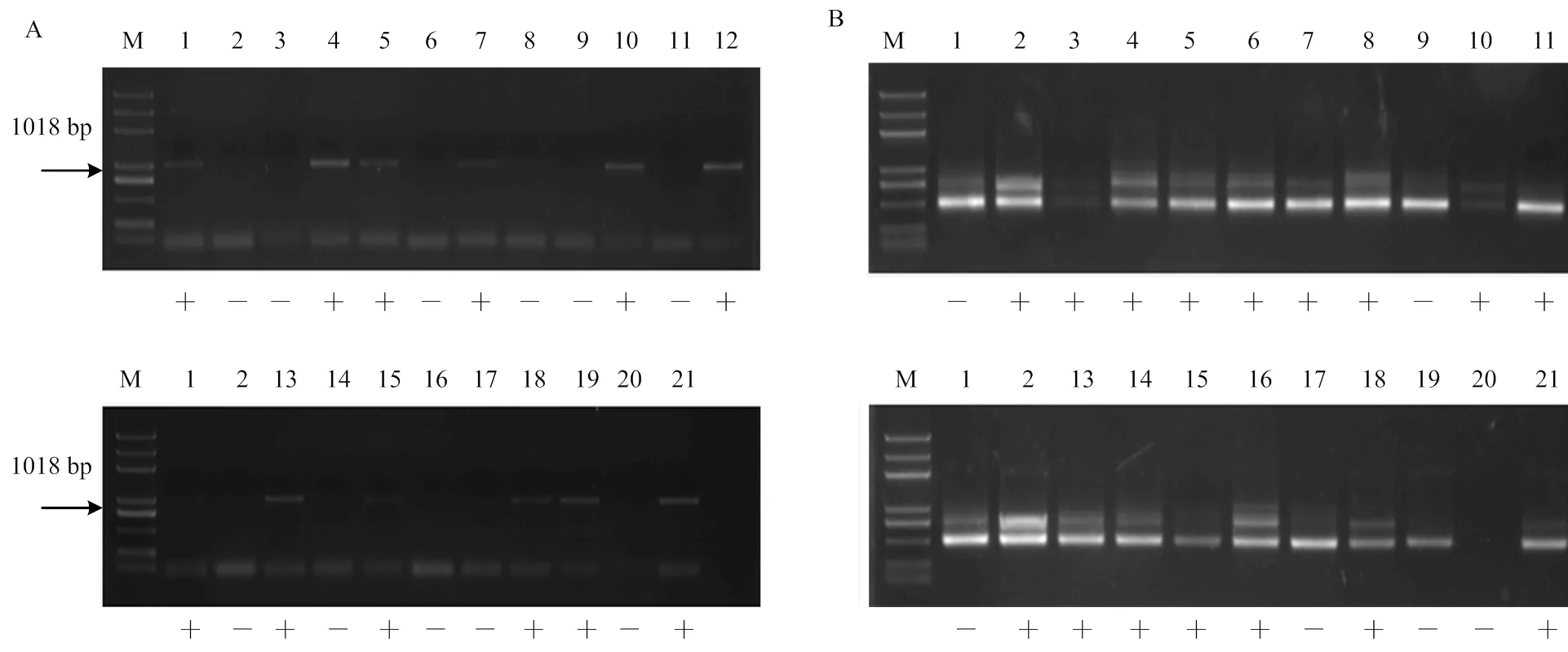
A:无核标记SCC8-1018 The molecular marker of SCC8-1018 linked to seedlessness gene;B:抗寒标记S241-717 The molecular marker of S241-717 linked to the hardiness gene;M:Marker (DL2000);1:红脸无核Blush Seedless;2:双优Shuangyou;3:G-1;4:G-2;5:G-3;6:G-4;7:G-5;8:G-6;9:G-7;10:G-8;11:G-9;12:G-10;13:G-11;14:G-12 15:G-13;16:G-14; 17:G-15;18:G-16;19:G-17;20:G-18;21:G-19
A:无核标记SCC8-1018 The molecular marker of SCC8-1018 linked to seedlessness gene;B:抗寒标记S241-717 The molecular marker of S241-717 linked to the hardiness gene;M:Marker (DL2000Plus);1:美丽无核Beauty Seedless;2:北冰红Beibinghong;3:B-1;4:B-2;5:B-3

A:无核标记SCC8-1018 The molecular marker of SCC8-1018 linked to seedlessness gene;B:抗寒标记S241-717 The molecular marker of S241-717 linked to the hardiness gene;M:Marker (DL2000);1:昆香无核Kunxiang Seedless;2:双优Shuangyou;3:A-1;4:A-2;5:A-3;6:A-4;7:A-5;8:A-6;9:A-7;10:A-8;11:A-9;12:A-10;13:A-11;14:A-12;15:A-13;16:A-14;17:A-15;18:.A-16;19:A-17;20:A-18;21:A-19;22:A-20;23:A-21;24:A-22;25:A-23;26:A-24;27:A-25;28:A-26;29:A-27;30:A-28;31:A-29;32:A-30
3 讨论
提高无核葡萄胚挽救的主要影响因素包括亲本基因型、培养基、取样时期、培养方式等。亲本间杂交的亲和力对胚挽救成苗具有重要作用[16]。本研究中杂交组合‘红宝石无核’ב北醇’获得成苗率最高,可能是由于亲本之间亲和性强,有利于合子胚的形成和萌发。杂交无核葡萄胚的发育很大程度上受到母本基因型的影响[17-20],不同种子败育型的无核葡萄中合子胚的形成能力有着较大的差异[15]。已有资料显示,胚败育发生过早或可挽救性差的品种如‘无核白’‘火焰无核’‘奇妙无核’等不宜用作母本材料[21-22],而成苗率较高的品种如‘红宝石无核’‘红脸无核’‘底莱特’等适宜作为胚挽救的母本材料[23-24]。本研究发现以‘昆香无核’‘红脸无核’为母本的杂交组合获得的成苗率高于以‘无核白’‘美丽无核’为母本的杂交组合,推测原因可能与‘昆香无核’‘红脸无核’合子胚的发育程度较高有关。
欧洲葡萄抗寒性差,不利于培育抗寒性强的无核葡萄新品种[16]。利用中国野生葡萄较强的抗寒性,通过胚挽救技术将其抗寒性基因导入欧洲无核葡萄是一个有效策略。本研究父本材料山葡萄‘双优’、欧山杂种‘北冰红’‘北醇’是通过常规杂交选育出的具有强抗寒性和高商品性的品种[25-27]。对以‘北冰红’‘双优’为父本,相同母本杂交后获得子代的成苗率进行比较,发现‘双优’作为父本的胚挽救效率更高。说明父本基因型对胚挽救效率有一定影响,基因型差异导致亲本之间的亲和力不同。
胚发育培养基为离体胚珠提供了幼胚发育所需的激素和营养物质,直接影响到胚能否存活和进一步发育,因此胚发育培养基是胚挽救成功的关键因素之一。1994年,Emershed等[10]创造的ER培养基在胚珠离体培养上取得了较好效果。但潘学军[4]认为以“无核品种×中国野生葡萄”组合为材料的胚挽救不适合以ER为基本培养基,并通过测定无核葡萄品种胚败育前浆果中的大量元素含量配制出了MM3培养基,后续结果表明MM3培养基的效果更优。本研究将‘无核白’ב双优’和‘红宝石无核’ב北醇’的杂种胚珠分别接种至MM3和ER培养基中,用MM3作为胚发育培养基的胚发育率和成苗率均优于用ER培养基,结果与潘学军的结论一致[4],MM3培养基具有较高浓度的镁离子和钾离子,钾离子是植物生长发育的必要营养元素,推测提高钾离子浓度有可能会促进无核葡萄葡萄胚的发育,镁离子在植物中主要与光合作用有关,而较高浓度的镁离子可能会促进胚挽救成苗。
氨基酸的种类对胚的发育和成苗会产生不同影响。Emershed等研究认为谷氨酰胺、天冬酰胺、半胱氨酸、丝氨酸可促进胚的发育[9-10,13]。由于‘昆香无核’ב双优’‘红宝石无核’ב北醇’胚发育率和成苗率最高,因此用其胚珠作为氨基酸对胚挽救效率影响的试验材料。本研究用MM3作为基本培养基添加上述4种氨基酸对‘昆香无核’ב双优’‘红宝石无核’ב北醇’处理得到的结果不尽相同。谷氨酰胺促进组合‘昆香无核’ב双优’胚的发育,而天冬酰胺对组合‘红宝石无核’ב北醇’胚的发育具有促进作用,说明不同氨基酸的处理对杂交组合的作用会有差异。研究发现,在发育培养基添加天冬酰胺、谷氨酰胺后对两个组合成苗均起到促进作用,与田莉莉[20]在不同品种的研究结果类似。同时研究认为谷氨酰胺不仅提高了‘红宝石无核’ב北醇’的成苗率,也促进其成苗长势。但对于不同杂交组合胚珠的培养,需通过试验获得其最适宜的胚发育培养基和成苗途径[28]。
无核抗寒葡萄胚挽救育种过程中,通过胚挽救技术获得杂种后代后,可选用无核和抗寒的分子标记对杂交子代进行辅助选择,加快所筛选杂种进入结果期,降低育种成本。目前用于无核性状标记辅助的有SCC8-1018、SCF27-2000、GSLP1-569、VMCF7F2-198和p3-VvAGL11-1200[29-33]。本研究利用亲本对3种无核标记SCC8-1018、SCF27-2000、GSLP1-569进行了筛选,得到SCC8-1018可用于对‘美丽无核’ב北冰红’‘红脸无核’ב北冰红’‘红脸无核’ב双优’‘昆香无核’ב双优’4个杂交组合所获得的杂种后代进行早期无核性状的辅助选择;GSLP1-569可用于对杂交组合‘无核白’ב北冰红’‘无核白’ב双优’的杂种后代早期无核性状的辅助选择。同时应用抗寒标记S241-717对上述杂交组合所获得的后代进行了早期抗寒性状的辅助选择。经检测6个杂交组合的83个杂种后代中,存在无核特异性条带的子代为49个,抗寒特异性条带的子代为55个,同时筛选出无核和抗寒特异性条带的子代36个。初步筛选获得了36个无核抗寒新种质。
4 结论
不同的亲本基因型对胚挽救成苗的影响不同,以‘红宝石无核’‘昆香无核’‘红脸无核’作为母本和以‘双优’作为父本的杂交组合胚挽救效率较高。MM3作为基本培养基有利于幼胚的发育和成苗;MM3培养基+酰胺类氨基酸可以促进胚挽救成苗。分子标记检测的6个杂交组合83个杂种后代中,同时携带无核和抗寒分子标记的杂种后代36个,这些杂种后代是今后田间杂种鉴定与观测的重要对象,再结合葡萄抗寒性评价标准,观察无核及抗寒性状的表现,从中选出符合育种目标的优株。
[1] 唐冬梅. 无核葡萄杂交胚挽救新种质创建与技术完善[D]. 杨凌: 西北农林科技大学, 2010.
TANG D M. Novel germplasm innovation of seedless grapes by embryo rescue and technique improvement[D]. Yangling: Northwest A&F University, 2010. (in Chinese)
[2] 彭冬燕, 袁媛, 李丹桐, 杨燕, 陈升东. 世界水果生产概况. 西南农业学报, 2006. 19(增刊): 505-507.
PENG D Y, YUAN Y, LI D T, YANG Y, CHEN S D. Introduction to global fruit’s production., 2006, 19(Suppl.): 505-507. (in Chinese)
[3] 王跃进, 万怡震. 美国加州的葡萄生产与科研. 西北农林科技大学学报 (自然科学版), 2002, 30(1): 134-140.
WANG Y J, WAN Y Z. Review of grape production and researches in California of US.(, 2002, 30(1): 134-140. (in Chinese)
[4] 潘学军. 无核抗病葡萄胚挽救技术体系优化及新品系培育[D]. 杨凌: 西北农林科技大学, 2005.
PAN X J. Innovating in the technique system of embryo rescue of stenospermocarpic grape and breeding new cultivars of both seedless and disease-resistance traits[D]. Yangling: Northwest A&F University, 2005. (in Chinese)
[5] 郭海江. 抗病无核葡萄新种质创制及分子标记辅助育种[D]. 杨凌: 西北农林科技大学, 2005.
GUO H J. Germplasm innovation of disease resistant and seedless grape and molecular maker-assisted breeding[D]. Yangling: Northwest A&F University, 2005. (in Chinese)
[6] 刘巧. 利用胚挽救技术培育抗寒无核葡萄新种质[D]. 杨凌: 西北农林科技大学, 2015.
LIU Q. Breeding new, cold-resistant, seedless grape germplasm using embryo rescue technology[D]. Yangling: Northwest A&F University, 2015. (in Chinese)
[7] 徐丽莹, 张怀明, 金明秋. 100PF-A型葡萄越冬覆土机性能及效益分析. 农业机械, 2004(4): 52.
XU L Y, ZHANG H M, JIN M Q. Performance and efficiency analysis of 100PF-A grape overwintering machine.,2004(4): 52. (in Chinese)
[8] Ramming D W, Emershad R L. In ovulo embryo culture of seeded and seedless(Abstr)., 1982, 17(3): 487.
[9] EMERSHAD R L, RAMMING D W, SERPE M D.embryo development and plant formation from stenospermic genotypes of., 1989, 76(3): 397-402.
[10] EMERSHAD R L, RAMMING D W. Somatic embryogenesis and plant development from immature zygotic embryos of seedless grapes (L.)., 1994, 14(1): 6-12.
[11] 唐冬梅, 王跃进, 赵荣华, 潘学军, 蔡军社, 张剑侠, 张朝红, 骆强伟. 无核葡萄胚挽救中影响胚发育的因子. 中国农业科学, 2009, 42(7): 2449-2457.
TANG D M, WANG Y J, ZHAO R H, PAN X J, CAI J S, ZHANG J X, ZHANG C H, LUO Q W. Factors influencing embryo development in embryo rescue of seedless grapes.,2009, 42(7): 2449-2457. (in Chinese)
[12] CAIN D W, ENERSHAD R L, TARAILO R E.-embryo culture and seedling development of seeded and seedless grapes (L.)., 1983, 22: 9-14.
[13] EMERSHAD R L, RAMMING D W.embryo culture ofL.c.v. ‘Thompson Seedless’., 1984, 71(6): 873-877.
[14] 刘军, 王小伟, 魏钦平, 鲁韧强, 高照全. 世界葡萄抗寒育种的成就与展望. 果树学报, 2004, 21(5): 461-466.
LIU J, WANG X W, WEI Q P, LU R Q, GAO Z Q. Achievements and prospect of world cold-resistant grape breeding., 2004, 21(5): 461-466. (in Chinese)
[15] 屈田田. 葡萄胚挽救育种应用研究[D]. 杨凌: 西北农林科技大学, 2016.
QU T T. Study on the application of grape breeding using embryo rescue[D]. Yangling: Northwest A&F University, 2016. (in Chinese)
[16] 张剑侠, 牛茹萱. 无核葡萄胚挽救技术的研究现状与展望. 园艺学报, 2013, 40(9): 1645-1655.
ZHANG J X, NIU R X. The present situation and prospect of embryo rescue technique research in seedless grape breeding., 2013, 40(9): 1645-1655. (in Chinese)
[17] 孟新法, 张利,张潞生, 张子莲. 无核葡萄胚发育及早期离体培养的研究: Ⅲ. 胚珠接种时期对胚发育的影响. 北京农业大学学报, 1993, 19(1): 45-47.
MENG X F, ZHANG L, ZHANG L S, ZHANG Z L. A study on ovule development of seedless grapes and its early culture: Ⅲ. The effect of inoculation dates on embryo development., 1993, 19(1): 45-47. (in Chinese)
[18] 徐海英, 张国军, 闫爱玲. 无核葡萄育种及杂交亲本的选择. 中外葡萄与葡萄酒, 2001(3): 30-32.
XU H Y, ZHANG G J, YAN A L. The seedless grape breeding and parental selection.,2001(3): 30-32. (in Chinese)
[19] GARCIA E, MARTINEZ A, GARCIA DE LA CALERA E, PEREA L J, CENIS J L, CARRENO J.culture of ovules and embryos of grape for the obtention of new seedless table grape cultivars., 2000, 528: 663-666.
[20] 田莉莉. 抗病无核葡萄胚挽救育种及种质创新[D]. 杨凌: 西北农林科技大学, 2007.
TIAN L L. Breeding for the disease-resistant seedless grape novel varieties and innovation of new germplasms using embryo rescue[D]. Yangling:Northwest A&F University, 2007. (in Chinese)
[21] 赵月玲, 程贯召, 王汉海. 无核葡萄的育种与胚挽救技术的运用. 生物学通报, 2004, 39(9): 15-16.
ZHAO Y L, CHENG G Z, WANG H H. Seedless grape breeding and application of embryo rescue technology., 2004, 39(9): 15-16. (in Chinese)
[22] PONCE M T, AGUERO C B, GREGORI M T, TIZIO R. Factors affecting the development of stenospermic grape () embryos cultured., 2000, 528: 667-672.
[23] 唐冬梅, 蔡军社, 骆强伟, 廖新福, 孙锋, 赵荣华, 符晓敏. 用于无核葡萄选育的胚挽救技术研究. 果树学报, 2008, 25(3): 316-321.
TANG D M, CAI J S, LUO Q W, LIAO X F, SUN F, ZHAO R H, FU X M. Study on embryo rescue technique for seedless grape breeding., 2008, 25(3): 316-321. (in Chinese)
[24] 温晓敏,张娜,路凤珍,田淑芬. 红宝石无核和希姆劳特葡萄杂交胚挽救技术研究. 天津师范大学学报(自然科学版), 2017, 37(5): 32-35.
WEN X M, ZHANG N, LU F Z, TIAN S F. Embryo rescue techniques of the reciprocal cross between Ruby Seedless grape and Himrod Seedless grape., 2017, 37(5): 32-35. (in Chinese)
[25] 宋润刚, 路文鹏, 沈育杰, 金仁浩, 李晓红, 郭振贵, 刘景宽, 林兴桂. 酿酒葡萄新品种‘北冰红’. 园艺学报, 2008, 35(7): 1085.
SONG R G, LU W P, SHEN Y J, JIN R H, LI X H, GUO Z G, LIU J K, LIN X G. A new ice-red brewing grape cultivar ‘Beibinghong’., 2008, 35(7): 1085. (in Chinese)
[26] 皇甫淳, 张辉, 修荆昌, 冯玉才. “双优”两性花山葡萄新品种选育研究. 中外葡萄与葡萄酒, 1994(4): 51-53.
HUANGfu C, ZHANG H, XIU J C, FENG Y C. A study on selection of a new breeding of hermaphrodite grape ‘Shuangyou’., 1994(4): 51-53. (in Chinese)
[27] 黎盛臣, 文丽珠, 张凤琴, 罗芳梅, 杨美容, 张映祝, 黄德藩. 抗寒抗病葡萄新品种——北醇. 植物学报, 1983, 1(2): 28-30.
LI S C, WEN L Z, ZHANG F Q, LUO F M, YANG M R, ZHANG Y Z, HUANG D F. A new grape variety for cold-resistance and disease-resistance——Beichun.,1983, 1(2): 28-30. (in Chinese)
[28] 王爱玲, 王跃进, 唐冬梅, 张剑侠, 张朝红. 提高无核葡萄胚挽救中幼胚成苗率的研究. 中国农业科学, 2010, 43(20): 4238-4245.
WANG A L, WANG Y J, TANG D M, ZHANG J X, ZHANG C H.Research on improvement of seedling rate in embryo rescue of seedless grapes., 2010, 43(20): 4238-4245. (in Chinese)
[29] LAHOGUE F, THIS P, BOUQUET A. Identification of a codominant scar marker linked to the seedlessness character in grapevine., 1998, 97(5/6): 950-959.
[30] MEHIA N, HINRICHSEN P. A new, highly assertive scar marker potentially useful to assist selection for seedlessness in table grape breeding., 2003, 603: 559-564.
[31] 王跃进, 杨英军, 周鹏, 张剑侠, 王西平. 用DNA探针检测我国栽培的无核葡萄及辅助育种初探. 园艺学报, 2002, 29(2): 105-108.
WANG Y J, YANG Y J, ZHOU P, ZHANG J X, WANG X P. Detecting the seedless characteristics of the grapes in China with DNA probe and DNA marker assistant selection., 2002, 29(2): 105-108. (in Chinese)
[32] CABEZAS J A, CERVERA M T, RUIZ-GARCIA L, Carreño J, Martínez-Zapater J M. A genetic analysis of seed and berry weight in grapevine., 2006, 49(12): 1572-1585.
[33] MEJIA N, SOTO B, GUERRERO M, CASANUEVA X, HOUEL C, MICCONO MDE L, RAMOS R, LE CUNFF L, BOURSIQUOT J M, HINRICHSER P, ADAM-BLONDON A F. Molecular, genetic and transcriptional evidence for a role of VvAGL11 in stenospermocarpic seedlessness in grapevine., 2011, 11: 57.
Breeding for Grape Germplasm involved in Seedlessness with Cold-resistant Using Embryo Rescue
ZHAO YaNan1, LUO QiangWei2, WANG YueJin1
(1College of Horticulture, Northwest Agriculture and Forestry University/State Key Laboratory of Crop Stress Biology in Arid Areas/Key Laboratory of Horticultural Plant Germplasm Resource Utilization in Northwest China, Ministry of Agriculture, Yangling 712100, Shaanxi;2Development and Research Centre of Grapes and Melons of Xinjiang Uighur Autonomous Region, Shanshan 838201, Xinjiang)
【Objective】 The objective of this study is to obtain new cold-resistant seedless grape germplasm and improve the breeding efficiency through embryo rescue. 【Method】The different genotypes, basal culture media (MM3 and ER), amino acids (2.5 mmol·L-1cysteine, asparagine, glutamine and serine were addedin MM3 medium) were used to investigate the effect on the embryo development rates and seedling rates from ovules of 7 cross combinations. From the parents, the molecular markers GSLP1-569 and SCC8-1018 for seedlessness and the marker S241-717 for cold-resistance were used to identify the strains with specific bands, and then the three markers were used to screen the hybrids by recognizing the specific bands. 【Result】 Of the 7 combinations, 1 168 ovules cultured in MM3 were obtained 331 embryos and 97 hybrid strains. Among these crosses, ‘Ruby Seedless’ × ‘Beichun’ got the highest embryo development rate and seedling rate, which were 46.00% and 17.33%, respectively. Compared with female parents, for ‘Shuangyou’ as male parent and ‘Blush Seedless’ ‘Thompson Seedless’ ‘Kunxiang Seedless’ as female parents, ‘Kunxiang Seedless’ × ‘Shuangyou’ had the highest embryo development rate and seedling rate, which were 45.39% and 16.31%, respectively. For ‘Beibinghong’ as male parent and ‘Blush Seedless’ ‘Beauty Seedless’ ‘Thompson Seedless’ as female parents, ‘Blush Seedless’ × ‘Beibinghong’ had the highest embryo development rate and seedling rate, which were 33.52% and 6.59%, respectively. Different male parents also influenced seedlings formation. the embryo development rates of ‘Blush Seedless’ × ‘Beibinghong’ and ‘Blush Seedless’ × ‘Shuangyou’ were 33.52% and 39.00%, and the seedling rates of them were 6.59% and 9.50%, respectively. the embryo development rates of ‘Thompson Seedless’ × ‘Beibinghong’ and ‘Thompson Seedless’ × ‘Shuangyou’ were 7.64% and 19.26%, and the seedling rates of them were 1.91% and 8.15%, respectively. The rate of embryo development and seedling of ovule cultured in MM3 medium was higher than that of ER medium. For ‘Kunxiang Seedless’ × ‘Shuangyou’, the ovules cultured in MM3 medium with 2.5 mmol·L-1glutamine showed the highest embryo development rate, which was 59.69%. The seedling rate of ovules cultured in basal media with asparagine and glutamine was 21.43% and 20.93%, respectively. The effect of promoting seedlings development was significant. For ‘Ruby Seedless’ × ‘Beichun’, the ovules in media with 2.5 mmol·L-1asparagine showed the highest embryo development rate, which was 55.71%. The seedling rate of ovules cultured in basal media with asparagine and glutamine was 21.43% and 22.22%, respectively. The effect of promoting seedlings development was significant. By using the molecular markers GSLP1-569 and SCC8-1018 for seedlessness and the marker S241-717 for cold-resistance, 83 hybrid strains from 6 cross combinations were detected, and there were 49 strains with specific bands of the molecular markers linked to the seedlessness, 55 strains with specific bands of the markers S241-717 for cold-resistance. Importantly, 36 strains with both seedlessness and cold-resistance were identified in this study. 【Conclusion】‘Kunxiang Seedless’ and ‘Blush Seedless’ are suitable as the female parents for embryo rescueof seedless grapes. The embryo rescue efficiency of ‘Shuangyou’ as the male parent is higher than that of ‘Beibinghong’. MM3 is suitable for embryo rescue, and the addition of amide acids to MM3 culture medium is helpful to the seedling formation. Among the 83 hybrid strains detected by molecular markers, 36 strains may have the seedless and cold-resistant characteristics.
seedless grape; cold-resistant; embryo-rescue; ovule culture; molecular marker assisted selection
10.3864/j.issn.0578-1752.2018.21.010
2018-05-07;
2018-07-03
国家现代农业产业技术体系建设专项基金(CARS-29-yz-3)
赵雅楠,E-mail:zhaoyanan94@163.com。通信作者王跃进,Tel:029-87082522;E-mail:wangyj@nwsuaf.edu.cn
(责任编辑 岳梅)

